|
Resumen Clásicamente, los pacientes con espondiloartritis (EspA) se clasifican en cinco subgrupos: espondilitis anquilosante (EA), artritis soriásica (AS), artritis asociada con enfermedad intestinal inflamatoria (EII), artritis reactiva y EspA indiferenciada. Si bien no se sabe a ciencia cierta, se considera que la patogenia es multifactorial, debida a la interacción entre factores de riesgo genéticos y desencadenantes ambientales, que producen la activación de la autoinflamación y la autoinmunidad. Este grupo de enfermedades se caracteriza por la inflamación crónica de las entesis y otras estructuras anatómicas, que causa sacroileitis, entesitis y artritis periférica. Otra característica distintiva de la EspA es la asociación con manifestaciones extrarticulares, como soriasis, uveítis y EEI. Los criterios de la Assessment of Spondyloarthritis International Society (ASAS) clasifican la EspA en dos grupos: EspA axial,(que incluye la EA clásica y la EspA axial no radiográfica) y la EspA periférica. El tratamiento de la EspA progresó mucho. La introducción del tratamiento biológico mejoró el pronóstico funcional y clínico de los pacientes. |
El término espondiloartritis (EspA) comprende un grupo heterogéneo de enfermedades con ciertas características en común que las diferencian de otras enfermedades reumáticas: los antecedentes familiares, la patogenia, la asociación con HLA-B27, la relación con infecciones gastrointestinales o genitourinarias y un cuadro clínico similar caracterizado principalmente por entesitis, sacroileitis y artritis.1
El grupo comprende la espondilitis anquilosante (EA), la artritis soriásica (AS), la artritis asociada con la enfermedad intestinal inflamatoria (EII), la artritis reactiva y la EspA indiferenciada.1 Sin embargo, en la fase inicial de la enfermedad puede ser difícil clasificar a los pacientes. Los criterios de la Assessment of Spondyloarthritis International Society (ASAS) permiten clasificar a los pacientes con EspA según los síntomas predominantes en: EspA axial (Figura 1) y EspA periférica (Figura 2).2-4

Figura 1. Evaluación de los criterios de clasificación de la Spondyloarthritis International Society para la espondiloartritis axial. Para emplear en pacientes con lumbalgia ≥3 meses y edad de inicio <45 años. 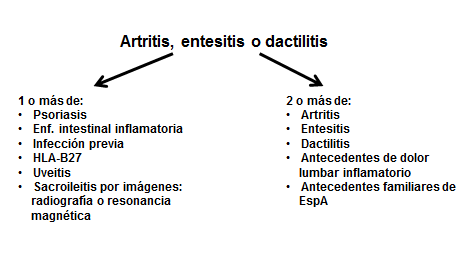
Figura 2. Evaluación de los criterios de clasificación de la Spondyloarthritis International Society para la espondiloartritis periférica.
≈ EPIDEMIOLOGÍA
La prevalencia de EspA depende de los antecedentes genéticos, especialmente la frecuencia de HLA-B27, la etnia y la distribución geográfica de la población en estudio. Por lo tanto la prevalencia varía y se estima que es del 0,1–2,5%.
≈ PATOGENIA
La patogenia es el resultado dela compleja interacción entre los factores de riesgo genéticos y los desencadenantes ambientales que activan la autoinmunidad y la autoinflamación.
► Factores de riesgo genéticos
La herencia es poligénica y se relaciona con varios factores genéticos. La posibilidad de heredar la EA es >90%.6 Los familiares de primero, segundo y tercer grado de pacientes con EA tienen un riesgo relativo del 94%, 25% y 4%, respectivamente, de sufrir la enfermedad.7
La importancia de la microbiota intestinal anormal y de las infecciones en la aparición de la enfermedad articular se confirmó en varios estudios
Los principales factores genéticos asociados con la EspA son:
Genes CMH
El HLA-B27 es al factor genético más importante en la EA. Está presente en el 85–95% de los pacientes blancos con EA, aunque sólo el 7–8% de los portadores de HLA-B27 en la población general sufren EA.8 El HLA-B27 también se asocia en menor grado con otras formas de EspA 7,9. El HLA-B27 está codificado por un alelo clase I de la región HLA-B del complejo mayor de histocompatibilidad. Varias hipótesis diferentes explican la función del HLA-B27 en la patogenia de la EspA.
► Hipótesis de los péptidos artritogénicos
Ciertos péptidos microbianos muy similares a los autopéptidos podrían imitarlos y causar reactividad de los linfocitos T, produciendo autorreactividad y enfermedad autoinmune. 10-12 La validez de esta hipótesis se cuestiona, ya que ratones con HLA-B27 pueden sufrir artrosis en ausencia de células T CD8+.13
► Hipótesis de los homodímeros de cadena pesada
Las cadenas pesadas de HLA-B27 pueden formar dímeros estables que afectan a los receptores de varios tipos de células de manera diferente a la estructura convencional de modo que pueden ser reconocidas por los receptores de los linfocitos citolíticos naturales, creando un proceso inflamatorio. Los receptores leucocitarios que podrían reconocer a los homodímeros son: LILRA1, LILRB2, KIR3DL1 y KIR3DL2.14
► Hipótesis del plegado erróneo de HLA-B27
Debido a varios motivos, el proceso de plegado de HLA-B27 es más lento que otros alelos de HLA y podría generar proteínas de plegado erróneo que se acumulan en el retículo endoplásmico, provocando activación de la autofagia y la vía IL23/17.14
Se caracterizaron más de 100 subtipos de HLA-B27, si bien no todos tienen el mismo grado de asociación con la EspA/EA. B27:02, 04 y 05 tienen fuerte asociación con la EA. Otros alelos de HLA-B, como HLA-B60, B39, B38, y B40 se asociaron con la EA.14
► Genes no CMH
Estudios de asociación del genoma completo involucraron a varios genes en la patogenia de la EspA agrupados en varias clases funcionales.
Polimorfismos en la aminopeptidasa 1 y 2 del retículo endoplásmico (ERAP1 y ERAP2 por las siglas del inglés) tienen una fuerte asociación con la EspA. Aún no se sabe el mecanismo por el que ERAP1 predispone a la EspA, ni tampoco el mecanismo por el que ERAP2 afecta el riesgo de sufrir la enfermedad.
► Vía de IL17/23
Estudios de asociación del genoma completo identificaron la asociación con genes para el receptor de IL23 (IL23R), así como la tirosina cinasa 2 (TYK2) y el transductor de señales y activador de la transcripción (STAT3), que participan en la vía de IL23R. Nuevas opciones terapéuticas contra estos blancos fueron eficaces.16
Otros genes no-CMH implicados son la familia del gen receptor del factor de necrosis tumoral (TNF por las siglas del inglés) y los genes que modulan la activación y la diferenciación de los linfocitos CD4+ o CD8+.
► Desencadenantes ambientales
La importancia de la microbiota intestinal anormal y de las infecciones en la aparición de la enfermedad articular se confirmó en varios estudios. De los pacientes con EII el 10–20% sufre sacroileitis y muchos pacientes con EA tienen lesiones inflamatorias microscópicas en la biopsia sin padecer síntomas. En otros casos, como la artritis reactiva y el síndrome de Reiter, la artritis aparece poco después de una infección gastrointestinal o genitourinaria.16
La importancia del estrés mecánico en la inflamación y la formación de hueso se analizó ampliamente en la literatura sobre la patogenia de la EspA. El “complejo sinovio-entésico” representa la integración sofisticada entre las inserciones y la sinovial adyacente. Los fibrocartílagos en las inserciones son proclives al microdaño o a la reparación tisular aberrante que se puede manifestar como tenosinovitis o sinovitis adyacente, debido a que la sinovial es rica en células inmunitarias y a su capacidad para experimentar hiperplasia y crecimiento intravascular.
Debido a esto la entesis es un lugar preferencial donde las moléculas de las bacterias se pueden depositar. El microdaño y la deposición bacteriana en el contexto de HLA-B27 podrían llevar a los cambios inflamatorios característicos de la EA. La secuencia de inflamación entésica seguida de formación de nuevo hueso no está demostrada formalmente, aunque estudios de resonancia magnética (RM) sugieren que la formación de nuevo hueso se produce preferencialmente en las lesiones inflamatorias avanzadas de la columna, caracterizadas por procesos reparativos, como la esclerosis ósea.18
Las lesiones agudas se resuelven sin secuelas, pero en las lesiones inflamatorias crónicas, la resolución del proceso produce metaplasia grasa y formación de hueso, por lo tanto el estrés mecánico participa en la progresión de la enfermedad.19
Modelos en animales mostraron la etiología multifactorial de la EspA con modelos de estrés genómico (HLA-B27), microbiano y biomecánico dando forma a los fenotipos de la enfermedad.
≈ CUADRO CLÍNICO
En los pacientes con EspA axial la lumbalgia es característica. Los pacientes con EspA axial o periférica pueden sufrir artritis, entesitis y dactilitis.
► Lumbalgia
La lumbalgia crónica afecta aproximadamente al 20% de la población general, pero una proporción reducida de estos pacientes sufre EspA axial. 21 Por lo tanto, la lumbalgia de la EspA axial se describe como ‘lumbalgia inflamatoria’. Se la halla en el 70–80% de los pacientes con EspA axial y se caracteriza por: edad de inicio <45 años, inicio insidioso, evolución >3 meses, mejora con el movimiento y con los antiinflamatorios no esteroides (AINE), pero no con el reposo22.
Se asocia con rigidez matinal y dolor nocturno. La etapa inicial de la enfermedad es intensa y el dolor se puede irradiar a la columna dorsal o la pelvis. La sacroileitis se puede manifestar como dolor alternante en ambas zonas glúteas y es muy específico para la EspA axial y la EA. También puede estar afectada la columna cervical y, con menor frecuencia la columna torácica, especialmente en la EA, con pérdida de la amplitud de movimientos.
► Artritis periférica
A menudo afecta las extremidades inferiores, especialmente las rodillas y los tobillos y se asocia con tumefacción. Es aguda, no erosiva, asimétrica y oligoarticular.23 La artritis de cadera y hombros es frecuente en la EA.24
► Entesitis
La entesitis es característica de la EspA. La entesis es el lugar de inserción de los ligamentos, los tendones, la cápsula articular o la fascia en el hueso. El lugar más común de la entesitis es el tendón de Aquiles. También se pueden afectar las crestas ilíacas, las uniones costocondrales del esternón, los trocánteres mayores y las mesetas tibiales. La entesitis produce tumefacción y dolor a la palpación.24
► Dactilitis
La dactilitis es la inflamación total de los dedos y manos y pies, que a veces les confiere aspecto de salchichas. Es sobre todo característica de la AS y de la artritis reactiva, pero no es una característica específica de la EspA. Se la observa en la sífilis, la tuberculosis y la sarcoidosis.25 Puede ser aguda, con signos inflamatorios o crónica, a menudo no dolorosa. La dactilitis puede afectar uno o más dedos de las manos y/o los pies, de manera asimétrica.
► Características no articulares
Las siguientes son características de las enfermedades del espectro de la EspA:
Afectación ocular: La uveítis anterior unilateral es un síntoma de la EspA, especialmente en pacientes HLA-B27y puede ser el motivo de consulta inicial. Suele responder al tratamiento local. También se puede asociar la conjuntivitis transitoria no purulenta 26,27
Enfermedad intestinal inflamatoria: la enfermedad articular relacionada con la EspA es la característica extraintestinal más frecuente de la EII. La EII se diagnostica en el 10% de los pacientes con EA. Por otro lado, la EA se diagnostica en el 3–10% de los pacientes con EII, aunque el 15–50% de los pacientes tienen sacroileitis en los estudios por imágenes. El 60% de los pacientes con EA tienen inflamación microscópica de la mucosa intestinal sin síntomas de EII 28,29
► Otras características clínicas
Son la insuficiencia aórtica, las alteraciones de la conducción, las manifestaciones neurológicas secundarias a fracturas de columna o a subluxación atlantoaxoidea, la amiloidosis y la osteoporosis.20
≈ DIAGNÓSTICO
► Exámenes complementarios
No hay análisis que sean absolutamente específicos de la EspA. Los marcadores más empleados en la práctica son el HLA-B27, la proteína C-reactiva (PCR) y la eritrosedimentación (ESR).
En la mayoría de los grupos étnicos, el >90% de los pacientes con EA y el 50–70% de los pacientes con otras formas de EspA son positivos para HLA-B27 y se los incluye en los criterios de la ASAS. Sin embargo, el HLA-B27 positivo no es por sí mismo diagnóstico de EA o EspA. El HLA-B27 es especialmente útil para el diagnóstico de la EA axial no radiográfica en combinación con la RM. La combinación de sacroileitis grave en la RM con la positividad de HLA-B27 es un excelente factor pronóstico de futura EA.30
La PCR y la eritrosedimentación tienen baja sensibilidad y especificidad. El aumento de la PCR se incluye en la clasificación de EspA axial de la ASAS; sin embargo, el aumento de la PCR y la eritrosedimentación están presentes sólo en el 40–50% de los pacientes con EA.31 Esta proporción puede ser mayor en las formas periféricas como la AS. Es decir que los valores normales de la PCR y la eritrosedimentación no descartan el diagnóstico de enfermedad activa o de EA.
► Datos radiográficos
♦ Radiografías simples. Varios datos característicos se pueden observar en pacientes con EspA, aunque no aparecen en las etapas tempranas de la enfermedad. En la EspA axial, el dato más específico es la sacroileitis. Los pacientes considerados como EspA axial no radiográfica no tienen datos radiográficos de sacroileitis. Los sindesmofitos (osificación originada en los ligamentos intervertebrales que puede unir los cuerpos vertebrales) también son muy específicos de la EspA y se los puede observar en ausencia de sacroileitis.31, 33
En las radiografías de las articulaciones periféricas y las entesis se observan cambios variables según los diferentes tipos de EspA. En la EspA axial, las articulaciones más afectadas son las caderas, donde puede haber extensos cambios destructivos.31 Los cambios radiográficos en las articulaciones periféricas son comunes en los pacientes con AS, incluso en las primeras etapas de la enfermedad. Estos cambios, muy característicos de la EspA, muestran la coexistencia de cambios erosivos con nueva formación ósea dentro de la misma articulación o en diferentes articulaciones dentro del mismo dedo. Erosiones esponjosas se pueden observar en zonas de entesitis en pacientes con EspA, como los talones, aunque no son específicos de ésta.34
♦ Resonancia magnética. La RM es una importante herramienta diagnóstica en las primeras etapas de la enfermedad, cuando aún no se hallan alteraciones en las radiografías simples. Los datos de RM de las articulaciones sacroilíacas se incluyen en los criterios de la ASAS. Se pueden ver lesiones inflamatorias agudas de las articulaciones sacroilíacas, que se observan como edema intenso de la médula ósea en la secuencia short-tau inversion recovery (STIR) o en T2 con imágenes de absorción de grasas. El edema de la médula ósea no es exclusivo de la EspA y puede aparecer en tumores malignos, infecciones y en la osteitis condensante del íleo. En la RM de la columna aparecen lesiones triangulares en uno o más ángulos de las vértebras.31
♦ Otros estudios por imágenes. La ecografía es útil para la entesitis. Muestra imágenes hipoecoicas, aumento del grosor de las inserciones tendinosas, calcificaciones, entesofitos y actividad en el power Doppler 35
► Criterios de clasificación
Los criterios ASAS permiten clasificar a prácticamente todos los pacientes con EspA según los síntomas predominantes en la EspA axial o periférica. Estas clasificaciones también incluyen los datos de la RM y permiten clasificar las formas tempranas y no radiográficas. La sensibilidad de los criterios ASAS para la EspA axial es del 82,95% y la especificidad del 84,4%. Para la EspA periférica, la sensibilidad estimada de los criterios ASAS es del 75% y la especificidad del 82,2%.2-4
≈ TRATAMIENTO
El objetivo principal del tratamiento de la EspA es disminuir la actividad de la enfermedad y detener el daño articular, mejorando la calidad de vida y conservando las capacidades funcionales, la autonomía y la participación social de los pacientes.
El tratamiento farmacológico de la EspA axial es diferente del de la EspA periférica. Los AINE y los bloqueantes anti TNF son la piedra angular del tratamiento de la EspA axial. Los antirreumáticos no biológicos modificadores de enfermedad (nb-DMARDs por las siglas del inglés) son esenciales para la EspA periférica.
► AINE
Según ASAS y la European League against Rheumatism (EULAR), los AINE, entre ellos los antagonistas selectivos de la ciclo-oxigenasa-2, son el tratamiento de primera línea de la EspA, especialmente la EspA axial.36 Con frecuencia la lumbalgia mejora en pacientes con EA tratada con AINE, con respuesta clínicamente significativa en más del 70% de los pacientes.
► Corticoides
Las inyecciones intrarticulares de corticoides se pueden emplear en la monoartritis, la entesitis y la dactilitis. Los corticoides sistémicos no se recomiendan habitualmente para tratar la afectación axial debido a su ineficacia en los síntomas axiales. En la EspA periférica los corticoides sistémicos pueden ser útiles en tratamientos breves en las formas graves con la dosis más baja posible37.
► Antirreumáticos no biológicos modificadores de enfermedad
El metotrexato, el leflunomide y la sulfasalazina son generalmente ineficaces para las manifestaciones axiales, pero son útiles en la EspA periférica. Aunque el metotrexato es el nb-DMARD más empleado, la elección se puede basar sobre las características clínicas del paciente, considerando también la coexistencia de manifestaciones extrarticulares. El metotrexato puede mejorar la soriasis y el metotrexato y la sulfasalazina son útiles para la uveítis o la enfermedad intestinal 37,38
► Antirreumáticos biológicos modificadores de enfermedad
Los tratamientos bloqueantes del TNF-α son el único tratamiento eficaz para los pacientes con EspA axial que no responden al tratamiento de primera línea con AINE. La eficacia de cada uno de los bloqueantes del TNF (adalimumab, infliximab, etanercept, golimumab, and certolizumab pegol) es fuerte y similar para la EA activa.28 La elección depende de la preferencia del paciente, la experiencia del médico con el fármaco, las enfermedades concomitantes y las manifestaciones extrarticulares.
El adalimumab y el etanercept son útiles para tratar la soriasis. El infliximab y el adalimumab mejoran la uveitis.
El infliximab y el adalimumab se emplean en la EII (enfermedad de Crohn y colitis ulcerosa).
El golimumab mejora la colitis ulcerosa y el certolizumab pegol mejora la enfermedad de Crohn.8,27,28
Todos los bloqueantes del TNF-α también son eficaces para la enfermedad periférica que no responde a los nb-DMARDs. El ustekinumab, un anticuerpo monoclonal inmunoglobulina totalmente humano contra el IL-12 a 23 es eficaz para tratar la AS y la soriasis.29 La investigación de nuevos blancos para el tratamiento de la EspA evoluciona constantemente y muchos nuevos fármacos estarán disponibles en breve, mejorando las herramientas terapéuticas para la EspA.
Resumen y comentario objetivo: Dr. Ricardo Ferreira