| Introducción |
La complicación a largo plazo más frecuente y molesta después de la reparación de la hernia inguinal, en las últimas 2 décadas, ha sido la neuralgia crónica post herniorrafia. El término crónica ha sido definido por la International Association for the Study of Pain (IASP) como dolor más allá de los 3 meses después de la reparación herniaria [1].
Algunas revisiones justifican un período más largo, de 6 meses, citando la intensa reacción inflamatoria evocada por las oleofinas sintéticas y su necesidad de disminuir [2]. Entre los pacientes con dolor crónico, existe un subgrupo clínico que experimenta síntomas más específicos de alteraciones en la eyaculación, dolor sexual y orquialgia.
La alteración en la eyaculación (dysejaculation) es definida como una quemazón intensa, una sensación dolorosa que ocurre justo antes, durante o después de la eyaculación. No sólo es sentida como un dolor profundo, sino también como un dolor superficial en toda la región inguinal, un dolor que puede ser lo suficientemente severo para que algunos individuos se abstengan del sexo en conjunto. No se notan hallazgos físicos [3-7].
El dolor sexual y la orquialgia son una incomodidad o dolor vago o distinto, hiperalgesia, disestesia, alodinia, que puede afectar el área inguinal, el eje del pene, la piel escrotal y el testículo. Puede o no acompañarse de alteración en la eyaculación.
| Preámbulo |
La incidencia de dolor crónico post herniorrafia ha sido confirmado a través de publicaciones de varios cirujanos eminentes y más notablemente por aquellas revisiones de Campanelli y col. [3], en un rango entre el 1% y el 53%; del 28,7% para Bay-Nielsen y col. [4]; del 11% al 54% para Valvekens y col. [5]; y del 10% para Aasvang y col. [6].
Una revisión previa de la colaboración EU Trialist, señaló una incidencia del dolor del 13,8% después de la reparación herniaria totalmente extraperitoneal y del 19% después de las reparaciones abiertas [7].
Ese amplio espectro en la incidencia se debe a la falta de definición y estandarización del momento del dolor, tipo de dolor, escalas de dolor, y definiciones de dolor leve, moderado y severo; tipo de reparación con o sin malla, abierta o laparoscópica; si los nervios fueron identificados, seccionados, o dejados intactos; peso de la malla, tipo de tejido; naturaleza de la fijación de la malla: suturas, tachas, pegamento, etc.
¿Fue resecado algún nervio? ¿Cuál o cuáles estaban en contacto con la malla? ¿Los nervios fueron simplemente cortados, con los extremos ligados o el muñón sepultado en la masa muscular?
No obstante, la mayoría de los estudios parece estar de acuerdo de que el tipo de dolor crónico que es lo suficientemente severo para provocar un cambio en el estilo de vida, para causar una discapacidad grave en las actividades ordinarias o hacer la vida intolerable, se sitúa por encima del 10% al 12% [1,2,6-11], mientras que para Loos y col. [12], representa el 21%.
En América del Norte, donde aproximadamente 1,1 millón de pacientes son sometidos a reparación herniaria anualmente [13], se puede esperar más de 100.000 pacientes que buscarán alguna forma de terapia de alivio a través de clínicas del dolor y, quizás no con la frecuencia suficiente, la eventual remoción de la malla causante.
El objetivo del presente estudio fue tomar un enfoque clásico en la búsqueda de las causas de la alteración de la eyaculación, dolor sexual y orquialgia. Por clásico, los autores se refieren a un retorno a la antigua técnica de observación mediante el uso de un microscopio.
Previamente, los autores han estudiado la interacción entre el cuerpo y la malla, como ocurren dentro de la malla [14-16]. El hallazgo más significativo en relación con el dolor crónico fue el crecimiento del nervio en el tejido cicatricial, incluyendo dentro de la malla, como una respuesta curativa del cuerpo.
Actualmente se enfocaron sobre la etapa siguiente de las interacciones malla-cuerpo, los efectos de la malla sobre los tejidos adyacentes al área inicial de curación, específicamente, los efectos de la migración de la malla sobre las estructuras anatómicas encontradas en el camino del movimiento de la malla, o el movimiento de los tejidos hacia la malla.
Han hipotetizado que después de una reparación inguinal abierta, todo el conducto deferente y sus cubiertas pueden ser afectados por la migración de la malla dentro del canal inguinal, o el conducto deferente desnudo en el espacio preperitoneal después de una reparación laparoscópica.
Para comprobar esa hipótesis, apuntaron al examen de especímenes explantados de mallas que podían incluir al conducto deferente y otros componentes del cordón espermático. Es más fácil decirlo que hacerlo, porque es raro e inusual que los cirujanos remuevan un conducto deferente de pacientes que sufran una inguinodinia crónica post herniorrafia, alteración de la eyaculación, u orquialgia.
De hecho, parecería ser una cuestión de honor, orgullo y competencia salvar los conductos deferentes traumatizados, separándolos de la masa leñosa que se forma con la malla y las cicatrices fibrosas.
La preservación del deferente y del testículo a toda costa simboliza un elemento de nuestra psique social, lo que explica la escasez de especímenes! Otra cuestión planteada en este estudio es si dejar un conducto deferente severamente dañado, que se erosionará, se fibrosará más, se distorsionará y se pegará rígidamente a la malla y a la pared posterior del canal inguinal, podría constituir posiblemente una fuente continua y deteriorante de incomodidad y dolor!
| Métodos |
Después de la aprobación del St. Michael´s Hospital Research Ethics Board, se buscó la información clínica de especímenes consecutivos de malla herniaria recibidos durante el período entre enero de 2013 y abril de 2016 en la División de Patología, para los siguientes criterios de inclusión: malla de punto de monofilamento de polipropileno, resecada por dolor crónico postoperatorio después de una reparación de hernia inguinal previa, y descripción intraoperatoria del compromiso del cordón espermático y/o el conducto deferente por la malla. Un total de 13 especímenes llenaron los criterios de inclusión.
Doce especímenes fueron recibidos en consulta de la contribución de los cirujanos listados como coautores, y 1 espécimen como consulta médicolegal. Los especímenes fueron examinados macroscópicamente para identificar los conductos deferentes y se seccionaron en serie de forma perpendicular al eje del vaso.
Cuando el conducto deferente no se identificó macroscópicamente, el corte se hizo perpendicularmente a los vasos más grandes u otras estructuras que potencialmente representan componentes del cordón o remanentes. El procesamiento de los tejidos y la tinción se realizaron de acuerdo con los métodos anatomopatológicos diagnósticos estándar descritos previamente [15].
De manera resumida, el tejido fue fijado en formalina tamponada neutra 10% por al menos 48 horas, muestreado en tres bloques, procesado en un procesador Tissue-Tec VIP5 (Sakura Finetek USA, Inc., Torrance, CA, USA), de acuerdo con los procedimientos operativos estándar del laboratorio; fue cortado a 4 µm, y teñido con hematoxilina y eosina (H&E), luego se procedió a digestión enzimática durante 4 minutos con inmunoperoxidasa para proteína S100 (DAKO Z0311 [Agilent Technologies, Santa Clara, CA, USA], seguido de incubación por 16 minutos y dilución 1:1000; Ventana Benchmark XT, Ventana Medical Systems, Inc., un miembro de Roche Group, Tucson, AZ, USA), para la identificación del nervio; y desmina (Dako, Clone:D33, dilución 1/30, recuperación HIER-CCI a los 36 minutos, tiempo de incubación: 16 minutos a 37ºC) para la identificación del músculo en el deferente..
La significación de la diferencia entre los parámetros evaluados fue valorada usando la prueba exacta de Fisher para datos categóricos y la prueba de Mann-Whitney para los datos continuos, de 2-colas.
| Resultados |
Todos los 13 especímenes fueron resecados para tratar el dolor crónico post herniorrafia. La mediana de la edad de los pacientes fue de 52 años (rango: 23 a 72). La malla fue colocada laparoscópicamente en 5 pacientes y de manera abierta en los 8 restantes. En 4 casos, se usó un tapón (plug) para la reparación inicial.
En todos los casos, la malla fue de monofilamento de polipropileno convencional, diseñada con un tamaño de poro de 1,5 a 2 mm (diámetro de la fibra y espacio dentro del rango de peso medio-pesado). La mediana del intervalo entre el implante y la remoción de la malla fue de 59 meses (rango: 8 a 176). Los registros mostraron que 6 pacientes reportaron dolor sexual de presentación variable y 3 describieron específicamente alteración en la eyaculación.
Intraoperatoriamente, en 4 casos, el deferente fue separado tediosamente de la malla y dejado in situ, mientras que sólo la malla fue resecada. En los restantes 9 casos, el deferente no pudo ser separado de la malla. De los 9 casos, en 3 pacientes el deferente fue “salvado”, dejándolo in situ con una tira de malla invadiéndolo, En los restantes 6 casos, la decisión del cirujano fue resecar el deferente junto con la toda la malla (Fig. 1).

FIGURA 1: Apariencia macroscópica de la malla con el deferente (señalado con las puntas de flecha), resecada después de una colocación laparoscópica (A) y de una abierta (B). En A, el deferente está parcialmente invadido por la malla e incrustado en tejido cicatricial. El espécimen fue seccionado a través del eje del deferente para examen microscópico (Fig. 2). En B, el deferente está incorporado en un pliegue complejo de la malla. Las secciones histológicas se muestran en la Fig. 3.
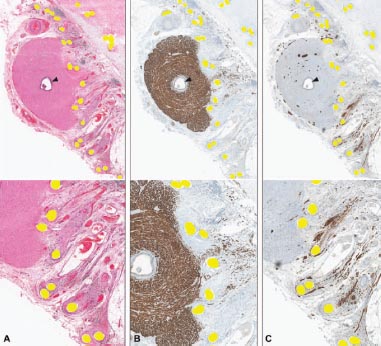
FIGURA 2: Secciones microscópicas del espécimen mostrado en la Fig. 1, de una malla colocada laparoscópicamente. Los cortes del mismo bloque están teñidos con 3 colorantes: H&E (A), desmina (B), y S100 (C); las fibras de la malla se ven en amarillo, la luz del deferente está indicada con puntas de flecha; magnificación de 40x en la parte superior de cada panel y agradamiento de 100x en la mitad inferior. En A, las fibras de la malla claramente erosionan dentro del deferente; por lo tanto, no pudo ser separado intraoperatoriamente de la malla. Nótese el rastro de cicatrices, inflamación y capilares sanguíneos estirados que quedan detrás de las fibras de malla migradas. En B, la tinción con desmina muestra la capa muscular del deferente (marrón oscuro). El músculo está siendo reemplazado por tenido cicatricial y la malla se mueve a través del conducto. Obsérvense fibras musculares residuales dispersas sobre la derecha detrás de la malla avanzando (migrando hacia la izquierda). En C, la tinción con S100 resalta los nervios (marrón oscuro) que están estirados e interrumpidos por las fibras migratorias de la malla.
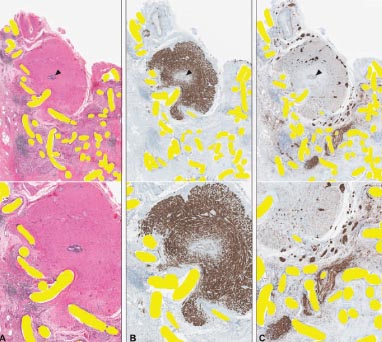
FIGURA 3: Malla resecada después de una reparación herniaria abierta. Los cortes del mismo bloque están teñidos con 3 colorantes: H&E (A), desmina (B), y S100 (C); las fibras de la malla se ven en amarillo, la luz del deferente está indicada por puntas de flecha; magnificación de 40x en la parte superior de cada panel y agradamiento de 100x en la mitad inferior. En A, como en el espécimen anterior, las fibras de la malla claramente erosionan dentro del deferente. La malla tiene una configuración plegada más compleja que después de una reparación laparoscópica. En B, la tinción con desmina muestra la capa muscular del deferente (marrón oscuro). El músculo es reemplazado por tejido cicatricial a medida que las fibras de la malla erosionan dentro del conducto deferente. En C, la tinción con S100 resalta los nervios (marrón oscuro). Obsérvense los nervios más grandes lejos del deferente. Estos nervios más grandes están en consonancia con la inervación somática. Uno está severamente distorsionado e interrumpido por la malla formando una lesión de tipo neuroma (agrandada en la parte inferior).
Microscópicamente, en los 6 casos en donde la impresión del cirujano fue que el conducto deferente había sido resecado, el mismo fue identificado sólo en 3 especímenes (50%). Las posibles causas por las que el deferente no fue identificado en los restantes 3 especímenes incluyeron la transmigración de la malla a través del conducto con su reemplazo fibroso completo.
El examen anatomopatológico de los 3 especímenes que incluían al deferente mostró una evidencia clara de migración y erosión dentro del vaso (Figs. 2-4). Una malla fue resecada después de implante laparoscópico (Fig. 1 y 2).
En ese espécimen, la primera estructura importante en el camino de migración de la malla fue el plexo de la mayoría de los nervios autónomos que rodean al conducto deferente en su superficie (Fig. 2C). En los 2 casos de implante a cielo abierto, había nervios más grandes, concordante con la inervación somática localizada más periféricamente al deferente (Fig. 3C).
En uno de esos especímenes, la migración de la malla causó una severa distorsión y disrupción de un nervio grande ocasionando una lesión de tipo neuroma. En los 3 especímenes, parecía que la rigidez general de la estructura del conducto impidió el colapso de la luz del deferente, incluso en los sitios de penetración avanzada de la malla.
A medida que la malla erosionó la capa muscular del deferente, el músculo del conducto fue reemplazado por tejido cicatricial, a medida que la malla avanzaba a través de la pared del mismo. Las Figuras 2B y 3B muestran la desaparición de la tinción marrón del músculo del deferente detrás de borde de avance de la malla (el tejido cicatricial está contrastado azul claro).
En un caso, el tratamiento incluyó epididimectomía y orquiectomía antes de la remoción de la malla en una sesión diferida. Inicialmente, el epidídimo fue resecado por dolor testicular debido a la sospecha de una epididimitis crónica sin respuesta a los antibióticos. L
uego, se llevó a cabo la orquiectomía por la continuación del dolor testicular. Los especímenes mostraron características de obstrucción proximal: hidrocele, espermatocele, congestión venosa y atrofia testicular segmentaria post obstructiva (Fig. 5).
No había inflamación apreciable. La malla fue removida posteriormente junto con el muñón del cordón espermático; sin embargo, no fueron histológicamente reconocibles las estructuras del cordón en el espécimen. Se sospechó que había sufrido una obliteración fibrosa.
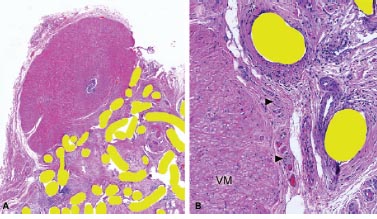
FIGURA 4: Malla resecada después de una reparación herniaria abierta. H&E, A – 40x, B – 100x. En A, el tercer espécimen que contiene una porción identificable del deferente mostró las mismas características que los 2 anteriores. El punto de penetración más profundo está en la hora 4 de la luz del conducto. Comparar el espesor residual en la posición de las hora 4 y el espesor de la porción intacta del deferente de la hora 7 a la hora 1 siguiendo el sentido de las agujas del reloj (mitad superior izquierda). En B, un sitio con daño inminente de los nervios autónomos (señalado con puntas de flecha) en la superficie del músculo del conducto (VM en la figura).
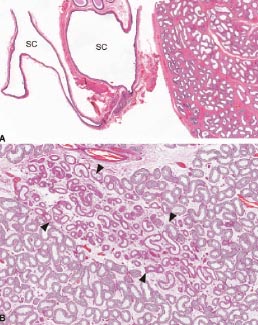
FIGURA 5: Especímenes de resección del epidídimo (A) y orquiectomia (B). Coloración con H&E, A – 40x, B – 100x. En A, la resección fue por dolor testicular e impresión clínica de epididimitis crónica. El espécimen mostró espermatocele (espacios marcados con SC), sin inflamación apreciable en el epidídimo (sobre la derecha). En B, atrofia testicular segmentaria (entre puntas de flecha), un cambio post obstructivo típico en el parénquima testicular.
El análisis estadístico mostró tendencia de un compromiso más avanzado del deferente en los pacientes que reportaron dolor sexual y/o alteración en la eyaculación. El conducto deferente no pudo ser separado de la malla en todos esos pacientes (100%), versus 43% de los pacientes que no reportaron dolor sexual (P = 0,07). Hubo también un abordaje quirúrgico más agresivo en los casos en donde los pacientes reportaron dolor sexual o alteración en la eyaculación.
La decisión de resecar el deferente se tomó en el 83% (5 de 6) de los pacientes con dolor sexual, mientras que el conducto fue resecado sólo en 1 caso (14%) de los 7 pacientes que no se quejaron de dolor sexual (P = 0,03). Comprensiblemente, la decisión intraoperatoria de resecar el conducto deferente parece estar influenciada por la edad del paciente.
La mediana de la edad en el grupo en donde el conducto fue preservado, ya sea disecándolo de la malla o dejándolo con una porción de la malla en su cuerpo, fue de 41 años (rango: 23 a 53), versus 60 años (rango: 37 a 72) en el grupo en donde la decisión fue de resecar el conducto (P = 0,04).
No hubo una asociación detectable entre los otros parámetros analizados y la edad de los pacientes o la lateralidad de la reparación inguinal. Tampoco hubo una diferencia significativa para los parámetros evaluados en términos de reparación laparoscópica versus reparación abierta o el uso de un tapón.
| Discusión |
Las investigaciones de los autores mostraron que la migración de la malla constituye un mecanismo para el desarrollo de complicaciones postoperatorias tardías, como la alteración en la eyaculación, dolor sexual y orquialgia.
La migración de la malla ha sido reconocida en publicaciones previas y se han propuesto definiciones de migración primaria y secundaria [17,18]. La migración primaria fue propuesta como el movimiento de una malla no asegurada hacia el tejido de menor resistencia, intra o inmediatamente después de la operación.
La migración secundaria fue descrita como la erosión de la malla a través de los tejidos y planos transanatómicos siguiendo la cicatrización postoperatoria. Este último es un proceso a lo largo de la vida causado por las fuerzas tisulares actuando para desplazar la malla, y por el entorno haciendo posible el movimiento: la reabsorción de los tejidos facilitada por la inflamación contra un cuerpo extraño y la habilidad universal de los tejidos para la remodelación.
Por defecto, la migración secundaria resulta en daño tisular. En su experiencia, los autores han visto moverse mallas a gran distancia en el cuerpo y transmigrar a través de órganos, indicando que no hay estructura anatómica – excepto quizás el hueso – que pueda brindar una barrera natural permanente para resistir el efecto erosivo (Fig. 6).
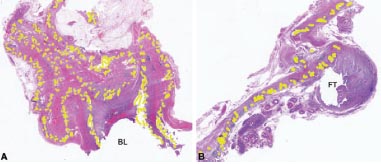
FIGURA 6: Habilidad de la malla para migrar a través de grandes distancias y transmigrar a través de órganos; ambas imágenes son secciones teñidas con H&E, con magnificación 10x (A) y 16x (B). En A, se encontró la malla varios años después de una reparación de hernia umbilical, deslizada hacia abajo y plegada contra la vejiga. Los bucles de avance transmigraron a través de la pared de la vejiga dentro de su luz (BL). En B, otra malla después de una reparación de hernia umbilical. Durante una revisión, se la encontró penetrando a través de la trompa de Falopio (FT) y el mesosalpinx.
Los hallazgos previos de los autores indicaron que las ramas nerviosas pueden crecer dentro de la malla y que su densidad se correlaciona con el desarrollo de dolor crónico. En el presente estudio, las observaciones indicaron que un gran número de ramas nerviosas pueden ser involucradas pasivamente, mediante la migración de la malla.
Es necesario tener presente que en estos casos, los nervios descritos pueden verse sólo por métodos histológicos, dado que están sepultados dentro de la malla y del tejido cicatricial. Además, las ramas nerviosas recién formadas son demasiado pequeñas para ser observadas a simple vista.
Los segmentos proximales más grandes de los nervios involucrados podrían ser visibles externamente al tejido cicatricial y la malla, como normales o, quizás, como nervios edematizados. Por lo tanto, un examen macroscópico intraoperatorio podría no revelar la extensión completa del compromiso del nervio.
La inervación del cordón espermático y sus componentes es bastante compleja. La porción preperitoneal del conducto deferente es acompañada por los nervios espermáticos autónomos del plexo pélvico, que son ramas del plexo hipogástrico superior (L1-L2). En el canal inguinal, la inervación se une al plexo espermático que corre desde el nivel renal a lo largo de la arteria espermática interna (D10-L2).
Los nervios autónomos corren principalmente sobre la superficie del deferente e inervan el testículo y el epidídimo. Lejos del deferente están los nervios somáticos: iliohipogástrico, ilioinguinal y las 2 ramas del nervio genitofemoral, que son bien conocidas por los cirujanos, siendo aconsejable recordar las variaciones y la ocasional ausencia de la rama genital, que invariablemente es reemplazada por ramas distales del nervio ilioinguinal [19].
Las mismas inervan la túnica vaginalis, la región inguinal, la piel del escroto, y el periné (L1-L2, S2-S3) [20,21]. Esa inervación rica y compleja brinda subsecuentemente múltiples oportunidades para la lesión de los nervios a diferentes niveles y localizaciones, ya sea durante el procedimiento quirúrgico o debido a la proximidad de la malla a los nervios.
Como bien lo han observado los cirujanos en la práctica clínica, una triple neurectomía, ya sea mediante abordaje abierto o laparoscópico preperitoneal, no garantiza que se resolverá el dolor [22-25]. Vale la pena señalar que la inervación autónoma es muchas veces pasada por alto mientras se enfatiza sobre los nervios somáticos durante la reparación inicial de la hernia, y luego como un objetivo para la neurectomía.
Además de pasar por alto la inervación autónoma, tampoco se le brinda la consideración adecuada al flujo neurovascular colateral. Como ha sido mostrado por Wantz [26], es muy rico e involucra a ramas de los nervios pudendos interno y externo, y a los plexos prostático y vesical superior e inferior.
Este último se une al plexo sobre los conductos deferentes hasta el nivel del testículo y la piel escrotal y la parte superior del muslo [26]. También parece haber un malentendido sobre los procesos reparativos que siguen a la cirugía.
Es necesario recordar que los axones interrumpidos intentan normalmente volver a crecer después del trauma, incluyendo los causados por la reparación herniaria inicial, la migración de la malla, o la neurectomía. Algunos axones fracasarán en alcanzar sus objetivos y se volverán atróficos, algunos alcanzarán sus objetivos y restaurarán la inervación, y otros formarán un neuroma. Todos esos escenarios pueden coexistir, y los dos últimos conllevan el riesgo del dolor [14,15].
Como fue observado, los nervios somáticos están más lejos del conducto deferente, por lo tanto, se involucran antes por la malla suprayacente que migra a través de los tejidos de la ingle. La inervación autónoma corre principalmente por la superficie del deferente y dentro de su músculo. Esas ramas se dañarán justo antes o al mismo tiempo que la musculatura del conducto.
La luz del deferente sólo es afectada en los estadios tardíos de transmigración de la malla a través del conducto, después de que la inervación somática y autónoma y las capas musculares han sido dañadas.
Esos hallazgos indican que la obstrucción del deferente no es un mecanismo necesario o principal para el dolor y la alteración en la eyaculación; por el contrario, el compromiso nervioso y muscular deben ser considerados como los enlaces fisiopatológicos.
El compromiso de los nervios brinda un mecanismo obvio para el desarrollo del dolor, mientras que la irritación del músculo del conducto y su inervación autónoma puede tener un efecto similar al del cólico biliar o renal, cuando el peristaltismo o el movimiento de la malla pueden disparar un dolor relacionado con el espasmo.
Teniendo en cuenta este conocimiento de fondo, los intentos valientes pero desesperados de rescatar remanentes del conducto deferente o restos, como uno los podría llamar, están posiblemente en la raíz del dolor ocasionado en el 1% al 3% de los pacientes cuyo dolor empeoró, o en el 8% de los pacientes cuyo dolor ha quedado sin cambio, después de la remoción de la malla [27].
También debe subrayarse que, mientras que con la reparación puramente tisular, la incidencia de alteración en la eyaculación era de 1 en 2500 (0,04%), esa incidencia en presencia de una malla es del 3,1% [29], un aumento de cerca del 8000%! La remoción de la malla se está volviendo un procedimiento más frecuente como una medida última para controlar la inguinodinia crónica severa, así como la orquialgia y la alteración en la eyaculación [2,3,5,11,22].
No es solo de importancia histórica, sino también de importancia clínica relevante, que la alteración en la eyaculación, cuando fue reportada originalmente en abril de 1992, consistió en 15 casos después de reparaciones puramente tisulares. El dolor se resolvió espontáneamente en todos los pacientes. El tiempo más largo para su resolución fue de 5 años [28].
En consecuencia, la recomendación fue resistir a cualquier intento de intervención quirúrgica. Con la malla de polipropileno en el canal inguinal o en el espacio de Bogros, el tiempo sólo promoverá mayor penetración de la malla en el cordón espermático.
Ese proceso es irreversible y el dolor probablemente no se resolverá, a menos que se reseque la malla y el cordón espermático. La alternativa puede ser, como probablemente ha sido el caso con algunos pacientes, tolerar el dolor lo mejor que se pueda, hasta la sustitución del cordón espermático invadido y destruido por tejido cicatricial fibrótico.
Como se ha observado, el conducto deferente puede ser completamente invadido por la malla sin dejar músculo residual reconocible. Se ha sospechado que esa pudo haber sido una de las causas potenciales de “desvanecimiento del deferente”, en los 3 casos en los que se pensó que se había resecado el conducto pero que no fue hallado en el espécimen.
En relación con la orquiectomia y la resección del epidídimo, como procedimientos destinados a tratar la orquialgia, es pertinente puntualizar, como se ha visto en casos clínicos, que la orquiectomia por si sola puede no erradicar el dolor testicular.
El deferente necesita ser resecado también, dado que contiene los remanentes de los nervios que anteriormente inervaban al testículo, creando así un “dolor de testículo fantasma”. Por el contrario, bien puede ser que la resección sólo del conducto deferente pueda aliviar el dolor testicular. Con la resección del conducto espermático, puede esperarse que dos tercios de los testículos sobrevivan [30,31].
La neuralgia post herniorrafia es un síndrome relativamente nuevo que se ha vuelto más definido desde 1998, cuando fue reportado por primera vez por Bocchi [32] (7,6% de 1000 reparaciones con técnica de Lichtenstein) y que él designó como “dolor tardío postoperatorio”. Antes del uso de la malla, el dolor inguinal crónico fue raro o desconocido.
Hasta la 4º edición del libro Hernia (Editores Nyhus & Condon; Lippincott, 1995), página 215, Nyhus decía: “Los problemas de dolores neurológicos persistentes después de una reparación de hernia inguinal son raros pero deben ser tomados con seriedad.
Cada año en los Estados Unidos son reparadas cerca de 400.000 hernias, sin embargo, incluso en la serie mayor de reportes de dolor después de una hernia inguino-femoral en los EEUU, hay sólo 17-23 casos. Por lo tanto, este debe ser un riesgo remoto de la cirugía, y como tal, los pacientes no deben ser advertidos al respecto”. Sólo en la 5° edición del año 2002, el nuevo equipo editorial de Fitzgibbons y Greenburgh incluyó un capítulo sobre el dolor crónico, realizado por John Cunningham, reportando una incidencia del 5% al 15%.
En el libro de Joseph Ponka de 1980 (WB Saunders), el autor menciona el compromiso y el atrapamiento de los nervios ilioinguinal y genitofemoral en el tejido cicatricial como una causa del dolor (páginas 601-602) y lo describe como “infrecuente” en media columna!
| Conclusiones |
Los resultados de este estudio han confirmado que la migración de la malla a través de las capas de revestimiento del cordón espermático y del conducto deferente tiene efectivamente lugar y juega un rol en el desarrollo de la alteración en la eyaculación, dolor sexual y orquialgia. Los intentos para preservan en cada situación el conducto deferente pueden no estar justificados, dado que los daños causados por la malla y la cicatrización residual son irreversibles.
Puede ser inesperado para muchos conocer que el cordón espermático puede, de hecho, ser completamente invadido por una malla y reemplazado por tejido cicatricial. Descubrir que la malla puede continuar su daño lento a los tejidos durante muchos años después de su implante, es una posibilidad con la que los cirujanos no se sentirán cómodos. Sin embargo, es una realidad que debe ser aceptada hasta el momento en que se descubra un nuevo reemplazo de tejido más compatible con los tejidos de los mamíferos.
Lo más desalentador será la decepción de muchos cirujanos que se han referido tan generosamente a Theodor Billroth y su tan citada observación de 1878 que: "si se pudiera encontrar un reemplazo ideal de tejido, el problema de la hernia ya no existiría". El polipropileno no cumplió con la expectativa de Billroth de un "reemplazo tisular" ideal y, por lo tanto, la búsqueda debe continuar de forma urgente, implacablemente! [33].
Comentario y resumen objetivo: Dr. Rodolfo D. Altrudi