|
Resumen:
|
Introducción
La neumonía asociada a la ventilación mecánica (NAVM) es una de las infecciones intrahospitalarias más frecuentes en las Unidades de Cuidados Intensivos (UCI) y se asocia con mayor morbi-mortalidad, prolongación de la estadía hospitalaria e incremento del consumo de antimicrobianos (50%) con el consecuente aumento del riesgo de resistencia antimicrobiana1.
La mortalidad atribuible a NAVM es controvertida, debido a la vulnerabilidad de los pacientes en unidades críticas, aunque se estima entre 5-25%1.
Según el informe del Programa Nacional de Vigilancia de Infecciones Hospitalarias de Argentina (VIHDA)2, en el 2016 la tasa alcanza el 12.4/1000 días de asistencia ventilatoria mecánica (AVM) para UCI polivalentes, por lo que el abordaje de esta infección constituye una prioridad.
El objetivo principal de este documento es establecer recomendaciones basadas en la bibliografía y en la opinión de expertos locales sobre el diagnóstico, tratamiento y prevención de NAVM, estableciendo algoritmos claros.
Las prioridades de este documento son:
1) Optimizar el diagnóstico integral, clínico y microbiológico, de las NAVM.
2) Orientar en los esquemas antibióticos empíricos y dirigidos, para un tratamiento efectivo de las NAVM en cada hospital y así evitar el uso inadecuado de antibióticos.
3) Promocionar medidas efectivas para reducir el riesgo de la NAVM.
| Métodos |
Este documento es el resultado del trabajo realizado por los miembros del Co.mité de Infecciones asociadas al Cuidado de la Salud y Seguridad del Paciente (IACS-SP) de la Sociedad Argentina de Infectología (SADI) y el Comité de Infectología Crítica (CIC) de la Sociedad Argentina de Terapia Intensiva (SATI), sobre la temática general de abordaje de las infecciones en Unidades de Terapia Intensiva (UTI). El documento está estructurado de la siguiente manera:
1. Atención inicial: sospecha diagnóstica y métodos habituales de diagnóstico
2. Tratamiento antibiótico: tratamiento empírico, dirigido, formas de administración y duración
3. Medidas recomendadas para la prevención.
Se realizó una búsqueda bibliográfica sistemática, cuyas fuentes fueron Medline, Pubmed, Embase, LILACS, Ovid, y Cochrane. Se utilizaron palabras claves términos MESH, en idioma español e inglés en el periodo 2002-2017, en población de adultos. Los tipos de estudios fueron guías, revisiones sistemáticas, estudios clínicos aleatorizados y estudios observacionales.
Se estableció como bibliografía principal las guías internacionales actuales más reconocidas (EE.UU., Reino Unido, Canadá, Latinoamérica y Europa)3-9 siendo adaptadas a las características y epidemiologia de nuestras unidades críticas.
Este documento forma parte de recomendaciones inter-sociedades que han sido diseñadas para asistir a los médicos tratantes (residentes, becarios, médicos de planta, infectólogos), personal de enfermería y kinesiología respiratoria de los pacientes adultos en asistencia ventilatoria mecánica para la prevención, diagnóstico y tratamiento de las neumonías asociadas a la ventilación mecánica.
| Atención inicial |
La evaluación clínica incluye a todos los pacientes bajo asistencia respiratoria mecánica por más de 48 horas que comienzan con fiebre, leucocitosis, aumento de las secreciones y deterioro de la gasometría. La escala de valoración clínica de infección pulmonar CPIS (Tabla 1) es un score que puede contribuir al diagnóstico y evolución de la neumonía.
Para un valor mayor a 6 su sensibilidad es 69% y especificidad 75% considerando la variabilidad inter-observador de alguno de sus puntos. El score de CPIS para diagnóstico frente a los criterios clínicos convencionales no ha demostrado superioridad, pero ha tenido cierta eficacia para monitorear la respuesta al tratamiento10.
TABLA 1.– Escala de valoración clínica de infección pulmonar (Clinical pulmonary infection score, CPIS)10.
| Al ingreso | |||
| Variables | 0 puntos | 1 punto | 2 puntos |
| Temperatura (°C) | 16.1°-38.4° | 38.5°-38.9° | ≤ 36 o ≥ 39° |
| Leucocitos (/mm3) | 4000-11 000 | ≤ 4000, ≥11 000 | Formas en cayado > 50% |
| Secreciones traqueales | Ausencia | No purulentas | Purulentas |
| Oxigenación (PAFI) | ≥ 240 con SDRA | ≤ 240 sin SDRA | |
| Radiografía | Sin infiltrados | Infiltrado difuso | Infiltrado localizado |
| A las 72 horas | |||
| Progresión de la Rx tórax | No | Sí | |
| Cultivo de aspirado traqueal | Negativo o bajo recuento | Patógeno bacteriano en moderada cantidad. Misma bacteria patógena observada con Gram | |
Las guías británicas recomiendan considerar además el aumento en el requerimiento de oxígeno objetivado a través de la PEEP (presión espiratoria final positiva) o PaO2/FIO2 (Presión arterial y fracción inspirada de oxigeno). Este dato se considera clave para la nueva definición epidemiológica de los Centros de Control y Prevención de Enfermedades de EE.UU. (CDC) y la vigilancia de las NAVM en una unidad11.
Estudios complementarios como radiografía de tórax y, eventualmente, tomografía axial computarizada (TAC) son esenciales para determinar la presencia de nuevo infiltrado pulmonar, aunque muchas veces resulten difíciles de interpretar.
Se considera NAVM temprana aquella que se manifiesta dentro de los cuatro días de la ventilación y NAVM tardía a partir del quinto día. Esta distinción se realiza con el objetivo de considerar los microorganismos de la comunidad en la temprana y los intrahospitalarios en la tardía, como agentes causales de la infección.
Sin embargo, en pacientes que han tenido internación previa, uso de antibióticos (ATB) o factores de riesgo para infección asociada a los cuidados de la salud (IACS), se prioriza la probabilidad de portar microorganismos resistentes (MOR) y por ende, ser causales de NAVM temprana en los primeros días de asistencia ventilatoria mecánica (AVM)3.
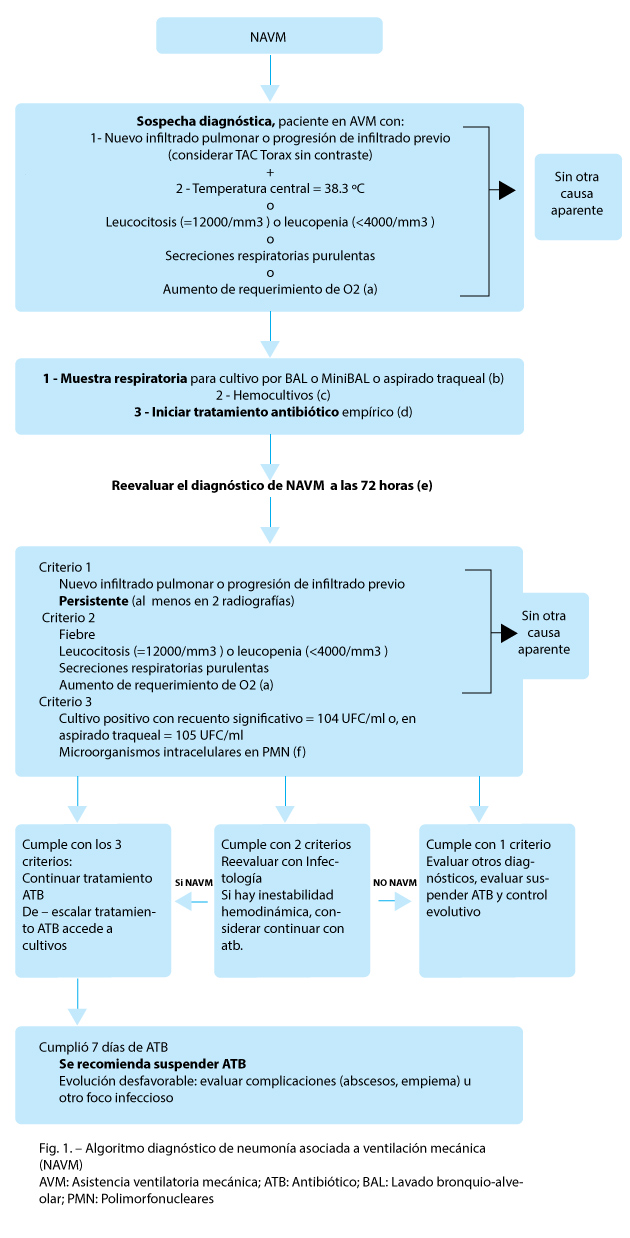
No existe gold standard para el diagnóstico de NAVM. La sospecha clínica debe determinar la inmediata toma de muestra3, 4 y el inicio de tratamiento antibiótico temprano, para luego reevaluar el diagnóstico y tratamiento a las 72 h4, 5, 7.
Con respecto al estudio microbiológico, las guías recientes priorizan las muestras cuantitativas o semicuantitativas por sobre las cualitativas y hay discrepancias sobre el rédito entre las muestras distales (lavado bronquio-alveolar-cepillo protegido) y proximales, como el aspirado traqueal4.
A nuestro criterio puede analizarse cualquier tipo de muestra (distal o proximal, cuantitativa o semicuantitativa) priorizando la que se encuentre disponible en el momento de sospecha de neumonía. Se consideran recuento significativo a 103 UFC/ml, con cepillo protegido, 104 UFC/ml en lavado bronquio-alveolar (BAL) y mini-BAL, 106 UFC/ml en aspirado traqueal. Se recomiendan los estudios invasivos por fibrobroncoscopia como BAL o cepillo envainado en los casos de neumonía izquierda, o para dirigir el estudio de la muestra al lugar de la infección.
Por otro lado, el estudio histopatológico del BAL puede ser útil para otros diagnósticos diferenciales de infiltrado pulmonar y fiebre, en unidades críticas de causa no infectológica, como hemorragia alveolar, neumonía eosinofílica, y toxicidad por drogas6, 8, 9.
Solo alrededor de un 15% de las NAVM tienen hemocultivos positivos. Se debería realizar hemocultivos para mejorar el diagnóstico y tratamiento, considerando que existe poca correlación entre los gérmenes hallados en hemocultivos y los de las muestras respiratorias12, (algoritmo de diagnóstico, Fig. 1).
| Tratamiento antimicrobiano |
El esquema antibiótico empírico debe ser acorde a la epidemiología local, estratificación por días de internación en unidades críticas y hospitalaria
La terapia empírica inadecuada tiene un impacto en la mortalidad. Es indispensable la administración precoz y adecuada de antibióticos, ya que esta medida disminuye la mortalidad en aproximadamente un 22%, como ha sido demostrado por Kumar y col.13, 14.
El esquema antibiótico empírico debe ser acorde a la epidemiología local, estratificación por días de internación en unidades críticas y hospitalaria (temprana ≤ 4 días o tardías ≥ 5 días) y factores de riesgo para MOR: uso de antibióticos en los 90 días previos en salas de alta prevalencia de resistencia, más de 4 días de internación o colonización por gérmenes resistentes como enterobacterias productoras de carbapenemasas, Acinetobacter baummanii o Pseudomonas spp.
En la mayoría de las unidades críticas es probable que, acorde a la epidemiologia local, se deba realizar un tratamiento antibiótico para las neumonías tardías con al menos dos drogas. Según el informe de VIHDA2 2016, los principales MOR productores de NAVM en 149 UCI del país fueron Pseudomonas aeruginosa (23.3%), Staphylococcus aureus (17.75%), Klebsiella pneumoniae (15.9%) y Acinetobacter baummani (14.1%).
Para el tratamiento empírico inicial de la NAVM temprana, sin factores de riesgo para MOR, se sugiere iniciar tratamiento para los agentes respiratorios comunitarios como neumococo, Haemophilus influenzae, Staphylococcus meticilino sensible (SAMS) y Branhamella catarrhalis utilizando ampicilina – sulbactam (AMS), ya que en nuestro medio el neumococo continúa siendo sensible a la penicilina.
Para las NAVM tardías o con factores de riesgo para MOR, los antibióticos a considerar para bacilos Gram negativos son ceftazidima, cefepima, imipenem, meropenem y beta-lactámicos/inhibidores de β-lactamasas (B-IBL) tal como piperacilina-tazobactam (PPTZ) y colistina, y para cocos Gram positivos vancomicina, trimetroprima-sulfametoxazol (TMS) y linezolid (Tabla 2). La indicación de cada uno de estos ATB dependerá de la frecuencia de los diferentes MOR en la UCI y su perfil de sensibilidad.
| Cobertura Gram positivos* | Cobertura Gram negativos | Cobertura Gram negativos multirresistentes |
| Vancomicina 15 mg/kg cada 8-12 h con dosis de carga de 25 mg/kg o Linezolid 600 mg cada 12 h, TMS 800/160 mg cada 8 h e.v. | Ceftazidime 2 g cada 8 h o Piperacilina tazobactam 4.5 g cada 6 h, en infusión de 4 h o Imipenem 500 mg cada 6 h, o meropenem 2 g cada 8 h o Cefepime 2g cada 8 h | Colistín con dosis de carga: 300 mg, y luego 150 mg cada 12 h y/o Amikacina 15-20 mg/kg cada 24 h y/o Fosfomicina 12-16 g por día y/o Tigeciclina 100-200 mg carga y 50-100 mg cada 12 h (no para Tribu Proteae y Pseudomonas spp) |
| *Podría evitarse la cobertura de SAMR en unidades con < 10% de este germen | ||
| Tratamiento dirigido |
Con respecto a Pseudomonas aeruginosa, la utilización de ceftazidima y cefepime son drogas seguras y efectivas; la adición de un segundo antibiótico no parece mejorar la evolución15.
Para Acinetobacter baumannii se debe priorizar la sensibilidad a sulbactam y carbapenem que son los tratamientos de elección cuando el cultivo así lo indique. La monoterapia con colistin fue efectiva para el tratamiento.
Dentro de los nuevos antibióticos, los b lactámicos con inhibidores de b lactamasas (ceftazidima-avibactam, ceftolozano tazobactam) son drogas prometedoras para aumentar el espectro antimicrobiano frente a MOR 16-19. Aún faltan estudios para determinar su eficacia en NAVM.
Para el tratamiento de NAVM por cocos positivos se aconseja antibióticos del menor espectro posible y con penetración pulmonar.
Para Staphylococcus aureus meticilino sensible (SAMS) se recomienda cefazolina y para los resistentes vancomicina, linezolid o TMS. Un estudio reciente ha demostrado cierto beneficio del uso de TMS vs. vancomicina para NAVM por Staphylococcus aureus meticilino resistente (SAMR)20.
El tratamiento para enterobacterias dependerá de la presencia de mecanismos de resistencia como betalactamasas de espectro extendido (BLEE) o carbapenemasas. Para enterobacterias productoras de carbapenemasas se sugiere la bi-terapia con meropenem si la CIM es menor o igual a 8 y otra droga activa como colistina, amikacina, tiegciclina o fosfomicina18, 19.
Con respecto a la forma de administración, si bien la evidencia aún no es contundente con respecto a la infusión continua, en pacientes críticos con infecciones graves y causadas por MOR, la dosis de carga y la administración prolongada o continua debe ser considerada.
La duración del tratamiento aún continúa siendo controvertida. En el estudio multicéntrico aleatorizado de Chastre y col.21 no hubo diferencias en la mortalidad, días de ventilación mecánica, falla clínica o estadía en unidades críticas en los pacientes con 8 días de tratamiento antibiótico vs. 15 días.
En los pacientes con tratamientos prolongados se observaron más reinfecciones por gérmenes con mayor resistencia en forma significativa. Basados en este estudio se recomienda en algunas guías tratamientos más prolongados para gérmenes no fermentadores por el riesgo de recaídas (aunque la definición de recaídas en este estudio es poco precisa) y la probabilidad de persistencia de colonización.
Sin embargo, en el mismo estudio no se hallaron diferencias en mortalidad en los pacientes con tratamientos cortos con bacilos negativos no fermentadores. Otros trabajos no aleatorizados no describen mayor frecuencia de recaídas con tratamientos cortos y bacilos negativos no fermentadores22.
Lo fundamental es reevaluar el diagnóstico en el tercer día de inicio de tratamiento antibiótico, basándose en los resultados de los cultivos y criterios clínicos
La recomendación de continuar con un tratamiento antibiótico durante 14 días en las NAVM por bacilos negativos no fermentadores no ha sido universal. Actualmente la mayoría de las guías recomiendan tratamiento de 7 días de duración, siempre y cuando los tratamientos sean efectivos (tratado con un ATB adecuado a sensibilidad del germen aislado) y el paciente evolucione favorablemente, independientemente del microorganismo causal 3, 4, 22, 23.
Lo fundamental es reevaluar el diagnóstico en el tercer día de inicio de tratamiento antibiótico, basándose en los resultados de los cultivos y criterios clínicos5. Algunas guías recomiendan utilizar el score de CPIS 5, 7, 8 o curva de procalcitonina (PCT)24, 25 para evaluar la suspensión del antibiótico.
En el estudio de Nina Singh y col. se evaluó la posibilidad de suspender el tratamiento antibiótico a los 3 días en pacientes con baja probabilidad de NAVM con un score de CPIS ≤ 6 sin diferencias en la mortalidad y con diferencias a favor de la discontinuidad del tratamiento en este grupo de pacientes en la resistencia antimicrobiana y estadía en las unidades criticas23.
> Antibióticos inhalados en infecciones respiratorias
Diferentes estudios en pacientes críticos muestran que los ATB nebulizados pueden ser una opción adecuada como tratamiento coadyuvante en la NAVM y traqueobronquitis asociada a la ventilación mecánica (TAVM) por MOR26, 27.
Con una adecuada técnica de nebulización, el ATB puede ser liberado directamente en el sitio de la infección y alcanzar elevadas concentraciones. De esta manera se evita la alteración de la flora intestinal, se minimiza la toxicidad sistémica y se evitan futuras resistencias a los ATB.
La ventaja de los antibióticos nebulizados es que pueden alcanzar una mayor concentración local a nivel pulmonar, que puede exceder entre 25 a 100 veces la CIM del patógeno, con mínima o nula toxicidad28.
Un reciente metaanálisis demostró que antimicrobianos inhalados como terapia primaria o adyuvante a antibioticoterapia parenteral no demostró beneficios, aunque se requieren trabajos aleatorizados y con definiciones más precisas en cuanto a dosis y antibióticos útiles para esta vía de administración para definir su verdadero rol29.
En caso de que se decida el tratamiento con ATB inhalados es fundamental considerar las condiciones que deben tener los nebulizadores y las partículas del ATB a nebulizar para lograr el objetivo terapéutico y evitar complicaciones como el broncoespasmo grave30, 31.
Las dosis de algunos antimicrobianos nebulizados se detallan a continuación:
– Colistín: es necesario nebulizar la droga inmediatamente luego de preparada para evitar la hidrólisis del metanosulfonato a colistín, ya que es tóxica para el pulmón. La concentración nebulizada de colistín es de 100 a 1000 veces mayor que las concentraciones séricas. Dosis: 300 a 900 mg/8-12 horas32-35.
– Aminoglucósidos (AMG): Estos antibióticos son una opción para el tratamiento de las NAVM producidas por BGN multirresistentes Se consideran antibióticos de alta solubilidad y baja difusión. Dosis: 500 mg cada 12 horas adicionada a la amikacina endovenosa31.
– Vancomicina: Un trabajo aleatorizado estudió la eficacia de la vancomicina nebulizada, con o sin aminoglucósidos, en pacientes con NAVM microbiológicamente documentada. Este estudio al comparar con el grupo placebo, el grupo de antibióticos nebulizados presentó, en forma significativa, mejoría clínica y microbiológica y menor requerimiento de antibióticos sistémicos. Sin embargo, la mortalidad no fue diferente entre los dos grupos. Dosis: 250 a 500 mg/12 horas36.
– Beta lactámicos: En dos estudios aleatorizados, se investigó el rol de la ceftazidima nebulizada en pacientes con NAVM. Wood y col. reportaron una reducción estadísticamente significativa en la frecuencia de NAR en el grupo de ceftazidima nebulizada37. En cambio, Claridge y col.38 no encontraron diferencias significativas. Dosis de ceftazidima: 500 mg/6 horas.
| Recomendación | Nivel de evidencia GRADO I |
| Evitar la intubación orotraqueal y promover la ventilación no invasiva (VNI) siempre que sea posible | I |
| Realizar “vacación” de sedación en forma diaria en pacientes sin contraindicación | I |
| Hacer prueba de ventilación espontánea diaria en pacientes sin contraindicación | I |
| Cambiar los circuitos respiratorios cuando están visiblemente sucios o con disfunción | I |
| Higiene oral con clorhexidina solución oral (0.12%) | II |
| Control del paciente ventilado sin sedantes (evitar benzodiacepinas frente a cuadros de agitación) | II |
| Movilización temprana y ejercicio en los pacientes en AVM | II |
| Utilizar tubos endotraqueales con aspiración subglótica para los pacientes que se espera esté en AVM más de 48 horas | II |
| Realizar la esterilización o desinfección adecuada del equipo utilizado para cuidados respiratorios | II |
| Elevar la cabecera a 30-45°a cuidados respiratorios | III |
| Remover la condensación en los circuitos frecuentemente, evitando el drenaje hacia el paciente | III |
| Aspirar las secreciones previo a movilización | III |
| Mantener presión del manguito del tubo endotraqueal 20-22 cm H O | III |
| Medidas recomendadas para la prevención de NAVM |
Se recomienda realizar la vigilancia de las NAVM en las unidades de cuidados críticos acorde a la metodología del NHSN (National Health System Network)11 o VIHDA. Las tasas de NAVM deberían ser reportadas a cada unidad crítica en forma periódica.
Es prioritario la capacitación del personal de salud involucrado (médicos, enfermeros y kinesiólogos) sobre medidas preventivas, diagnóstico y tratamiento de NAVM.
El paquete de medidas o bundle más reconocido de prevención de NAVM ha sido el del Institute for Healthcare Improvement de la Campaña Save 5 million lives; que incluye la elevación de la cabecera, profilaxis para tromboembolismo, profilaxis para úlceras de stress, interrupción diaria de la sedación y asesoramiento diario del weaning respiratorio del paciente.
Posteriormente, se cuestionaron algunas de estas recomendaciones como la profilaxis de úlcera de stress por la posible asociación con neumonía intrahospitalaria e infecciones por Clostridium difíccile, y se incorporaron otras medidas como la higiene oral con clorhexidina1.
El uso de bundles de medidas para la prevención de NAVM, es una combinación de recomendaciones con evidencia científica que busca la sinergia de las mismas. El estudio de Girard et al1 demostró un efecto sinérgico entre la vacación de sedación diaria y protocolos de desvinculación a la asistencia ventilatoria o respiratoria mecánica (AVM).
La mayoría de los centros concuerdan que para disminuir las tasas de NAVM además de implementar una vigilancia incidencia con devoluciones a los grupos involucrados, programa de higiene de manos y capacitación del personal de salud en la prevención de NAVM, deben promoverse las siguientes medidas, basadas en la evidencia científica1, 4, 9, en los pacientes con AVM (Tabla 3).
Actualmente existen controversias respecto a la higiene oral con clorhexidina por su posible asociación con un aumento de mortalidad no significativo39. En los estudios con clorhexidina oral se ha observado una disminución de las tasas de NAVM pero no se ha observado una reducción en días de AVM, internación o mortalidad.
En conclusión, a través de esta recomendación intersociedades SADI-SATI adaptadas a las necesidades y epidemiología de nuestro país, pretendemos brindar una herramienta útil para establecer criterios de diagnóstico, tratamiento y prevención de NAVM cuyo objetivo final es el uso de antimicrobianos apropiados y garantizar una atención médica de calidad.
 |
|