► Introducción:
El tratamiento del cáncer gástrico que compromete el estómago proximal es la gastrectomía total con una adecuada linfadenectomía regional. Cuando un tumor invade directamente el bazo o el páncreas, es necesaria la esplenectomía o la pancreatectomía para lograr una resección R0. Aún sin esa invasión directa, la esplenectomía es efectuada también apuntando a una linfadenectomía completa a nivel del hilio esplénico, porque el 10% al 20% de los cánceres proximales metastatiza en los ganglios linfáticos en esa área y la disección completa no es técnicamente posible sin la esplenectomía.
El beneficio en la sobrevida de la esplenectomía para una linfadenectomía profiláctica o terapéutica es controversial. Varios estudios retrospectivos comparando la esplenectomía con la preservación del bazo, mostraron que la esplenectomía se asoció con un aumento de la morbilidad y mortalidad postoperatorias, pero no con una mejora en la sobrevida [1-3]. No obstante, esos estudios estuvieron fuertemente sesgados a favor de la preservación del bazo dado que la esplenectomía había sido realizada en pacientes con enfermedad más avanzada y que el grupo de preservación del bazo incluyó muchos casos de gastrectomía distal para tumores distales.
Dos ensayos prospectivos controlados y randomizados (ECR) fueron efectuados para evaluar la esplenectomía en la gastrectomía total. El ensayo chileno [4] enroló a 187 pacientes en una única institución mostrando una sobrevida a 5 años ligeramente mejor con la esplenectomía que con la preservación del bazo (42% vs 36%), pero la diferencia no fue estadísticamente significativa. Ese estudio concluyó que la esplenectomía debería restringirse a tumores con metástasis macroscópica o invasión directa. El ensayo coreano [5] enroló a 207 pacientes en una única institución mostrando también una sobrevida ligeramente pero no significativamente mejor con la esplenectomía.
En ese ensayo, la randomización fue efectuada antes de la cirugía y la resección no fue curativa en cerca del 20% de los pacientes. El estudio concluyó que la linfadenectomía profiláctica con esplenectomía no estaba justificada. Estos dos ensayos deberían ser considerados no conclusivos y sin el poder estadístico necesario. Existe también otro ECR japonés de pequeña escala (79 pacientes) reportado en 1985 [6] y un meta-análisis de esos 3 ECR mostró una sobrevida a 5 años levemente superior con la esplenectomía, pero la diferencia no fue estadísticamente significativa (riesgo relativo 1,17 con intervalo de confianza de 95% [IC]: 0,97 – 1,41) [7].
En 2 ECR europeos comparando linfadenectomías D1 y D2 para cáncer gástrico [8,9], se incluyó a la esplenectomía o a la pancreatectomía en la gastrectomía total D2 y se demostró un aumento significativo de la morbilidad y de la mortalidad con esos procedimientos. Por lo tanto, en Occidente, la esplenectomía o la pancreatectomía son desalentadas en la gastrectomía total por cáncer gástrico [10].
En Japón, por el otro lado, la mortalidad operatoria en la gastrectomía total con esplenectomía ha sido reportada como baja [11]. Los pacientes con metástasis en los ganglios linfáticos del hilio esplénico son frecuentemente curados con la esplenectomía [12], y, por lo tanto, la esplenectomía ha sido considerada como una parte estándar de la gastrectomía total D2 [13]. No obstante, estudios retrospectivos en Japón fallaron también en mostrar una ventaja en la sobrevida con la esplenectomía sobre la preservación del bazo [14,15].
Para clarificar el rol de la esplenectomía para el cáncer gástrico proximal que requiriere una gastrectomía total para lograr una resección R0, los autores de este trabajo realizaron un ECR a gran escala en instituciones especializadas del Japan Clinical Oncology Group (JCOG). El estudio fue registrado en ClinicalTrial.gov como NCT00112099 y en el UMIN Clinical Trials Registry (UMIN-CTR) como C000000004.
► Pacientes y métodos
♦ Diseño del estudio y objetivos finales
Se comparó la esplenectomía y la conservación del bazo en la gastrectomía total. Cuando se planificó el ensayo en el año 2001, la esplenectomía era el procedimiento estándar en Japón para la gastrectomía total curativa, para los tumores T2-4 en pacientes físicamente aptos. En consecuencia, el ensayo estableció la preservación del bazo como la rama de prueba y fue diseñado para confirmar la no inferioridad de la preservación del bazo, en relación con la esplenectomía, en la sobrevida global (SG). El objetivo final primario fue la SG, definida como el intervalo entre la asignación al azar y la muerte por cualquier causa. Los objetivos finales secundarios fueron la sobrevida libre de recidiva (SLR), definida como el intervalo entre la asignación al azar y la primera recidiva o la muerte por cualquier causa; la morbilidad operatoria; la duración de la cirugía y la pérdida de sangre.
Los hallazgos clínico-patológicos y los estadios del tumor fueron registrados en el ensayo de acuerdo con la 13º edición de la Japanese Classification of Gastric Carcinoma [16] y la 6º edición de la Union for International Cancer Control (UICC) [17] y son presentados en el trabajo según esta última.
♦ Criterios de elegibilidad
Los pacientes con cáncer gástrico proximal T2-4 considerado curable, y aptos para la cirugía, fueron enrolados dentro del ensayo después de dar su consentimiento informado por escrito. Los pacientes con metástasis macroscópicas en los ganglios linfáticos en el hilio esplénico o a lo largo de la arteria esplénica no fueron incluidos porque los cirujanos participantes consideraron que esos tumores deberían ser tratados en bloque con la esplenectomía.
Los tumores comprometiendo a la curvatura mayor del estómago fueron excluidos también, debido a la alta posibilidad de metástasis ganglionar en el hilio esplénico. Los pacientes con tumores tipo 4 de Borrmann (linitis plástica) o aquellos con citología positiva en el lavado peritoneal fueron excluidos también por su mal pronóstico, independientemente de los métodos quirúrgicos. En consecuencia, el ensayo incluyó a pacientes con cáncer gástrico proximal resecable, con posibilidad ni baja ni alta de metástasis en el hilio esplénico.
♦ Instituciones y control de la calidad de la cirugía
Inicialmente, 29 instituciones del Grupo de Estudio del Cáncer de Estómago del JCOG participaron en este ensayo [18]. Durante el período de enrolamiento, el grupo de estudio se expandió gradualmente de acuerdo con la política de manejo del sitio del JCOG, y finalmente 36 instituciones registraron pacientes. Todas las instituciones tenían una unidad quirúrgica especializada para el cáncer gástrico, en donde la gastrectomía total D2 con o sin esplenectomía fue realizada rutinariamente. con una baja mortalidad postoperatoria (< 2%). Todos los cirujanos participantes estuvieron de acuerdo con los detalles técnicos para la cirugía y su adhesión al protocolo fue monitoreada en reuniones llevadas a cabo 3 veces por año. El protocolo del estudio fue aprobado por el JCOG Clinical Trial Review Committee y por las juntas de revisión institucional de todas las instituciones participantes. Los procedimientos fueron efectuados de acuerdo con los estándares éticos de la Declaración de Helsinki de 1975.
♦ Randomización y manejo de los datos
Después de la confirmación de los criterios pre e intraoperatorios, el cirujano telefoneaba al Data Center, en donde el paciente era asignado al azar para recibir una gastrectomía total con esplenectomía (grupo A) o sin esplenectomía (grupo B). Las asignaciones se hicieron por el método de minimización, con una técnica de la moneda cargada balanceando los grupos de acuerdo con la institución y la profundidad de la invasión tumoral (T2/T3/T4). Durante el período en estudio, el protocolo fue enmendado, como se describirá posteriormente, para adoptar la nueva evidencia producida por otros ECR y la presencia o ausencia de invasión esofágica fue añadida como un factor de balanceo.
El Centro de Datos del JCOG realizó el manejo de datos, monitoreo central y análisis estadístico. El Centro brindó reportes de seguimiento semestral que fueron enviados a y revisados por el JCOG Data and Safety Monitoring Committee (DSMC). Ninguno de los cirujanos participantes estuvo involucrado en el análisis de los datos.
♦ Cirugía
Inmediatamente después de la laparotomía, se efectuó una citología por lavado peritoneal. Mientras se esperaba el resultado, el cirujano inspeccionó y palpó el estómago y los órganos adyacentes para confirmar los criterios de elegibilidad. El cirujano luego comenzó con la parte inicial de la operación en el estómago distal. Después de obtener un resultado citológico negativo el cirujano contactaba con el JCOG Data Center para el enrolamiento. El resultado de la randomización fue reportado inmediatamente al cirujano, quien luego completó la operación de acuerdo con los procedimientos asignados, de la siguiente manera:
Grupo A: gastrectomía total con esplenectomía. Se movilizó el cuerpo y cola del páncreas del retroperitoneo y se disecaron los ganglios linfáticos alrededor de la arteria esplénica (No. 11p, mitad proximal; 11d mitad distal; Fig. 1). El bazo fue removido en bloque con los ganglios hiliares (No. 10). La arteria esplénica fue ligada y cortada a unos 5-6 cm de su raíz, distal al origen de la gran arteria pancreática, pero se la preservó más larga cuando había temor de una isquemia pancreática subsecuente.
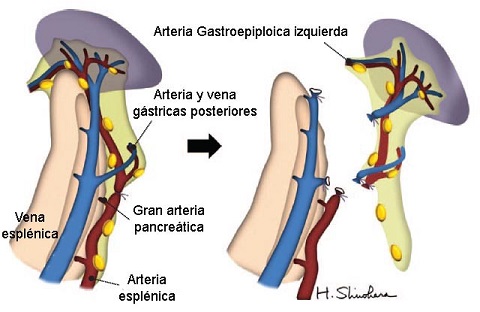
FIGURA 1: Movilización del páncreas distal y el bazo, seguida por la esplenectomía
Grupo B: gastrectomía total sin esplenectomía. El páncreas y el bazo no fueron movilizados. La arteria gastroepiploica izquierda fue ligada y cortada en su origen, el ligamento gastroesplénico fue cortado cerca del hilio esplénico y el bazo fue preservado. Los ganglios linfáticos No. 11p y 11d fueron disecados sin movilización pancreática. Los ganglios No. 10 fueron generalmente dejados intactos, pero fueron disecados si se los consideró fácilmente removibles en pacientes delgados.
En ambos grupos, se realizó la linfadenectomía D2 excepto para la disección de los ganglios No. 10 en el grupo B. La linfadenectomía para-aórtica no fue permitida. Los métodos de reconstrucción y la colecistectomía adicional fueron a discreción del cirujano. La bursectomía no fue obligatoria, pero la extensión de la remoción de la envoltura pancreática fue registrada. Los cuidados perioperatorios, incluyendo el manejo de la anestesia y la selección de los dispositivos quirúrgicos, no fueron especificados en el protocolo. Los ganglios linfáticos disecados fueron recuperados del espécimen quirúrgico fresco y fueron clasificados de acuerdo con los números de estación definidos por la JCGC [16]. Las estaciones y el número de los ganglios linfáticos recogidos fueron registrados en formularios de reporte de casos y fueron monitoreados.
♦ Seguimiento
Los pacientes fueron seguidos de acuerdo con un esquema fijo. Los análisis de sangre, incluyendo marcadores tumorales (CEA y CA19-9) y la tomografía computada (TC) o la ecografía abdominal fueron realizados cada 6 meses. Se monitoreó la presencia o ausencia de episodios infecciosos durante cada intervalo del seguimiento (fiebre > 38ºC o neumonía). Siguiendo con la práctica estándar en Japón para esa época, no se realizó vacunación profiláctica para neumococos.
♦ Enmiendas al protocolo
En el protocolo original, no se empleaba quimioterapia adyuvante, de acuerdo con las guías de tratamiento en ese momento [19]. Sin embargo, cuando 319 pacientes (64% del plan original) fueron enrolados en este ensayo, un ECR japonés (ensayo “ACTS-GC” [20]) mostró beneficios en la sobrevida con la terapia adyuvante sobre la cirugía solamente, y se esperó un cambio en el tratamiento estándar en Japón. Los autores de este estudio decidieron suspender el agregado de pacientes y esperar hasta el primer análisis interino que había sido programado para 3 meses después.
Dado que la JCOG DSMS recomendó continuar con el ensayo luego de análisis interino, se enmendó el protocolo para brindar terapia adyuvante S-1 a los pacientes con estadio patológico II/III por 1 año, y se reabrió el registro de pacientes después de una suspensión de 11 meses. También se enmendó el protocolo para incluir a los tumores que invadían el esófago, si la invasión era de 3 cm o menor. Eso se debió a que el ECR precedente de los mismos autores (JCOG9502) había demostrado que esos tumores no debían ser tratados por toracotomía sino mediante un abordaje abdominal [21], que era el estándar en este ensayo sobre la esplenectomía.
♦ Tamaño de la muestra y análisis estadístico
La sobrevida a 5 años esperada en el grupo con esplenectomía estándar era del 70% y la del grupo con preservación del bazo, del 73%. Se planificó enrolar a 500 pacientes (250 en cada grupo) para observar 196 muertes en total, con un alfa de un lado de 0,05, un poder estadístico del 70% y un margen de no inferioridad de la tasa de riesgo (TR) de 1,21, correspondiendo a un 5% en términos de sobrevida a 5 años, con un período de 5 años de acumulación de pacientes, continuado por un período de 5 años de seguimiento alejado.
Debido a la enmienda del protocolo descrita, se recalculó el tamaño de la muestra basado en los efectos estimados de la quimioterapia adyuvante y la inclusión de los tumores con invasión esofágica. La sobrevida a 5 años esperable del grupo estándar después de recalcular fue del 70%, la misma que en el protocolo original y, por lo tanto, se dejó el mismo tamaño para la muestra. El período de acumulación después de las enmiendas se fijó en 2 años.
Se planificaron y realizaron 3 análisis interinos: el primero después de haber enrolado los 2/3 de la muestra planificada, el segundo después de completar el agrupamiento de los pacientes, y el tercero, 2 años después. La función de gasto alfa de Lan-DeMets con un abordaje tipo O´Brien-Fleming, fue utilizada para mantener el error alfa del estudio en 5% [22]. El alfa de un solo lado del análisis primario fue de 0,0466.
Los datos de todos los pacientes randomizados fueron analizados para la SG y la SLR sobre una base de intención de tratamiento. Las curvas de sobrevida fueron estimadas por el método de Kaplan-Meier. El análisis de la SG fue realizado empleando un modelo de riesgos proporcionales de Cox estratificado, con la profundidad de la invasión del tumor (T2/T3-T4) como factor de estratificación. Los análisis de los subgrupos preespecificados para la SG también fueron realizados, para evaluar las interacciones entre tratamiento y subgrupo, con el uso de un modelo de regresión de Cox. También fueron incluidos los factores postoperatorios en el análisis de subgrupo, para estimar su influencia sobre la SG. El análisis de la SLR fue realizado utilizando un modelo de riesgos proporcionales de Cox no estratificado. Se usó la prueba exacta de Fisher para los datos categóricos y la rank sum de Wilcoxon para los datos continuos.
Los valores de P de dos lados fueron calculados para todas las pruebas, excepto para el análisis primario de la SG. Los valores de P menores a 0,05 fueron considerados como indicadores de significación estadística. Los análisis fueron realizados utilizando el programa SAS, versión 9.2 (SAS Institute, Cary, NC).
► Resultados
♦ Pacientes y cirugía
Entre junio de 2002 y marzo de 2009, incluyendo los 11 meses de suspensión por la enmienda del protocolo, 505 pacientes de 36 instituciones fueron randomizados para esplenectomía (254 pacientes) o preservación del bazo (251 pacientes). Todos los pacientes fueron sometidos a gastrectomía total y, mientras que a todos los pacientes asignados para esplenectomía se les efectuó la remoción del bazo, 3 pacientes asignados para preservación esplénica fueron sometidos a esplenectomía por las siguientes razones: un sangrado del bazo que no podía controlarse, una arteria esplénica sinuosa que fue accidentalmente ligada y cortada, y una invasión tumoral directa de la cola del páncreas hallada después de la asignación.
Seis pacientes fueron considerados no elegibles después del tratamiento, por las siguientes razones: el examen histológico del estómago resecado mostró un linfoma maligno en 1 paciente y un carcinoma neuroendócrino en otro; una metástasis hepática fue hallada antes del cierre abdominal después de la gastrectomía; se reportó una citología positiva después de la randomización; el dato de los análisis de sangre preoperatorios fue reportado incorrectamente; y una invasión tumoral directa de la cola del páncreas fue hallada después de la asignación. Todos esos pacientes no elegibles ocurrieron en el grupo de preservación del bazo.
Las características de los 2 grupos estuvieron balanceadas excepto para la categoría anatomopatológica T. Aunque la categoría T intraoperatoria fue usada como un factor de balanceo, la profundidad histológica resultó ser un factor de desequilibrio entre los grupos, siendo significativamente más comunes los tumores con penetración de la serosa (pT3, pT4) en el grupo con esplenectomía (P = 0,026). A pesar del criterio pre e intraoperatorio usado para excluir a los tumores T1, 71 tumores (14,1%) fueron diagnosticados histológicamente como pT1. La mayoría de todos los tumores en este ensayo (73,3%) no penetraba la serosa.
Los análisis de seguridad para comparar los 2 grupos fueron realizados en tres pacientes esplenectomizados incluidos en el grupo de preservación del bazo. Los resultados fueron confirmados también con análisis excluyendo a esos pacientes. La mediana de la pérdida de sangre en el grupo con esplenectomía fue 75 mL superior que en el grupo con preservación del bazo (P = 0,025), pero la incidencia de transfusión fue similar. La duración de la operación no fue diferente entre los 2 grupos.
Las complicaciones postoperatorias fueron más comunes en la esplenectomía que en la preservación del bazo (30,3% y 16,7%, P < 0,01); la fístula pancreática y los abscesos intraabdominales fueron las complicaciones mayores encontradas más frecuentemente en el primer grupo. La incidencia de fístula pancreática no se asoció con la extensión de la remoción de la envoltura del páncreas. La mortalidad hospitalaria postoperatoria fue observada en tres pacientes (0,6%): uno después de una esplenectomía (filtración anastomótica), y dos después de preservación del bazo (pancreatitis postoperatoria y filtración anastomótica).
En el grupo con esplenectomía, se recolectaron 5 ganglios linfáticos más que en el grupo con preservación del bazo (mediana 64 vs 59, P < 0,01). La mediana del número de ganglios linfáticos No. 10 recolectados en 254 pacientes del grupo con esplenectomía fue 4. En el grupo con preservación del bazo, la disección o el muestreo de No. 10 sin esplenectomía fue realizado en 58 pacientes (23%) y la mediana del número de ganglios linfáticos No. 10 recolectados en esos pacientes fue 2. La mediana del número de ganglios linfáticos disecados alrededor de la arteria esplénica distal (No. 11) fue de 3 y de 2 en el grupo con esplenectomía y con preservación del bazo, respectivamente.
♦ Sobrevida
Después de una mediana para el período de seguimiento alejado de 71,8 meses para todos los pacientes randomizados, 152 pacientes habían fallecido y 137 tenían recidivas del cáncer gástrico. El patrón de recidiva fue similar en los dos grupos, excepto que la enfermedad peritoneal fue diagnosticada en el grupo con esplenectomía con casi el doble de incidencia que en el grupo con preservación del bazo, lo que pudo haber sido causado por el hecho de que las proporciones de tumores con invasión de la serosa y de tipo histológico no diferenciado en el grupo con esplenectomía fueron mayores que en el grupo con preservación del bazo.
La SG a 5 años fue del 75,1% (95% IC: 69,3-80,0) para el grupo con esplenectomía y del 76,4% (95% IC: 70,7-81,2) para el grupo con preservación del bazo. La TR para muerte del grupo con preservación del bazo en relación con el grupo de esplenectomía fue de 0,88 (90,7% IC: 0,67-1,16; P de 1 lado para no inferioridad = 0,025). El límite superior del valor del IC fue menor que el pre-especificado de 1,21 y, por lo tanto, se demostró de manera estadísticamente significativa la no inferioridad de la preservación del bazo.
El análisis de sobrevida empleando la población elegible (N = 499) mostró resultados similares (TR: 0,86; 95% IC: 0,62-1,18). Las tasas de SLR a 5 años para los grupos con esplenectomía y con preservación del bazo fueron de 68,4% (95% IC: 62,3-73,7) y de 70,5% (95% IC: 64,4-75,7), respectivamente, y la TR de la preservación del bazo en relación con la esplenectomía fue de 0,87 (95% IC: 0,65-1,17).
En los análisis de subgrupo para la SG, la localización del tumor mostró interacción estadísticamente significativa: los pacientes con un tumor cuyo mayor abultamiento se situaba en el tercio medio o inferior del estómago tuvieron una menor población en este estudio (78 pacientes; 15,4%) y los 36 pacientes en el grupo con preservación del bazo mostraron una sobrevida mejor que los 42 en el grupo con esplenectomía (log-rank P = 0,006; interacción P = 0,011).
De los 254 pacientes en el grupo con esplenectomía, 6 pacientes (2,4%) tuvieron metástasis histológica en los ganglios linfáticos No. 10. En el grupo con preservación del bazo, el muestreo o la disección de los ganglios No. 10 sin esplenectomía fue realizado en 58 pacientes y 2 de ellos (3,5%) tuvieron metástasis histológica. Esos 8 pacientes tuvieron también metástasis histológicas en un rango amplio de otras estaciones ganglionares, incluyendo la curvatura menor. Siete de los 8 pacientes con metástasis en los ganglios No. 10 desarrollaron recidivas y murieron, y 1 paciente en el grupo con preservación del bazo tuvo una SLR por más de 5 años.
♦ Complicaciones tardías
Durante el seguimiento de 502 pacientes que sobrevivieron a la cirugía, 44 pacientes (8,8%) tuvieron neumonía y 73 pacientes (14,5%) tuvieron un episodio infeccioso con fiebre elevada. No hubo diferencias entre los 2 grupos (21 y 23 pacientes con neumonía y 38 y 35 pacientes con episodio infeccioso, en esplenectomía y preservación del bazo, respectivamente). Ningún paciente desarrollo una neumonía neumocóccica fulminante en ambos grupos.
► Discusión
Este es el mayor ECR sobre la esplenectomía en la gastrectomía total, con más pacientes enrolados que la suma de los ECR previos [4-6], y el primero en mostrar una no inferioridad estadísticamente significativa de la preservación del bazo, en relación con la esplenectomía, en la SG. Fue realizado de manera segura, con una baja mortalidad operatoria (0,6%). En este ensayo, se intentó enrolar a los pacientes con una posibilidad moderada de metástasis en los ganglios No. 10, para evaluar la linfadenectomía profiláctica mediante esplenectomía.
Se evitaron cuidadosamente los casos no curativos y los pacientes con mal pronóstico, mediante la exclusión de aquellos con citología peritoneal positiva y/o tumores tipo 4 de Borrmann. También se excluyeron tumores con metástasis ganglionar macroscópica en el hilio esplénico y aquellos comprometiendo la curvatura mayor del estómago, que han sido reportados como teniendo una posibilidad alta de metástasis en los No. 10 [23-26]. Consecuentemente, la mayoría (73,3%) de los pacientes enrolados tenía un tumor sin invasión serosa y la incidencia de metástasis histológicas No. 10 en el grupo con esplenectomía fue de 2,4%.
Esa incidencia baja es atribuida parcialmente a la inclusión mayor de lo esperado de tumores pT1 (14,1%). La profundidad de la invasión del cáncer gástrico T1 es frecuentemente sobreestimada debido al componente ulcerativo intramural, incluso con el uso de la ultrasonografía endoscópica (USE). En este estudio, la categoría T fue evaluada principalmente sin USE, pero fue confirmada por la inspección y palpación durante la cirugía. Sin embargo, algunos tumores pT1 fueron incluidos, lo que fue inevitable en ese contexto.
Puede suponerse que si la mayoría de los tumores hubieran sido pT3-4 (penetrando la serosa) con una posibilidad más alta de metástasis No. 10, los resultados podrían haber sido diferentes. No obstante, en el análisis de subgrupos de categoría T, la TR de la SG de la preservación del bazo en relación con la esplenectomía, para los tumores pT3-4 fue de 0,72, mientras que para los tumores pT1-2 fue de 1,12, sugiriendo que – contrario a las expectativas de los cirujanos – la esplenectomía disminuye la sobrevida en los tumores más profundos. Una tendencia similar se observó en los subgrupos pN: la TR en los pacientes con pN0 fue de 1,23, mientras que en los pacientes con pN1 fue de 0,73, sugiriendo que la esplenectomía disminuye la sobrevida en los pacientes con metástasis en los ganglios linfáticos.
De este ensayo con un estricto criterio de elegibilidad, los autores concluyen que la esplenectomía debería ser evitada en la gastrectomía total potencialmente curativa para el cáncer gástrico proximal que no invade la curvatura mayor. La incidencia de metástasis en los ganglios No. 10 en ese escenario fue tan baja como del 2,4%, y todos los 8 pacientes con metástasis No. 10 tenían también metástasis en otros sitios ganglionares, y 7 fallecieron con recidivas.
Los autores interpretan los resultados en el sentido de que un cáncer gástrico proximal que no compromete la curvatura mayor tiene una posibilidad muy baja de tener metástasis en los ganglios No. 10 y que cuando esas metástasis existen, la enfermedad está ya extendida y no puede ser curada por la cirugía. No obstante, se debería ser cuidadoso con la extrapolación de los resultados para todos los cánceres gástricos. Los autores no han podido responder la cuestión clínica de si se debería evitar la esplenectomía para un tumor localizado y limitado a la curvatura mayor, porque excluyeron cuidadosamente a esos pacientes del ensayo.
Esos tumores pueden tener metástasis sólo en los ganglios No. 10 que pueden ser curadas con la esplenectomía [12,25,26]. No parece posible otro ECR para responder esa cuestión, porque esos pacientes no son comunes. En otros ECR previos comparando la linfadenectomía D2 y la D2 plus con linfadenectomía para-aórtica (JCOG9501) [11,27], estos mismos autores sometieron a gastrectomía total a 199 de 523 pacientes enrolados, de los que a 191 se les efectuó esplenectomía.
Dieciséis pacientes (8,4%) tenían metástasis histológicas en los ganglios linfáticos No. 10 y 8 pacientes sobrevivieron más de 5 años (datos no publicados). Ese ensayo JCOG9501 y el actual sobre esplenectomía fueron conducidos por el mismo grupo de cirujanos y tuvieron criterios de inclusión similares, excepto que en el último se excluyeron a los tumores que invadían la curvatura mayor. La incidencia más alta de metástasis No. 10 (8,4% vs 2.4%) y la mayor proporción de sobrevivientes entre los pacientes con metástasis No. 10 (50% vs 12,5%) en el ensayo JCOG9501 en relación con el presente de esplenectomía, pueden atribuirse a la diferencia en la elegibilidad de los tumores con invasión de la curvatura mayor.
En conclusión, en la gastrectomía total por cáncer gástrico proximal que no invade la curvatura mayor, la esplenectomía debería ser evitada, dado que incrementa la morbilidad operatoria sin mejorar la sobrevida. El impacto de la esplenectomía profiláctica para los tumores localizados en la curvatura mayor del estómago proximal es una cuestión aún sin respuesta.
Comentario y resumen objetivo: Dr. Rodolfo D. Altrudi