Introducción
La obesidad es una enfermedad común que afecta a más de 300 millones de adultos en todo el mundo [1]. Se define como un índice de masa corporal (IMC) mayor de 30. En Canadá, la prevalencia de la obesidad ha aumentado casi 3 veces en las 2 décadas pasadas [2]. Aproximadamente el 25% de la población canadiense está clasificada ahora como obesa [3].
Las opciones actuales para la cirugía bariátrica son categorizadas por varios principios. Los procedimientos puramente restrictivos incluyen el bandeo gástrico ajustable laparoscópico y la gastrectomía en manguito. El bypass gástrico en Y de Roux es una cirugía restrictiva con un abordaje menor de mala absorción. Los procedimientos principalmente de mala absorción con un componente restrictivo incluyen el swith duodenal y la derivación biliopancreática. Los procedimientos casi puramente de mala absorción incluyen el bypass yeyuno-ileal.
La gastrectomía en manguito laparoscópica (GML), también conocida como gastrectomía longitudinal o vertical, es una opción quirúrgica relativamente nueva y efectiva para el manejo de la obesidad mórbida (Fig. 1). Fue introducida inicialmente en 1990 como una alternativa a la gastrectomía distal con el procedimiento del swith duodenal, para reducir la tasa de complicaciones [4,5]. La gastrectomía en manguito fue realizada laparoscópicamente por primera vez por Ren y col., en 1999 [6]. En ese entonces, la GML era considerada como la primera etapa, en pacientes con alto riesgo, antes de la derivación biliopancreática o del bypass gástrico en Y de Roux [7]. Subsecuentemente se encontró que la GML era efectiva como un procedimiento único para el tratamiento de la obesidad mórbida [8]. Aunque la GML funciona como un procedimiento restrictivo, puede también ocasionar saciedad temprana, al remover la porción del estómago productora de ghrelina [9].
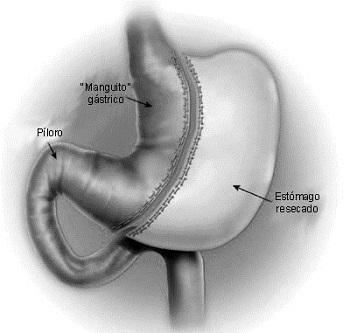
FIGURA 1: Gastrectomía en manguito
La incidencia de la obesidad en Canadá está en aumento y más pacientes son sometidos a procedimientos bariátricos [10]. Ese crecimiento se agrava con la creciente incidencia del turismo médico, en donde los pacientes viajan al extranjero para atención quirúrgica, particularmente cirugía bariátrica [11]. Eso inevitablemente se traslada a una mayor incidencia de complicaciones asociadas con dichos procedimientos. Por lo tanto, es esencial para todos los cirujanos, incluyendo a aquellos que practican en las comunidades más pequeñas, tener en cuenta esas complicaciones potenciales y tener un conocimiento básico de cómo manejarlas y cuando pedir la guía de un cirujano bariátrico. El propósito de este artículo es echar alguna luz sobre los principios básicos en el maneo de las complicaciones después de una GML. Los autores presentan su abordaje quirúrgico para la GML y revisan las principales complicaciones agudas (dentro de las 2 semanas de la cirugía) y tardías, que pueden aparecer en lo pacientes después de la GML (Tabla 1).
• TABLA 1: Complicaciones asociadas con la gastrectomía en manguito laparoscópica (Ver tabla)
Técnica quirúrgica
El paciente es colocado en posición supina con los brazos separados. El neumoperitoneo se realiza con una técnica cerrada con la aguda de Veress colocada en el área subcostal izquierda del abdomen. Dos puertos de 10 mm so colocados en las áreas supraumbilical y medio-abdominal izquierda. Un puerto adicional de 15 mm es colocado en el medio-abdomen derecho para introducir la engrampadora. Finalmente, 2 puertos adicionaldes de 5 mm son colocados en los cuadrantes superiores izquierdo y derecho del abdomen. El lóbulo izquierdo del hígado es separado medialmente utilizado un separador de Nathanson colocado en el área subxifoidea.
El estómago es descomprimido al comienzo de la operación colocando una sonda orogástrica. El cirujano se ubica a la derecha del paciente y el primer ayudante a la izquierda. El ángulo de His es bajado francamente utilizando el disector Goldfinger (Ethicon Endo-Surgery), exponiendo el pilar izquierdo del diafragma. La disección comienza a unos 6 cm proximal al píloro desmontando el ligamento gastrocólico usando el Harmonic Scalpel (Ethicon Endo-Surgery). La disección se realiza proximalmente hacia los vasos cortos gástricos. Eso libera las fijaciones de la curvatura mayor del estómago y el fondo gástrico. El tubo orogástrico es entonces removido y reemplazo por una bujía de 50-French colocada en el estómago por el anestesiólogo y guiada laparoscópicamente hasta quedar en la curvatura menor del estómago, justo distal al píloro. Luego se usa la tri-engrampadora Endo GIA 60 mm para seccionar el estómago. Los autores utilizan inicialmente 2 cartuchos negros para seccionar el estómago distal, comenzando a 6 cm proximal al píloro. Luego, se usan 4 a 6 cartuchos púrpura de 60 mm para completar la división del remanente del estómago. La pieza es retirada de la cavidad abdominal a través del puerto de 15 mm. Luego se retira la bujía y se realiza una gastroscopía intraoperatoria con insuflación de aire y azul de metileno, para descartar cualquier filtración. Los autores rutinariamente cierran la aponeurosis del puerto de 15 mm bajo visi´n directa, antes de desinflar el abdomen. Los pacientes no reciben nada por boca después de la cirugía. En el 1º día postoperatorio, se realiza un estudio gastrointestinal con gastrografin para descartar una filtración de la línea de engrampado (Fig. 2). Seguidamente, se comienza con una dieta de líquidos claros.
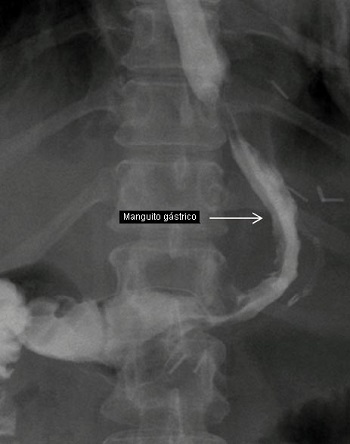
FIGURA 2: Radiografía mostrando una imagen normal del estómago después de una gastrectomía en manguito laproscópica
Complicaciones agudas
Hemorragia
El riesgo de sangrado postoperatorio ha sido reportado entre el 1% y el 6% después de la GML [4,12]. El origen del sangrado puede ser intra o extraluminal. El sangrado intraluminal de la línea de engrampado se presenta generalmente con una hemorragia digestiva alta. Los síntomas comunes incluyen hematemesis o heces con melena. El diagnóstico y manejo del sangrado intraluminal sigue el algoritmo común de la hemorragia digestiva alta. El mismo incluye el establecimiento de líneas intravenosas de gran calibre para la resucitación con fluidos, administración de glóbulos rojos si es necesario, medición del débito urinario con la inserción de una sonda de Foley y una gastroscopía urgente para diagnosticar y controlar la fuente del sangrado.
El sangrado extraluminal se presenta generalmente con una caída seriada de los niveles de hemoglobina o signos de taquicardia o hipotensión. El origen común del sangrado extraluminal incluye la línea de engrampado gástrico, bazo, hígado o pared abdominal en los sitios de ingreso de los trócares. Los autores sugieren un second-look laparoscópico en todo paciente que se presenta con sangrado extraluminal con una frecuencia cardíaca sostenida mayor a 120 latidos por minuto y una caída de la hemoglobina de más de 10 g/L postoperatoriamente. La laparoscopía urgente facilita el diagnóstico y permite la evacuación de coágulos, así como el control quirúrgico de la fuente del sangrado. Muchas veces el origen real de la hemorragia no puede ser identificado, pero consideran que la evacuación del hematoma y la colocación de un drenaje aspirativo cerrado sirve frecuentemente como un complemento útil para la resucitación del paciente.
Hay comercialmente disponible una variedad de materiales de refuerzo para intentar reducir la tasa de sangrado de la línea de engrampado. Los mismos incluyen el copolímero glicólido carbonato de trimetileno (Gore Seamguard; WL, Gore and Associates), tiras de pericardio bovino (Synovis Surgical Innovations) o submucosa de intestino delgado porcino (Surgisis Biodesign, Cook Medical). Si el uso de material de refuerzo reduce la tasa de sangrado, sigue siendo controversial. En un reciente ensayo prospectivo randomizado, Dapri y col. [13], compararon la tasa de sangrado de la línea de engrampado después de la GML utilizando 3 técnicas diferentes: engrampado del estómago sin refuerzos, o refuerzo con sutura o con Gore Seamguard. Esos investigadores observaron una tasa significativamente más baja de sangrado con el uso del material de refuerzo. No hubo diferencia en la incidencia de filtración. No obstante, Albanopoulos y col. [14], no observaron una diferencia significativa en su tasa de sangrado postoperatorio entre los pacientes con sutura de la línea de engrampado o con refuerzo Gore Seamguard, después de la GML. Estos investigadores tuvieron tasas de compliación de 6% y 0% (sangrado y filtración) en las ramas con sutura y Seamguard, respectivamente, pero ello no alcanzó significación. Por lo tanto, en la institución en donde se desempeñan los autores del presente trabajo, no utilizan rutinariamente ningún material de refuerzo para la GML.
Filtración de la línea de engrampado
La filtración gástrica es una de las complicaciones más series y temidas de la GML (Fig. 3). Ocurre en hasta el 5% de los pacientes después de la GML [8,12]. Existen varias clasificaciones basadas en los hallazgos radiológicos y el momento del diagnóstico [15]. Basado en el examen contrastad del tracto gastrointestinal superior, la filtración gástrica puede ser clasificada en 2 tipos. Una de tipo I o filtración subclínica, es controlada, ya sea mediante un drenaje quirúrgico o a través de un tracto fistuloso dentro de la cavidad abdominal o torácica. Una de tipo II o filtración clínica, es una filtración diseminada con difusión del contraste dentro dela cavidad abdominal o torácica [16]. Basado en el momento del diagnóstico, las filtraciones gástricas son clasificadas como tempranas o tardías. Una filtración temprana es generalmente diagnosticada dentro de los primeros 3 días después de la cirugía, mientras que una filtración tardía es usualmente diagnosticada más de 8 días después de la cirugía [17].
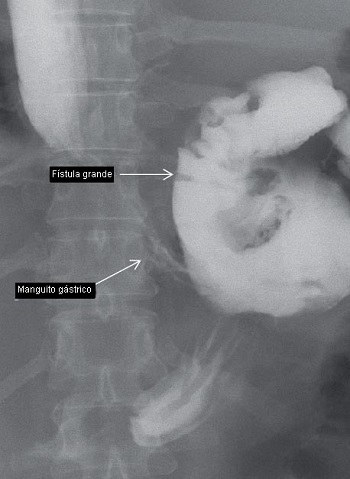
• FIGURA N° 3: Radiografía mostrando una filtración después de una GML
Las filtraciones gástricas pueden ser diagnosticadas ya sea incidentalmente o en una seriada gastrointestinal alta de rutina realizada postoperatoriamente sin ningún signo clínico o durante una laparoscopía/laparotomía exploradora realizada a causa de una taquicardia inexplicable. En un estudio de Kolakowski y col. [18], se encontró que una combinación de signos clínicos de fiebre, taquicardia y taquipnea fue 58,33% sensible y 99,75% específica para la detección de filtraciones anastomóticas. La diabetes mellitus y la apnea del sueño se asociaron con una incidencia mayor de filtración anastomótica. Por lo tanto, los autores del presente trabajo sugieren una laparoscopía exploradora diagnóstica para los pacientes que muestran esos 3 signos en el período postoperatorio temprano. En presencia de una filtración, un lavado abdominal con reparación quirúrgica de la filtración (si es técnicamente posible) y el establecimiento de una ruta para alimentación enteral, debería ser realizado. Dado que el estómago tiene un tamaño limitado, la elección preferida para la alimentación enteral es típicamente una yeyunostomía de alimentación.
En contraste, el tratamiento de una filtración gástrica tardía es más desafiante quirúrgicamente, debido a la presencia de una reacción inflamatoria. En ese escenario, los intentos de reparar la fístula generalmente son fútiles. Las opciones de tratamiento incluyen el manejo conservador o quirúrgico. Eso depende de la condición hemodinámica del paciente y de los hallazgos físicos y radiológicos. En ausencia de inestabilidad hemodinámica y hallazgos físicos sugestivos de peritonitis, puede iniciarse el tratamiento conservador. El mismo comprende resucitación con fluidos, antibióticos endovenosos, nada por boca, drenaje percutáneo de las colecciones intraabdominales (si son drenables) y colocación de stent intraluminal [19]. En un paciente séptico con evidencia radiológica de filtración con colecciones líquidas intraabdominales difusas, el drenaje quirúrgico está garantizado.
En la institución en donde se desempeñan los autores de este trabajo, se han manejado exitosamente filtraciones gástricas tardías con drenaje (ya sea quirúrgico o percutáneo), establecimiento de una vía de alimentación (enteral o parenteral) y colocación de stents gástricos por aproximadamente 2-4 semanas (Fig. 4). Otros investigadores han usado también stents intraluminales para el manejo de las filtraciones gástricas [20,21]. Himpens y col. [20], reportaron su experiencia en el manejo de 29 pacientes con filtración gástrica después de una GML con colocación de stent. Esos investigadores dejaron el stent en su lugar por un promedio de 7 semanas. Se observó el éxito inmediato en 19 pacientes después de la colocación del primer stent, mientras que 5 pacientes requirieron la colocación de un segundo stent. Dos pacientes tuvieron filtraciones persistentes y requirieron una intervención quirúrgica.
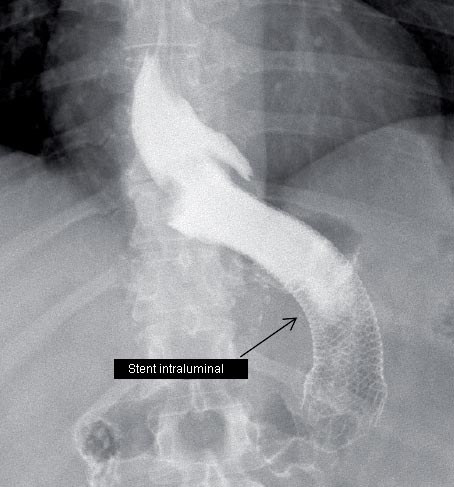
FIGURA N° 4: Radiografía mostrando un stent intraluminal para el tatamiento de una filtración después de una GML
Absceso
El absceso intraabdominal es otra complicación posible de la GML. Usualmente se presenta con síntomas de dolor abdominal, fiebre/escofríos o náuseas y vómitos. Si existe sospecha clínica, se debería obtener una tomografía computada del abdomen para descartar la presencia de un absceso intraabdominal. En una serie de 164 pacientes sometidos a GML, Lalor y col. [22], reportaron 1 paciente con un absceso (0,7%). El tratamiento incluye drenaje percutáneo y antibióticos.
Complicaciones crónicas
Estenosis
La formación de una estenosis es otra complicación potencial que ocurre después de una GML. Puede presentarse tanto de manera aguda después de la cirugía, debido al edema tisular o, más comúnmente, de manera tardía. Los síntomas incluyen intolerancia alimentaria, disfagia o náuseas y vómitos. Aunque el retorcimiento del estómago después de una GML ha sido reportado [23], el sitio más común de estenosis es la incisura angularis [24]. Un estudio gastrointestinal alto o una endoscopía son generalmente diagnósticos.
Las opciones de tratamiento dependen del momento de la presentación. Una estenosis diagnosticada agudamente, puede a veces tratarse conservadoramente, con reposo intestinal (nada por boca), rehidratación con líquidos intravenosos y observación estrecha. En ausencia de otras patologías (por ej., absceso, filtración), esas estenosis se resolverán espontáneamente sin la necesidad de una intervención adicional. El fracaso del manejo conservador garantiza la dilatación endoscópica.
En contraste, las estenosis crónicas generalmente requieren una intervención adicional. Eso incluye tratamientos endoscópico o quirúrgico. Las opciones de tratamiento dependen de la longitud de la estenosis. La dilatación endoscópica en una herramienta invaluable usada en ese escenario para la estenosis de segmento corto [25]. Los tratamiento sucesivos con intervalos de 4 a 6 semanas, son adecuados para tratar la estenosis y mejorar los síntomas del paciente. En contraste, la estenosis de segmento largo y el fracaso del manejo endoscópico demandan una intervención quirúrgica. Las opciones incluyen una seromiotomía laparoscópica o abierta o la conversión a un bypass gástrico en Y de Roux. Dapri y cols. [26], reportaron su experiencia con la seromiotomía laparoscópica en pacientes que habían tenido una GML. Esos investigadores reportaron resultados exitosos con ese tratamiento. Parikh y col. [25], reportaron una incidencia del 3,5% de estenosis sintomática después de una GML en su serie de 230 pacientes; 2 pacientes requirieron conversión a un bypass gástrico en Y de Roux debido al fracaso del manejo endoscópico.
Deficiencias nutricionales
Las deficiencias nutricionales son comunes después de la cirugía bariátrica, La etiología es multifactorial debido a la absorción alterada y a la disminución de la ingesta oral. En un reciente estudio de Gehrer y col. [27], la prevalencia de la deficiencia de vitamina B12, vitamina D, folato, hierro y zinc, fue reportada en el 3%, 23%, 3%, 3% y 14%, respectivamente, después de una GML. En general, esos investigadores encontraron que las deficiencias de micronutrientes eran menos prevalentes después de una GML que de un bypass gástrico en Y de Roux; no obstante, la deficiencia de folato fue levemente más común después de la GML que del bypass gástrico en Y de Roux (22% vs 12%) [27]. Por lo tanto, está garantizado el estudio rutinario de la sangre después de una GML para diagnosticar las deficiencias de vitaminas y minerales. En la institución de los autores de este trabajo se monitorea rutinariamente los niveles séricos de vitamina B12, vitamina D, folato, hierro y calcio de los pacientes, a los 3, 6 y 12 meses después de la cirugía y, de ser necesario, se los trata adecuadamente.
Enfermedad por reflujo gastroesofágico
La enfermedad por reflujo gastroesofágico (ERGE) es una condición vista comúnmente en la población de la cirugía bariátrica. Aunque se sabe que algunas operaciones, como el bypass gástrico en Y de Roux, se asocian con una incidencia reducida de reflujo postoperatorio, eso es controversial en la GML. En una reciente revisión sistemática de Chiu y col. [28], los autores hallaron que los datos no eran concluyentes en relación con el efecto de la GML sobre la ERGE. De los estudios incluidos, 4 mostraron una incidencia aumentada de ERGE postoperatoriamente, mientras que 7 mostraron una disminución en la incidencia de ERGE. Certer y col. [29], efectuaron un estudio retrospectivo en pacientes sometidos a GML y hallaron que el 47% de los pacientes tenían síntomas persistentes (>30 días) de ERGE. Los síntomas más comúnmente reportados incluyen acidez (46%) y regurgitación (2%). El manejo de los pacientes con ERGE persistente involucra el tratamiento con inhibidores de la bomba de protones. Esos pacientes requieren un estrecho seguimiento clínico. Si los síntomas persisten a pesar del uso de los inhibidores, los autores de este trabajo generalmente realizan una gastroscopía para el diagnóstico.
Conclusión
La GML es un procedimiento nuevo y efectivo para el manejo quirúrgico de la obesidad mórbida. Por lo tanto, el número de pacientes sometidos a ese procedimiento continuará aumentando. El conocimiento básico de las complicaciones comunes y las opciones de tratamiento disponibles es esencial para todos los cirujanos generales en actividad. Este artículo ofrece una guía básica de manejo para el tratamiento de las complicaciones después de la GML. Mediante el diagnóstico y tratamiento temprano de esas complicaciones, la morbilidad y mortalidad de los pacientes pueden ser reducidas.
♦ Comentario y resumen objetivo: Dr. Rodolfo D. Altrudi