Introducción
La traqueostomía fue popularizada por Chevalier Jackson a comienzos del siglo 20 y es considerada actualmente como el procedimiento estándar para los pacientes que requieren ventilación mecánica prolongada. La traqueostomía percutánea en la cabecera del enfermo (TPC), como fuera descrita por Ciaglia y col. [4], en 1985, es una alternativa costo-efectiva a la traqueostomía abierta. Además de ser un procedimiento más costo-efectivo que la traqueostomía abierta, la seguridad de la TPC ha sido demostrada en una serie de poblaciones, incluyendo pacientes críticamente enfermos, de trauma, cardiotorácicos, neurológicos y otorrinolaringológicos [5-9]. Adicionalmente, la TPC puede ser efectuada rápida y tempranamente en los pacientes internados en una unidad de cuidados intensivos (UCI) [10]. Los autores de este trabajo adoptaron la TPC como un abordaje rutinario en 1990 [11]. A pesar de que múltiples estudios han reportado que la traqueostomía percutánea es un procedimiento seguro y costo-efectivo cuando se realiza en la cabecera del enfermo, su uso aún no ha sido aceptado por la comunidad quirúrgica como el procedimiento estándar. Dado que ha sido la técnica preferida en la UCI donde se desempeñan los autores desde 1998, éstos revisaron críticamente su experiencia para verificar su seguridad relativa, particularmente en la población de pacientes de alto riesgo. Hipotetizaron que la TPC tiene una morbilidad mínima aceptable, aún en pacientes con alto riesgo y que debería ser el procedimiento estándar.
Métodos
El Denver Health Medical Center es un centro regional de trauma de nivel I, certificado por el estado y por el American College of Surgeons y es un establecimiento de enseñanza integral de la University of Colorado School of Medicine. Se revisaron los casos de pacientes sometidos a una TPC desde enero de 1998 hasta junio de 2008. La técnica de la TPC fue realizada por cirujanos de trauma/atención de urgencias, como fuera descrito previamente [12], con un cambio en julio de 1999 pasando de la técnica secuencial de multidilatación a la técnica Rhino de dilatación única.
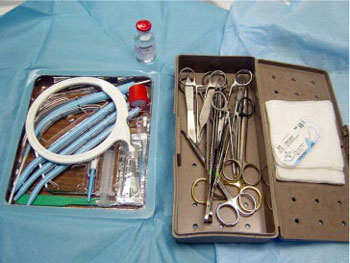
La técnica de la TPC se inicia después de suministrar al paciente una apropiada sedación (100 a 200 mcg de fentanilo y 1 a 2 mg de midazolam) y paralización (típicamente, 0,1 mg/kg de vencuronio, a menos que estuviera contraindicado). Además del equipo para el procedimiento (Ciaglia Blue Rhino Percutaneous Tracheostomy, Cook Medical) se empaquetan, en un neceser reutilizable, los instrumentos frecuentemente empleados (pinzas de Adson, de DeBakey, separadores Seine, portaagujas, tijeras, broches). (Fig. 1). Además, se emplea una compresa enrollada interescapular para “levantar” al paciente y facilitar la hiperextensión del cuello para una exposición adecuada; los pacientes con lesiones de columna cervical son mantenidos en una posición neutral.
• FIGURA 1: Kit de traqueostomía percutánea e instrumentos frecuentemente usados.
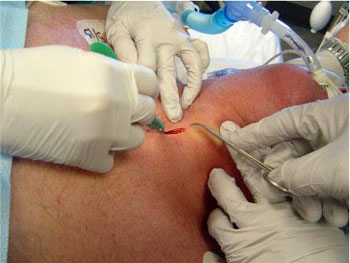
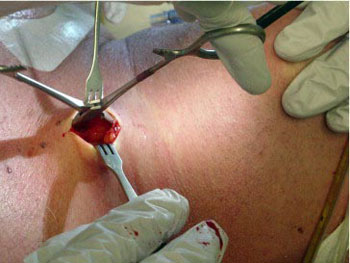
La superficie anterior del cuello se limpia con una solución del clorhexidina, pero la técnica no es considerada estéril. Luego de infiltrar con lidocaína al 1% con epinefrina, se efectúa una incisión vertical de 1,5 cm, justo por debajo del cartílago cricoides (Fig. 2). Se efectúa disección roma hasta identificar los anillos traqueales por palpación (Fig. 3).
• FIGURA 2: Incisión vertical de 1,5 cm justo por debajo del cartílago cricoides
• FIGURA 3: Disección roma hasta identificar por palpación los anillos traqueales.
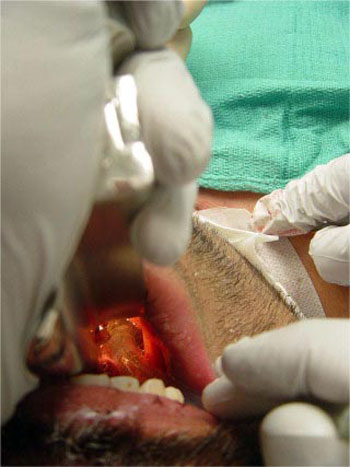
Justo antes de insertar la aguja, se retira el tubo endotraqueal bajo visión directa, usando un laringoscopio, hasta que el balón alcanza las cuerdas vocales (Fig. 4). Dejar el broncoscopio en la luz traqueal o dentro del tubo endotraqueal aumenta la posibilidad de dañarlo con la aguja y dificulta la ventilación. Una vez que la aguja es colocada dentro de la luz de la vía aérea, entre el 1º y 2º anillos traqueales (Fig. 5) y de haber aspirado aire a través de la solución salina en la jeringa adosada, confirmado su ubicación intraluminal, se avanza el alambre dentro de la tráquea (Fig. 6).
• FIGURA 4: Retiro del tubo endotraqueal bajo visión directa utilizando un laringoscopio hasta que el balón es evidente justo por debajo de las cuerdas vocales.
• FIGURA 5: Colocación de la aguda del kit de Ciaglia dentro de la luz de la vía aérea, entre el 1º y 2º anillo traqueal.
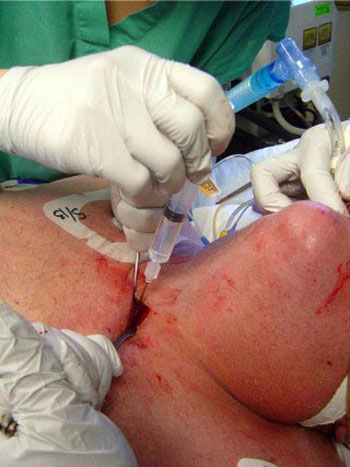
• FIGURA 6:Avance del alambre a través de la aguja dentro de la luz traqueal
.jpg)
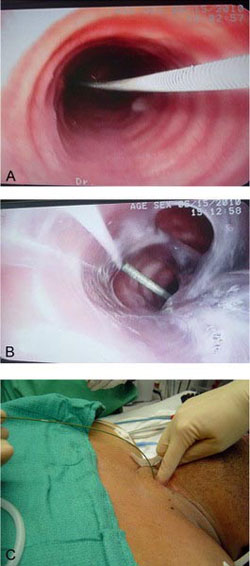
En este punto, se realiza la confirmación broncoscópica. Se deben verificar 3 pasos confirmatorios antes de dilatar la tráquea: a) el alambre está dentro de la luz de la tráquea por debajo de la carina; b) el alambre no pasa a través del ojo de Murphy del tubo endotraqueal y c) el alambre trascurre por la superficie anterior de la tráquea, en posición entre las horas 11 y 1 y entre el 1º y 2º, ó 2º y 3º anillos traqueales (aproximadamente debe caber un pulpejo de dedo entre el cartílago cricoides y el punto de inserción del alambre) (Fig. 7). El cirujano no debe confundir un istmo tiroideo prominente con el cartílago cricoides.
• FIGURA 7: (A) La broncoscopía confirma la presencia del alambre dentro de la luz de la tráquea, debajo de la carina. (B) El alambre no pasa a través del ojo de Murphy del tubo endotraqueal. (C) La palpación digital confirma el alambre transcurriendo sobre la superficie anterior de la tráquea, en posición entre las horas 11 y 1 y entre el 1º y 2º, ó el 2º y 3º anillos traqueales; aproximadamente un pulpejo de dedo debe caber entre el cricoides y el punto de inserción del alambre.
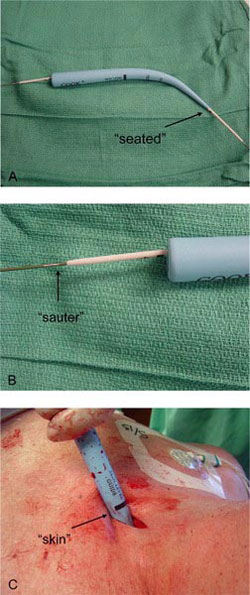
Antes de la dilatación Rhino, se deben efectuar 3 pasos adicionales utilizando la regla nemotécnica de las 3 S: “seated”, la punta del dilatador Rhino debe estar asentada sobre la cánula interna blanca; “sauter”, la marca sobre el alambre debe estar alineada con la porción distal de de la cánula blanca interna y “skin”, se debe observar la marca de piel sobre el dilatador Rhino, porque es el límite de la inserción en la tráquea (Fig. 8).
• Figura 8: Las 3 “S”: (A) La punta del dilatador Rhino debe estar “seated” sobre la cánula interna blanca. (B) La marca “sauter” sobre el alambre debe estar alineada con la porción distal de la cánula blanca interna. (C) La marca “skin” del dilatador Rhino debe ser observada porque es el límite de la inserción en la tráquea.
Después de la dilatación Rhino, el tubo de traqueostomía, cuyo balón fue probado y apropiadamente cargado en el dilatador azul, está listo para la inserción (Fig. 9). Se verifican las 3 S finales: “seated”, “sauter” y “syringe” (jeringa), Claramente, los pasos 1 y 2 son idénticos y el paso 3 se asegura de que esté disponible una jeringa de 10 mL para inflar el balón del tubo de traqueostomía después de la inserción.
• FIGURA 9: El tubo de traqueostomía es cargado sobre un dilatador azul de tamaño medio, listo para la inserción.
El tubo de traqueostomía es colocado dentro de la vía aérea y se retiran el introductor y el alambre; una broncoscopía a través del tubo recién colocado confirma su emplazamiento adecuado dentro de la tráquea. Luego se fija en su lugar la traqueostomía con puntos en los 4 ángulos y se coloca un lazo de amarre al cuello (Fig. 10). En este punto se reinserta el broncoscopio para verificar la permeabilidad de la vía aérea y brindar limpieza de la misma. El tubo endotraqueal no es removido hasta que se confirma satisfactoriamente el tubo de traqueostomía. No se realiza de rutina una radiografía de tórax post-procedimiento.
• FIGURA 10: La traqueostomía es sutura en su lugar colocando puntos de Prolene 2-0 (Ethicon) en los 4 ángulos.
.jpg)
Los pacientes considerados de alto riesgo fueron definidos como aquellos con un collar cervical o un halo, con lesiones documentadas de la columna cervical, los que requirieron goteo de heparina y los que requirieron parámetros ventilatorios con presión positiva al final de la espiración (PPFE) > 10 cm H2O o fracción de oxígeno inspirado (FiO2) > 50%. Se registraron los datos demográficos de los pacientes y los resultados; se incluyó la revisión de las historias clínicas ambulatorias en la investigación para identificar las complicaciones alejadas. Las complicaciones definidas incluidas en el análisis, fueron el desplazamiento de la traqueostomía, el sangrado que requirió operación, la infección de la herida, la pérdida de la vía aérea requiriendo una cricotiroidotomía de emergencia, el estoma traqueal persistente y la estenosis subglótica. El análisis estadístico fue realizado utilizando el programa SAS para Windows (SAS Institute). El Colorado Multi-Institutional Review Board aprobó este estudio.
Resultados
Durante el período del estudio, 1.000 pacientes fueron sometidos a una TPC. La mayoría de los pacientes (74%) fueron hombres con una edad promedio de 46 ± 0,6 años y el 70% de la población en estudio fueron pacientes de trauma. La TPC fue efectuada 8,9 ± 0,2 días después de la admisión. Los pacientes permanecieron dependientes del ventilador por un tiempo adicional de 9,7 ± 0,4 días. El total de días de ventilador fue de 21 ± 0,6, la duración de la estadía en UCI fue de 29 ± 0,6 días y de la estadía hospitalaria de 35 ± 0,8 días. La mortalidad global fue del 12%.
Hubo 482 pacientes (48%) sometidos a TPC que fueron considerados de alto riesgo, con algunos incluidos en más de 1 categoría de riesgo: 1 categoría de riesgo, 273 pacientes; 2 categorías de riesgo, 139 pacientes; 3 categorías de riesgo, 56 pacientes; 4 categorías de riesgo, 12 pacientes y 5 categorías de riesgo, 2 pacientes. Las categorías de riesgo incluyeron 272 pacientes con un collar cervical o halo, 150 pacientes con FiO2 > 50%, 110 pacientes con PPFE >10 cmH2O y 102 pacientes con una infusión sistémica de heparina.
Las complicaciones ocurrieron en 14 pacientes (1,4%). Las complicaciones tempranas incluyeron desplazamiento requiriendo revisión operatoria (n = 4), sangrado requiriendo intervención (n = 2), infección de la herida (n = 1) y fracaso del procedimiento requiriendo cricotirotomìa (n = 1). En los 4 pacientes con desplazamiento, todas las traqueostomías fueron colocadas demasiado bajas, lo que se sospechó en la broncoscopía o en la radiografía de tórax al final del procedimiento; se efectuó una revisión formal con emplazamiento entre el 1º y 2º o entre el 2º y 3º anillos traqueales. Esos casos ocurrieron al comienzo de la experiencia con la TPC. Los 2 casos de sangrado incluyeron 1 paciente con grandes venas yugulares anteriores requiriendo ligadura y 1 paciente que requirió embolización de una fístula arteriovenosa tiroidea superior izquierda en el 3º día postoperatorio. La infección de la herida fue tratada exitosamente con antibióticos y no necesitó intervención quirúrgica. Un paciente con fractura bilateral Leforte III experimentó una extubación inadvertida cuando se retiró el tubo endotraqueal hasta el nivel de la glotis; se reintentó la intubación oral sin éxito, por lo que se efectuó una cricotiroidotomía de urgencia. Las complicaciones tardías incluyeron la persistencia del estoma traqueal, que requirió cierre quirúrgico (n = 4) y la estenosis subglótica (n = 2). Las tasas de complicaciones fueron equivalentes entre los grupos con riego normal y aumentado. Hubo 6 complicaciones (1,2%) en los pacientes con riesgo normal: sangrado (n = 2), desplazamiento requiriendo revisión operatoria (n = 2), cricotiroidotomía de urgencia (n =1) y estoma persistente (n = 1). Las 8 complicaciones (1,7%) en los pacientes con riesgo alto incluyeron: persistencia del estoma (n = 3), estenosis subglótica (n = 2), desplazamiento requiriendo revisión (n = 2) e infección de la herida (n = 1). No hubo muertes relacionadas con la TPC.
Discusión
La traqueostomía percutánea fue descrita originalmente por Sheldon y col. [13] en 1955; no obstante, no fue usada rutinariamente hasta que se reportó la técnica de dilatación por Ciaglia y col. [4], en 1985. Desde su introducción, múltiples estudios han validado esta técnica como equivalente o superior a la traqueostomía abierta [14-21]. Comparada con la traqueostomía quirúrgica, la traqueostomía percutánea tiene varias ventajas. Es relativamente simple de realizar con un tiempo de procedimiento más breve [15,16,22-24]. La habilidad para efectuar un procedimiento en la cabecera del enfermo, obvia la morbilidad potencia,l así como el costo considerable, asociados con el transporte de pacientes críticamente enfermos a la sala de operaciones. Varios estudios han demostrado que la traqueostomía percutánea es más costo-efectiva que la traqueostomía quirúrgica [22,23,25], con una tasa similar o inferior de complicaciones [15,16,23,26]. A pesar de la literatura actual, parecen existir muchas instituciones que no han adoptado a la TCP como la técnica de elección.
La experiencia de los autores de este trabajo en la década pasada, les ha brindado varios puntos instructivos sobre la técnica. Emplean un equipo de 3 personas para realizar la traqueostomía en la cabecera del paciente. El equipo operatorio consiste en un terapista respiratorio entrenado en el manejo de la vía aérea, un cirujano de planta y un residente de 2º año de cirugía o del departamento de emergencia. Alternativamente, un anestesiólogo, otro cirujano o una enfermera de anestesia, pueden manejar la vía aérea y el posicionamiento del tubo endotraqueal. Un solo operador podría realizar el procedimiento, pero en el hospital escuela académico en donde trabajan los autores, se incorpora un residente en entrenamiento al equipo operatorio. Aunque los autores limpian la piel del paciente con clorhexidina antes de la incisión, no utilizan un campo completamente estéril como el de un quirófano. Dado que el sitio quirúrgico es contaminado después de la incisión en la tráquea, el uso de ropa y guantes estériles es, en opinión de los autores, costoso e inefectivo para prevenir la infección. La incidencia de infección de la herida fue en esta serie del 0,1%. Los autores consideran que la broncoscopía es esencial en el procedimiento, para confirmar que el alambre está en la tráquea y no a través del ojo de Murphy del tubo endotraqueal, o por detrás de la pared traqueal, en el esófago. En unas pocas ocasiones, los autores habían colocado a ciegas el alambre a través del ojo de Murphy; si no hubiera sido detectado por la broncoscopía antes de la dilatación y colocación del tubo endotraqueal, la decanulación del tubo endotraqueal hubiera sido imposible. No usan la broncoscopía para determinar hasta donde traccionar del tubo endotraqueal, eligiendo para ello la visión directa con laringoscopía; usando sólo el broncoscopio no se puede evaluar el posicionamiento adecuado del manguito. Con la realización de la broncoscopía al finalizar el procedimiento para confirmar el emplazamiento del tubo traqueostómico y brindar una limpieza pulmonar, no hace falta efectuar una radiografía post-procedimiento, a menos que el paciente no retorne a los parámetros ventilatorios basales.
Al analizar las complicaciones, los autores identificaron varios puntos ilustrativos adicionales. Primero, el uso del broncoscopio para determinar hasta donde retirar el tubo endotraqueal debería evitarse, debido a la potencial pérdida de la vía aérea. Cuando se observa la vía aérea distal a través del broncoscopio, el manguito está por encima del área de visualización, por lo tanto, si se ven las cuerdas vocales, el manguito está por encima de ellas. En los pacientes con una vía aérea edematosa, fracturas faciales complejas o intubación previa difícil, tales como aquellos que perdieron la vía aérea y requirieron una cricotiroidotomía de urgencia en esta serie, debería considerarse el uso del broncoscopio como una maniobra para mantener abierta la vía aérea (stent). Adicionalmente, cuando se manipula el tubo endotraqueal, éste no debe ser traccionado hasta justo antes de la inserción de la aguja en la tráquea y, una vez traccionado, debe prestarse mucha atención en mantener su posición para prevenir una extubación accidental. En los pacientes con desplazamiento de la traqueostomía se recopilaron 2 puntos de aprendizaje. Primero, la omisión del cirujano de la palpación directa de la superficie anterior de la vía aérea, para confirmar que el alambre sale de la tráquea a no más de un pulpejo desde el cartílago cricoides, es crítica. Se puede usar el broncoscopio para confirmar que el catéter está insertado en la tráquea anterior y que no ingresa lateralmente; no obstante, la palpación directa debería confirmar también la ubicación. Segundo, el istmo tiroideo puede ser confundido con el cartílago cricoides; la visualización directa para delimitar mejor los anillos traqueales puede realizarse mediante la división del istmo con electrobisturí. Como sería esperable, la disección limitada, el mantenimiento en la línea media y la buena atención a la hemostasia deberían limitar las complicaciones hemorrágicas. El esclarecimiento de la causa del estoma persistente en 4 pacientes, de la estenosis subglótica en 2 y de la infección de la herida en 1 fue difícil de discernir en esta revisión.
Un área de controversia es quién debería hacer estos procedimientos y en qué población de pacientes. En la práctica actual de los autores, existen pocas contraindicaciones absolutas para la traqueostomía en la cabecera del paciente. En los pacientes con una columna cervical inestable sin fijación (collar, halo o quirúrgica) se debería postergar la traqueostomía hasta que el equipo de columna determine la estabilización. Claramente, cualquier paciente con un estado cervical indeterminado no debería ser sometido a una traqueostomía hasta completar los estudios por imágenes e instituir el tratamiento necesario. En los pacientes sometidos a una operación de fijación anterior de fracturas cervicales, los autores esperan hasta 5 días post procedimiento para realizar la TPC, para prevenir la contaminación del sitio operatorio y la potencial infección del material implantado. La TPC probablemente debería retrasarse en los pacientes con oxigenación límite sobre una FiO2 > 80% y una PPFE > 15 cmH2O. Asimismo, la coagulopatía no controlada o los pacientes con niveles de tiempo de tromboplastina parcial supraterapéuticos o con goteo de heparina, deberían ser corregidos antes del procedimiento. El cirujano de planta participa activamente en la TPC con los residentes novatos. Aunque siempre se puede argumentar, en relación con la experiencia, que “más es mejor”, el completar 1 a 20 TPC como residente avanzado puede hacer probablemente que el cirujano se sienta competente para realizar el procedimiento cuando su entrenamiento está completo.
Hasta donde llega el conocimiento de los autores, este es la experiencia más grande de una única institución sobre TPC reportada hasta el presente. Adicionalmente, el uso de la TPC en varios tipos diferentes de pacientes de alto riesgo, no ha sido analizado previamente. Hay varias limitaciones en este estudio. Aunque se revisó individualmente en detalle cada historia clínica de los pacientes, existen las limitaciones inherentes a cualquier análisis retrospectivo. También existe la posibilidad de que un paciente haya desarrollado complicaciones tardías que fueron tratadas en otro centro asistencial.
En la experiencia de los autores, la traqueostomía percutánea puede ser efectuada con seguridad en la cabecera del enfermo en la UCI y puede ser realizada, aún en pacientes con alto riesgo, con mínima morbilidad. La tasa global de complicaciones en todos los pacientes fue del 1,4% y no hubo diferencias entre los pacientes con riesgo normal y alto. Además, no hubo muertes debidas a la TPC. Los autores proponen que esos hallazgos indican que la TPC debería ser considerada como el gold standard en los pacientes que requieren una traqueostomía no emergente en la UCI.
♦ Comentario y resumen objetivo: Dr. Rodolfo D. Altrudi
► Para acceder a las referencias bibliográficas en formato Pdf, haga clic aqui
