| 1. Introducción |
Los melanocitos se originan a partir de los progenitores de la cresta neural durante el desarrollo embrionario y son células pigmentadas que producen melanina como respuesta fotoprotectora. Aunque se encuentran con mayor frecuencia en la piel y el cabello, los melanocitos también se encuentran en las superficies mucosas y en el tracto uveal del ojo. La proliferación clonal de melanocitos en estas respectivas regiones anatómicas da lugar a melanomas cutáneos, mucosos y uveales.
Los factores de riesgo más importantes para los melanomas cutáneos incluyen la exposición crónica a los rayos ultravioleta (UV) en adultos mayores y quemaduras solares con ampollas durante la adolescencia y la niñez; esto está respaldado por las sustituciones de nucleótidos C > T relacionadas con los rayos UV que predominan en la genética de los melanomas cutáneos. A nivel molecular, esta transición maligna de melanocitos a melanoma se caracteriza y aparentemente depende de la activación constitutiva de la vía RAS-RAF-MAPK/ERK, que regula la proliferación celular, invasión, angiogénesis y metástasis.
La identificación de mutaciones del conductor, como BRAFv600E/K, a lo largo de esta vía ha llevado al desarrollo de una terapia dirigida con inhibición dual de BRAF y MEK, que ha contribuido a una mejora notable en la supervivencia general de los pacientes con melanoma avanzado BRAF V600 (Figura 1).
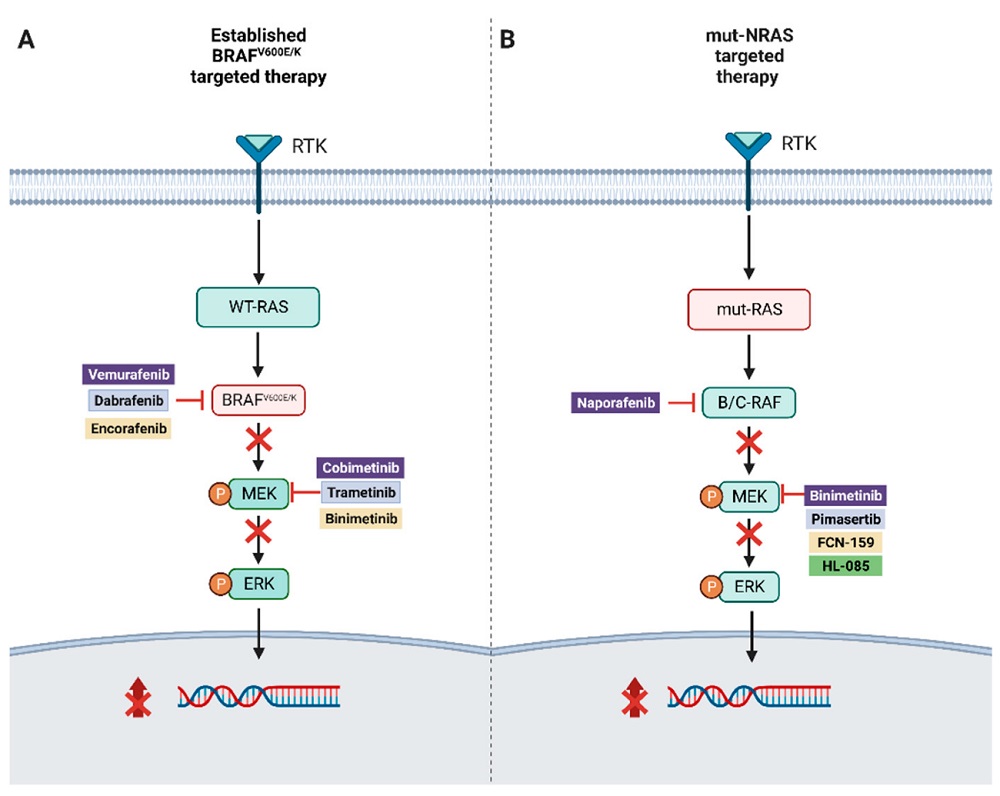
Figura 1.
(A) Ilustración de la terapia dirigida combinada en melanoma mutado- BRAFv600E/K.
(B) Enfoques de terapia dirigida para el melanoma con mutación en NRAS.
El panorama terapéutico para el melanoma ha avanzado mucho desde los días en que el pronóstico para los pacientes con melanoma metastásico avanzado se medía en meses con dacarbazina e interleucina-2 como las únicas opciones de tratamiento aprobadas por la FDA. El surgimiento de la inmunoterapia basada en puntos de control inmunológico como tratamiento de primera línea ha cambiado significativamente los resultados. En esta revisión, los autores destacan los últimos avances en terapias dirigidas para el melanoma.
| 2. Mutaciones RAF, vía MAPK |
En el melanoma, los objetivos moleculares se encuentran en gran medida dentro de la vía de señalización MAPK, que parece fundamental para la progresión del melanoma. La vía regula una amplia gama de actividades celulares, incluida la proliferación, supervivencia, angiogénesis y migración celular. La familia de proteínas RAF consta de tres enzimas: ARAF, BRAF y CRAF (RAF-1). Las mutaciones están presentes en aproximadamente el 8% de los tumores humanos, con mutaciones somáticas activadoras de BRAFen 40-66% de los melanomas
| 3. Resistencia mutante BRAF |
La resistencia adquirida con recaída clínica es casi uniforme en todos los pacientes tratados con la combinación de inhibidores BRAF/MEK. Esto se debe en parte a los numerosos mecanismos de resistencia a los medicamentos, que hacen que sea difícil de prevenir o tratar de manera efectiva.
| 4. Inhibidores Pan-RAF |
Los inhibidores Pan-RAF se han desarrollado como un enfoque alternativo para prevenir o superar la resistencia y la activación paradójica de inhibidores específicos de BRAF en BRAF-WT- y pacientes mutados-NRAS, así como en el subconjunto de pacientes mutados BRAF V600E con resistencia adquirida.
Dado que los primeros estudios mostraron una eficacia clínica limitada de la monoterapia pan-RAF, los mecanismos de resistencia se dilucidaron utilizando células de melanoma que fueron tratadas y finalmente desarrollaron resistencia a belvarafenib, un inhibidor de pan-RAF. In vitro, se encontró que los clones resistentes a belvarafenib tenían reactivación de la vía MAPK mediante mutaciones en ARAF que conducen a dimerización y actividad quinasa. In vivo, también se encontró que el ctDNA obtenido de pacientes con enfermedad progresiva después del tratamiento con belvarafenib tenía mutaciones ARAF.
| 5. NRAS |
NRAS es una de las tres proteínas de la familia de proteínas RAS, que se encuentran en su forma activa cuando se unen a GTP y en su forma inactiva cuando se unen a GDP. La proteína RAS activada envía señales a través de la cascada de MAP quinasa para promover actividades proliferativas y antiapoptóticas. NRAS es la segunda mutación conductora más común en el melanoma cutáneo, solo superada por BRAF, y se encuentra en 25 a 30% de los casos. Estas mutaciones ocurren con frecuencia en el exón 2, lo que lleva a una sustitución de AA en la posición 61 (glutamina por arginina, lisina o histidina).32]. Las mutaciones oncogénicas más comunes en RAS interfieren con el retorno de RAS a un estado inactivo unido a GDP, que es catalizado por proteínas activadoras de GTPasa.
Los pacientes con mutación NRAS con melanoma avanzado en el momento del diagnóstico tienen una supervivencia general significativamente más corta (15,5 meses frente a 23,5 meses). A pesar de su prevalencia e importancia en el melanoma, históricamente el RAS no ha demostrado ser susceptible de tratamiento directo debido a la falta de un tratamiento fácilmente farmacológico. Los fármacos competitivos con GTP están limitados por la afinidad extremadamente alta de RAS por GTP y las altas concentraciones intracelulares de GTP.
| 6. ERK |
ERK, un efector posterior de la vía MAPK, cataliza la fosforilación de factores de transcripción nucleares una vez que está en su estado activo. La señalización de ERK en el melanoma se vuelve independiente de los mecanismos de retroalimentación debido a mutaciones en BRAF y NRAS. Además, la señalización de ERK se mantiene sin hiperactivación y posterior detención o muerte del ciclo celular debido a la regulación de retroalimentación intrínseca a través de la transcripción DUSP. La señalización de ERK se restablece en pacientes que adquieren resistencia a la inhibición de RAF y MEK, generando un interés en apuntar directamente a ERK para abordar la resistencia.
| 7. Mutaciones atípicas de BRAF |
Melanomas con mutación de carácter atípico BRAF abarcan una alteración genética diversa y a menudo se subdivide en mutantes V600 y no V600. Cada mutación se clasifica en clases I, II o III según su mecanismo de señalización y actividad quinasa, lo que conduce a diferentes grados de desregulación molecular. Las extrañas mutaciones, BRAF V600 que incluyen V600R/D/M/L, son monómeros activadores de quinasas que se encuentran característicamente en pacientes varones mayores con antecedentes de daño solar crónico. Los mutantes distintos de V600 se pueden clasificar como clase II (p. ej., L597P/Q/R/S, K601E, G469R/S/A) o III (G596R, D594Y/N/G/E, D287Y) dependiendo de la formación de dímeros para activar RAF quinasas o heterodímeros que alteran la actividad quinasa por completo, lo que resulta en una activación paradójica de la señalización ERK, respectivamente.
Normalmente, los tumores de clase II y III presentan un curso clínico más agresivo y se asocian con un peor pronóstico. Las mutaciones atípicas de BRAF se observan con mayor frecuencia en el melanoma mucoso.
| 8. Inhibición de MEK CDK4/6 + |
El cincuenta por ciento de los melanomas mutantes NRAS tienen aberraciones genéticas en genes asociados al ciclo celular, lo que proporciona una justificación para combinar inhibidores de MEK con inhibidores de CDK4/6. Los inhibidores de CDK4/6 provocan la detención del ciclo celular al impedir que el complejo CDK4/6-ciclina D1 fosforile la proteína del retinoblastoma. Un estudio preclínico utilizando las líneas celulares de melanoma humano mutantes NRAS revelaron efectos sinérgicos tanto en la apoptosis como en la detención del ciclo celular con la correspondiente regresión tumoral. Actualmente, se está llevando a cabo un ensayo de fase II que evalúa la eficacia del inhibidor pan-RAF naporafenib combinado con ribociclib en pacientes con enfermedad metastásica o irresecable.NRAS-Melanoma mutado está en progreso.
| 9. SHP2 |
La proteína tirosina fosfatasa 2, o SHP2, ha sido recientemente la base para nuevos enfoques de terapia dirigida. SHP2 funciona como una proteína tirosina fosfatasa involucrada en la activación de varias vías de señalización, incluidas RAS/Raf/MAPK, PI3K/ AKT, JAK/STAT y PD-1/PD-L1. En consecuencia, la modulación de la actividad de SHP2 puede afectar la supervivencia celular y las vías de regulación inmune.
| 10. Autofagia |
Los melanomas que han adquirido resistencia a la inhibición de BRAF más MEK a menudo se caracterizan por una enfermedad que progresa rápidamente. Uno de los mecanismos de resistencia que se ha identificado es la autofagia, un proceso celular adaptativo en el que proteínas anormales, organelas dañadas y patógenos se descomponen mediante degradación lisosomal para reciclar componentes celulares en precursores moleculares y energía para facilitar la autorrenovación.
Específicamente, la inhibición de MEK1/2 aumenta el flujo autofágico al activar el eje de señalización LKB1-AMPK-ULK1 en células cancerosas impulsadas por RAS. Por lo tanto, la autofagia se ha convertido en un objetivo racional para superar la resistencia BRAF/MEK.
| 11. Objetivos epigenéticos |
EZH2 codifica una subunidad catalítica del complejo represivo Polycomb 2 (PRC2), que facilita la trimetilación de la histona H3 lisina 27. PRC2 juega un papel clave en la regulación epigénica mediante la promoción de la compactación de la cromatina. EZH2 se expresa altamente en el melanoma primario y metastásico humano y se considera necesario para la melanogénesis, la proliferación y las metástasis; su expresión se asocia con un peor pronóstico. Mutaciones puntuales de EZH2 dan como resultado una ganancia de función en el 5% de los melanomas y a menudo se encuentran en coexistencia con activadores BRAF que pueden indicar un sinergismo oncogénico.
| 12. BAP1 and HDAC |
La proteína 1 asociada a BRCA1 (BAP1) es un gen supresor de tumores que frecuentemente muta en melanomas uveales metastásicos en las últimas etapas de la melanomagénesis. La mutación produce una pérdida de función del gen e impulsa a las células a desdiferenciarse y adquirir propiedades similares a tallos con mayor capacidad de autorreplicación. Las alteraciones en las regulaciones epigenéticas contribuyen a este fenotipo, como lo demuestra la restauración de la diferenciación de los melanocitos cuando las células de melanoma uveal con mutaciones BAP1 se tratan con inhibidores de la histona desacetilasa (HDAC). Sin embargo, no se ha establecido la eficacia clínica de los inhibidores de HDAC.
| 13. Inmunoterapia potenciada |
La llegada de la inmunoterapia ha representado el avance más significativo en la atención de los pacientes con melanoma avanzado desde los esfuerzos iniciales con la terapia sistémica hace muchos años. Si bien se ha informado que la mediana de sobrevida alcanza los 72,1 meses en pacientes tratados con la combinación ipilimumab/nivolumab, este enfoque puede verse limitado por importantes eventos adversos inmunológicos relacionados con el tratamiento y el desarrollo de resistencia.
Se han emprendido varios enfoques novedosos para combinar la inmunoterapia con agentes de terapia dirigida para superar la resistencia y mejorar los resultados. Un enfoque bien establecido ha sido revertir el efecto inmunosupresor de los factores proangiogénicos en el microambiente tumoral utilizando inhibidores de la tirosina quinasa que interfieren con la señalización del VEGF para aumentar la eficacia antitumoral de los inhibidores de PD-1/L1.
| 14.Conclusiones |
El panorama terapéutico para el melanoma avanzado ha experimentado una expansión significativa en las últimas décadas. A pesar de los avances en inmunoterapia y terapias dirigidas que han revolucionado el paradigma de tratamiento del melanoma, existe una necesidad persistente de desarrollar terapias novedosas, particularmente para pacientes que han progresado o para aquellos pacientes que no son buenos candidatos para terapias basadas en el sistema inmunológico.
La identificación de mutaciones impulsoras para el diseño racional de nuevas terapias dirigidas será de vital importancia para seguir optimizando los resultados clínicos y lograr la difícil cura del melanoma.
Resumen, traducción y comentario objetivo: Dr. Esteban Crosio