Introducción
Dada la alta prevalencia de los trastornos cognitivos en la edad adulta, los costos sociales de las demencias, la posibilidad terapéutica actual para la enfermedad tipo Alzheimer (DTA) y el papel cada vez mayor del médico de Atención Primaria en la detección de esta patología, existe una creciente necesidad de contar con un instrumento breve y fiable que permita detectar demencia en los estadios iniciales y que pueda utilizarse en la práctica clínica de rutina por el médico clínico general [1]. Aunque con este propósito se han desarrollado y utilizado diversos tests, ninguno se ha convertido individualmente en el estándar establecido [2]. El Mini-Mental State Examination (MMSE) [3] es, sin duda, el más validado y utilizado [4], incluso en poblaciones muy ancianas [5]. Desdichadamente, el MMSE falla en detectar demencia en los estadios iniciales. Esto se debe fundamentalmente
a dos razones:
1. Su escasa sensibilidad para objetivar déficit leves de memoria y de lenguaje como consecuencia del uso de tareas mnésicas y lingüísticas muy simples. Esto constituye una debilidad importante, dado que los síntomas iniciales en la mayoría de los pacientes con DTA son los trastornos mnésicos y de denominación.
2. Su escasa sensibilidad para objetivar los déficit ejecutivos observados en la demencia frontotemporal (DFT).
Existe consenso sobre la utilidad del MMSE para el control clínico longitudinal del deterioro cognitivo [6,7]. Otros instrumentos, como el CAMCOG [8], el test de Barcelona [9], el Dementia Rating Scale (DRS) [10,11] y la evaluación neuropsicológica estándar [12] presentan la dificultad de requerir personal especializado y equipamiento con los que usualmente no cuenta el médico clínico general.
El Addenbrooke’s Cognitive Examination (ACE) es una batería breve, de 15-20 minutos de duración, recientemente desarrollada y validada en inglés por Mathuranath et al [13] para detectar demencia. Estos autores proponen un coeficiente denominado VLOM, que se obtiene del ACE: (fluidez verbal + lenguaje) / (orientación + recuerdo diferido), y es de utilidad para diferenciar la DTA de la DFT. Recientemente, Bier et al [14] han confirmado la utilidad de la versión del ACE en francés para detectar demencia. Sin embargo, en este estudio el cociente VLOM no mostró utilidad para diferenciar la DTA de la DFT.
El estudio entre culturas del rendimiento en instrumentos cognitivos desarrollados y validados en el idioma inglés se necesita frecuentemente antes de adaptarlos en diferentes países. Los objetivos del presente trabajo fueron:
1. Validar en español el ACE para la detección de demencia en una población de idioma castellano con alto nivel educativo.
2. Estudiar la utilidad del coeficiente VLOM para diferenciar la DTA de la DFT. Este último punto es de especial interés debido a los recientes resultados de la versión en francés del ACE [14], que cuestionan la utilidad del coeficiente VLOM –previamente sugerida por Mathuranath et al [13]– para diferenciar una probable EA de una posible DFT sugerida.
Pacientes y médicos
El ACE evalúa seis dominios cognitivos. La puntuación máxima obtenible es 100: orientación (10), atención (8), memoria (35), fluencia verbal (14), lenguaje (28) y habilidades visuoespaciales (5). A su vez, permite calcular los 30 puntos del MMSE, ya que se incluyen en el cuestionario. Si comparamos ambas pruebas, mientras el MMSE asigna 3/30 puntos a la función memoria, el ACE le asigna 35/100, lo que permite evaluar el aprendizaje serial. También agrega el examen de la fluencia verbal y amplía el del lenguaje:
suma 10 objetos más a la prueba de denominación, evalúa así más profundamente la lectura de palabras e incluye una prueba de comprensión más exigente. Con respecto a las funciones visuoespaciales, además de los pentágonos cruzados del MMSE, se pide al paciente el dibujo de un cubo y de un reloj. En la traducción al español se adaptó la prueba de aprendizaje y recuerdo del nombre y la dirección, y se mantuvo el número de palabras utilizadas; en la prueba de memoria semántica se realizó una adaptación cultural, y tanto en la repetición de palabras y frases como en la lectura de vocablos regulares e irregulares, se consideró el tamaño y la frecuencia de uso de las palabras y frases.
Población
La validación se realizó sobre 128 pacientes del Servicio de Neurología Cognitiva, Neuropsicología y Neuropsiquiatría del FLENI. Se estudiaron tres grupos: 52 controles, 22 con diagnóstico de probable DFT y 54 con diagnóstico de probable DTA (CDR de 0,5-1). Todos los participantes del estudio se seleccionaron después de la revisión de 300 historias clínicas de la sección de Neurología Cognitiva, Neuropsicología y Neuropsiquiatría del FLENI. La revisión de la historia clínica se realizó de modo sistemático, consecutivo, y sin sesgos en la selección. Se incluyeron los casos dudosos, que posteriormente evolucionaron (o no) a DTA o a DFT. Los evaluadores estaban ciegos al diagnóstico (Tabla I).
La división entre los controles y el grupo de demencia se realizó según los criterios del DSM-IV [15]. El diagnóstico de DTA probable se realizó de acuerdo con los criterios del NINCS-ADRDA [16]. Para el diagnóstico de DFT se emplearon los criterios establecidos en el consenso de Lund y Manchester [17]. El grupo control estaba contituido por familiares de los pacientes o voluntarios sanos. Los criterios de exclusión fueron: presencia de depresión, patología cerebrovascular concomitante, antecedentes de adicción o de abuso de sustancias, y presencia de otras causas de probable deterioro cognitivo.
Evaluación clínica y neuropsicológica
Todos los sujetos participantes en el estudio se evaluaron por medio de una batería neuropsicológica y neuropsiquiátrica estándar, como parte de la evaluación diagnóstica que reciben en la clínica de memoria de la sección de Neurología Cognitiva, Neuropsicología y Neuropsiquiatría del FLENI. En esta clínica multidisciplinaria se les realizó a los pacientes una resonancia magnética (RM), que se informó por evaluadores independientes, tomografía computarizada por emisión de fotón único (SPECT) en los casos de DFT y análisis de sangre completos, con el objetivo de excluir otras causas de deterioro cognitivo. La batería neuropsicológica consistió en los siguientes tests: Rey Auditory Verbal Learning Test, Logical Memory Subtest del Weschler Memory Scale revisado, Trail Making Test A y B, figura compleja de Rey, test de denominación de Boston, Wisconsin Card Sorting Test, Letter- Number (subtest del Weschler Adult Intelligent Scale III) y Digit Span. La batería neuropsiquiátrica estuvo constituida por el Cambridge Behavioural Inventory [18] y por el Neuropsychiatric Inventory [19]. Se evaluó a todos los pacientes con el ACE y el CDR. Los evaluadores eran ciegos con respecto a los antecedentes de cada paciente. A todos los pacientes se les realizó un control clínico entre 6 y 18 meses. El diagnóstico se basó en un consenso entre los neurólogos, neuropsiquiatras y neuropsicólogos del equipo, tomando en consideración los resultados obtenidos en las distintas pruebas diagnósticas sin tener en cuenta el ACE.
.bmp)
Figura 1. ACE: ubicación de los casos con el punto de corte 86. Los puntos de la izquierda representan los pacientes con demencia: los falsos negativos (7,9%) son los puntos ubicados por encima de la línea de punto de corte de 86. Los puntos de la derecha representan las puntuaciones de los controles: los falsos positivos son los puntos ubicados por debajo de la línea de punto de corte de 86 (el 3,8%).
Control DFT DTA p 12,33 (3,060).
Sexo . . . . Hombres 24 11 21 > 0,60a Mujeres 28 11 33 Edad 69,71 (8,069) 71,50 (6,617) 73,02 (7,666) > 0,08 Educación
12,59 (4,636) 11,06 (3,828) > 0,09 b ACE 93,12 (3,617) 76,36 (8,952) 67,96 (14,073) < 0,001 b,c MMSE 29,19 (0,715) 26,32 (2,918) 23,56 (4,027) < 0,001 b,d Pruebas significativas en cursiva. a Test de chi al cuadrado. b Test de Kruskal- Wallis. c Control > DFT = DTA. d Control > DFT > DTA.
Tabla I. Variables demográficas: medias (DE)
Análisis estadístico
Se investigó la diferencia entre las edades medias y años de educación para los tres grupos mediante análisis de la varianza (ANOVA). Cuando las varianzas no fueron omogéneas (test de Levene), se efectuaron las comparaciones mediante el correspondiente test no paramétrico de Kruskal-Wallis. La diferencia de proporciones entre los sexos para los tres grupos se analizó mediante el test de chi al cuadrado. Se estudió, mediante regresión lineal múltiple, la relación entre la puntuación total del ACE como variable dependiente y las variables de regresión sexo, edad y años de educación.
La consistencia interna del cuestionario se evaluó mediante el coeficiente α de Cronbach [20], basado en la correlación inter-items promedio. Se midió la fiabilidad split-half, que consiste en dividir la escala en dos mitades y examinar el coeficiente α entre ellas.
La elección del punto de corte de la puntuación total del ACE se efectuó mediante la curva ROC (del inglés receiver operating characteristics), junto con la cual se determinaron los valores pronósticos positivos –la probabilidad de que un individuo con resultado positivo tenga la patología– y negativos –la probabilidad de que un individuo con resultado negativo no tenga la patología– para diferentes prevalencias teóricas (5, 10, 20 y 30%). También se estudiaron curvas ROC comparativas para el ACE y para el MMSE para comparar sus capacidades discriminatorias.
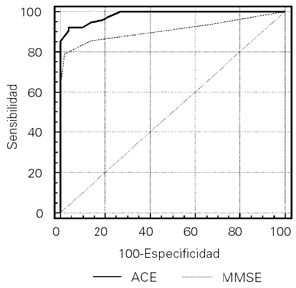
Figura 2. Curvas ROC comparativas entre ACE y MMSE.
|
Punto de corte | Demencia en general |
VPP para prevalencias teóricas | |||||
| . | Sensibilidad | Especificidad | 5% | 10% | 20% | 30% | |
| ACE | 83 | 85,5 | 100,0 | 100 | 100 | 100 | 100 |
| . | 86 a | 92,1 | 96,2 | 55,8 | 72,7 | 85,7 | 91,1 |
| . | 91 | 100,0 | 73,1 | 16,4 | 29,2 | 48,1 | 61,4 |
| MMSE | 26 | 63,2 | 100,0 | 100 | 100 | 100 | 100 |
| . | 27a | 78,9 | 98,1 | 68,4 | 82,0 | 91,1 | 94,6 |
| . | 28 | 85,5 | 86,5 | 25,1 | 41,4 | 61,4 | 73,1 |
| a Punto de corte propuesto. | |||||||
Tabla II. Puntos de corte y VPP (valor pronóstico positivo) para demencia en general.
Para evaluar la dependencia de la asignación de demencia, de acuerdo con el punto de corte propuesto de ACE, con el sexo, edad y educación, se utilizó la regresión logística binaria.
Las diferencias entre las medias de los dominios para los grupos DFT y DTA se analizaron mediante el test t de Student para muestras independientes, si se pudo probar la homogeneidad de varianzas; en caso contrario, se utilizó el test no paramétrico de Mann-Whitney.
En todos los casos se consideró significativa una probabilidad de error menor que el 5%. Se utilizó el programa informático SPSS 10.0, Medcalc e InfoStat.
Resultados
Las edades medias no difirieron significativamente (F2;125 = 2,463; p = 0,089). Tampoco hubo diferencia significativa entre los años de educación para los tres grupos (debido a que no pudieron homogeneizarse las varianzas, se utilizó el test de Kruskal-Wallis: χ22 = 4,736, p = 0,094).
El coeficiente α de Cronbach fue de 0,8137, para 127 casos y 21 elementos –se considera aceptable un coeficiente mayor de 0,70, y excelente, mayor de 0,80–. Al dividir la escala en dos mitades en forma aleatoria, para la primera mitad, que constó de 11 variables, el α fue de 0,7943, y para la segunda mitad (10 variables) fue de 0,6766. Estos resultados indican una aceptable consistencia interna de los elementos del test.
| . |
DFT |
DTA |
p (unilateral) |
| Orientación | 8,91 (1,342) | 7,43 (2,220) | 0,0004 a |
| Atención y concentración | 7,41 (1,141) | 6,91 (1,496) | 0,081 |
| Memoria total | 23,4(5,644) | 18,96 (7,371) | 0,007 |
| Aprendizaje de nombre y dirección | 16,8(3,444) | 14,63 (5,574) | 0,0495 |
| Recuerdo de nombre y dirección | 2,57 (2,014) | 1,57 (1,996) | 0,028 |
| Memoria retrógrada | 2,52 (4,504) | 1,91 (1,496) | 0,057 |
| Fluencia verbal | 7,38 (2,578) | 6,91 (2,883) | 0,256 |
| Lenguaje | 26,00(2,470) | 24,96 (3,138) | 0,089 |
| Habilidades visuoespeciales | 3,95 (1,024) | 2,74 (1,592) | 0,0015 a |
| Pruebas significativas en cursiva. a Test de Mann-Whitney. | |||
Tabla III. Dominios: medias (DE).
La puntuación total de ACE no mostró dependencia con el sexo ni con la edad, pero sí con los años de educación, con un coeficiente de regresión de 1,414 e intervalo de confianza del 95% (IC 95%) de 0,687-2,142. De la curva ROC de ACE con el grupo control frente a demencia, se eligió el punto de corte de 86, ya que logró la mayor sensibilidad (92,1%; IC 95%: 83,6-97,0) junto con la mayor especificidad (96,2%; IC 95%: 86,8- 99,4)– (Tabla II y Fig. 1).
En la regresión logística, con ‘presencia o ausencia de demencia’ como variable dependiente dicotómica en función de sexo, edad y años de educación como covariables, cuando se tomó 86 como punto de corte para el ACE ninguna de las variables pronósticas fue significativa. Este resultado refuerza la elección del punto de corte de 86, con el cual el diagnóstico de demencia no depende del sexo, ni de la edad ni de la escolaridad del paciente.
Además, se compararon las áreas debajo de las curvas ROC para el ACE y el MMSE, para evaluar la capacidad de ambos tests de discriminar entre el grupo control y el de demencia. De la curva comparativa, que muestra un área de 0,984 para el ACE y 0,908 para el MMSE, con una p < 0,01 para la diferencia, se desprende la mayor sensibilidad y especificidad del ACE sobre el MMSE para el diagnóstico de demencia (Fig. 2).
Al estudiar los diferentes dominios cognitivos en los dos grupos de pacientes, se encontró que las puntuaciones medias en los pacientes con DTA eran significativamente menores que en los pacientes con DFT en los siguientes dominios: orientación, memoria total, aprendizaje y recuerdo de nombre y dirección y habilidades visuoespaciales (Tabla III).
Para intentar una relación entre los distintos subelementos, el ACE permite obtener un coeficiente que se obtiene de la división entre la suma de fluidez verbal más lenguaje, dividido por la orientación más el recuerdo diferido del nombre y dirección. Este cociente se denomina VLOM y permite una orientación sobre qué tipo de patología puede sufrir el paciente (Fig. 3).
El punto de corte óptimo del VLOM para discriminar entre DFT y DTA es 4,12, con el cual se logra una sensibilidad del 95,5% para DFT (IC 95%: 77,1-99,2), y una especificidad para DFT del 40,7% (IC 95%: 27,6-55,0) (Tabla IV). Con estos datos habría una banda de incertidumbre entre 1,82 y 4,87, con un 100% de especificidad por encima de 4,87 para DTA y un 100% de especificidad por debajo de 1,82 para DFT.
Discución
Este estudio evidenció dos hallazgos de importancia:
– La versión en español del ACE es una herramienta de adecuada sensibilidad (92%) para detección de demencia en una población de alto nivel educativo.
– El coeficiente VLOM del ACE en español permite una orientación para el diagnóstico diferencial entre DTA y DFT. Para el ACE, el punto de corte más eficaz en la detección de casos con demencia en este estudio fue de 86, basado en la mayor sensibilidad y especificidad y reforzado por el hecho de que, con este punto de corte, la asignación de demencia no depende del sexo, edad ni años de educación. Con respecto al coeficiente VLOM, nuestros resultados coinciden con la publicación original, pero son discordantes con los obtenidos que emplean la versión francesa del ACE, que no encontró útil este coeficiente para diferenciar DTA de DFT. Muy probablemente, estas diferencias se deban al hecho de que el grupo francés utilizó distintos criterios clínicos para el diagnóstico de la DFT [14].
En el presente estudio, las diferencias más importantes entre los grupos se registraron en orientación, memoria total, aprendizaje y recuerdo de nombre y dirección, y habilidades visuoespaciales. El ACE puede realizarse en un tiempo breve (entre 15 y 20 min). Comparado con el MMSE, brinda más información en memoria, denominación y visuoespacialidad, e incorpora además la medición de funciones ejecutivas (p. ej., fluencia verbal, prueba del reloj). Además, contiene en su estructura al MMSE, lo que permite que se pueda tomar en pacientes cuyas evoluciones se realizaban con ese elemento de screening, o en pacientes muy deteriorados. Las modificaciones y ampliaciones que se observan en el ACE en los distintos dominios mejoran sustancialmente diversos aspectos del MMSE que han recibido críticas [21].
Considerando que los trastornos en la denominación son uno de los síntomas cardinales de la DTA y constituyen un síntoma de la DFT, el ACE, al aumentar de 2 a 12 la cantidad de figuras que se debían denominar, incrementa significativamente la sensibilidad. Lo mismo se observa con respecto a las pruebas de memoria.
Si bien las muestras se homogeneizan en cuanto a edad y años de educación, se debe destacar y advertir que la población estudiada tiene como característica una escolaridad promedio de 12 años. Dicho nivel de escolaridad no es representativo de toda la población de Argentina: los puntos de corte deben tomarse cuidadosamente, dado que, si bien la puntuación total del ACE no depende del sexo ni de la edad, sí lo hace con respecto a los años de educación. Para realizar una interpretación adecuada de los valores del ACE, son esenciales cut-off scores estratificados por educación. Aunque un método de screening no detecta todos los cuadros demenciales, máxime cuando muchas veces estos trastornos pueden presentarse en una forma atípica y tener una afectación diferente de un dominio cognitivo dado [22,23], el presente estudio demuestra que el ACE en español representa una batería confiable para detectar demencia y orientar el diagnóstico diferencial entre el DTA y DFT en la práctica clínica de rutina. Se necesitan futuros estudios para validar la utilidad del ACE en el control clínico longitudinal de pacientes, en la medición de respuesta al tratamiento, así como su utilidad en otras patologías y en poblaciones con menor nivel educativo.
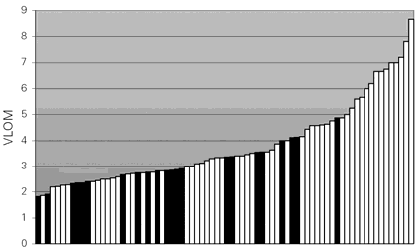
Figura 3. Diagrama de barras del cociente VLOM = (fluencia verbal + lenguaje) / (orientación + memoria). Barras negras: pacientes DFT; barras blancas: pacientes DTA.
| Puntos de corte |
≤ 1,82 |
≤ 4,12 |
≤ 4,87 |
|
Sensibilidad para DFT |
4,5 (0,8-22,9) |
95,5 (77,1-99,2) |
100,0 (84,4-100,0) |
|
Especificidad para DFT |
100,0 (93,3-100,0) |
40,7 (27,6-55,0) |
25,9 (15,0-39,7) |
|
Sensibilidad para DTA |
100,0 (93,3-100,0) |
40,7 (27,6-55,0) |
25,9 (15,0-39,7) |
|
Especificidad para DTA |
4,5 (0,8-22,9) |
95,5 (77,1-99,2) |
100,0 (84,4-100,0) |
Tabla IV. Puntos de corte del cociente VLOM: sensibilidad y especificidad para DFT y DTA con distintos puntos de corte.
Bibliografía
1. Gifford DR, Cummings JL. Evaluating dementia screening tests: methodologic standards to rate their performance. Neurology 1999; 52: 224-7.
2. Boustani M, Peterson B, Hanson L, Harris R, Lohr KN. US Preventive Services Task Force. Screening for dementia in primary care: a summary of the evidence for the US Preventive Services Task Force. Ann Intern Med 2003;138: 927-37.
3. Folstein M, Folstein S, Mchugh P. Mini-mental state. A practical method for grading the cognitive status of patients for the clinician. J Psychiatr Res 1975; 12: 189-98.
4. Lezak M. Neuropsychological assessment. 3 ed. New York: Oxford University Press; 1995.
5. Dufouil C, Clayton D, Brayne C, Chi LY, Dening TR, Paykel ES, et al. Population norms for the MMSE in the very old: estimates based on Tabla IV. Puntos de corte del cociente VLOM: sensibilidad y especificidad para DFT y DTA con distintos puntos de corte.Puntos de corte ≤ 1,82 ≤ 4,12 ≤ 4,87 Sensibilidad para DFT 4,5 (0,8-22,9) 95,5 (77,1-99,2) 100,0 (84,4-100,0) Especificidad para DFT 100,0 (93,3-100,0) 40,7 (27,6-55,0) 25,9 (15,0-39,7) Sensibilidad para DTA 100,0 (93,3-100,0) 40,7 (27,6-55,0) 25,9 (15,0-39,7)Especificidad para DTA 4,5 (0,8-22,9) 95,5 (77,1-99,2) 100,0 (84,4-100,0) Figura 3. Diagrama de barras del cociente VLOM = (fluencia verbal + lenguaje) / (orientación + memoria). Barras negras: pacientes DFT; barras blancas: pacientes DTA. longitudinal data. Mini-Mental State Examination. Neurology. 2000; 55:1609-13.
6. Morris JC, Heyman A, Mohs RC, Hughes JP, Van Belle G, Fillenbaum G, et al. The Consortium to Establish a Registry for Alzheimer’s Disease (CERAD). Part I. Clinical and neuropsychological assessment of Alzheimer’s disease. Neurology 1989; 39: 1159-65.
7. Teng EL, Chui HC, Schneider LS, Metzger LE. Alzheimer’s dementia:performance on the Mini-Mental State Examination. J Consult Clin Psychol 1987; 55: 96-100.
8. Roth M, Tym E, Mountjoy CQ, Huppert FA, Hendrie H,Verma S, et al.CAMDEX. A standardised instrument for the diagnosis of mental disorderin the elderly with special reference to the early detection of dementia. Br J Psychiatry 1986; 149: 698-709.
9. Peña-Casanova J. Programa integrado de exploración neuropsicológica.Test de Barcelona. Barcelona: Masson; 1990.
10. Mattis S. Mental status examination for organic mental syndrome in the elderly patient. In Bellak L, Karasu TB, eds. Geriatric psychiatry. New York: Grune & Stratton; 1976. p. 77-122.
11. Mattis S. Dementia Rating Scale (DRS). Odessa, FL: Psychological Assessment Resources: 1988.
12. Geldmacher DS, Whitehouse PJ. Evaluation of dementia. N Engl J Med 1996; 335: 330-6.
13. Mathuranath PS, Nestor PJ, Berrios GE, Rakowicz W, Hodges JR. A brief cognitive test battery to differentiate Alzheimer’s disease and frontotemporal dementia. Neurology 2000; 55: 1613-20.
14. Bier JC, Ventura M, Donckels V, Van Eyll E, Claes T, Slama H, et al. Is the Addenbrooke’s Cognitive Examination effective to detect frontotemporal dementia? J Neurol 2004; 251: 428-31.
15. American Psychiatric Association. Diagnostic and statistical manual of mental disorders. 4 ed. Washington DC: APA; 1994.
16. McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM.Clinical diagnosis of Alzheimer’s disease: report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer’s Disease. Neurology 1984; 34: 939-44.
17. Neary D, Snowden JS, Gustafson L, Passant U, Stuss D, Black S, et al.Frontotemporal lobar degeneration: a consensus on clinical diagnostic criteria. Neurology 1998; 51: 1546-54.
18. Chen EY, Shapleske J, Luque R, McKenna PJ, Hodges JR, Calloway SP, et al. The Cambridge Neurological Inventory: a clinical instrument for assessment of soft neurological signs in psychiatric patients. Psychiatry Res 1995; 56: 183-204.
19. Cummings JL, Mega M, Gray K, Rosenberg-Thompson S, Carusi DA,Gornbein J. The Neuropsychiatric Inventory: comprehensive assessment of psychopathology in dementia. Neurology 1994; 44: 2308-14.
20. Cronbach LJ. Coefficient alpha and the internal structure of tests. Psychometrika 1951; 16: 297-333.
21. Feher EP, Mahurin RK, Doody RS, Cooke N, Sims J, Pirozzolo FJ. Establishing the limits of the Mini-Mental State. Examination of ‘subtests’. Arch Neurol 1992; 49: 87-92.
22. Galton CJ, Patterson K, Xuereb JH, Hodges JR. Atypical and typical presentations of Alzheimer’s disease: a clinical, neuropsychological, neuroimaging and pathological study of 13 cases. Brain 2000; 123: 484-98.
23. Benedet MJ. Alteraciones de la comunicación verbal y alteraciones del lenguaje en las demencias corticales (I). Estado actual de la investigación. Rev Neurol 2003; 36: 966-79.
24. Lecours-André R, Peña-Casanova J, Diéguez-Vide F. Dislexias y disgrafías: teoría, formas clínicas y exploración Barcelona: Masson; 1998.