Introducción
La principal preocupación después de una resección de la pared torácica, es el mantenimiento de la estabilidad e integridad del tórax [1]. Una resección amplia resulta frecuentemente en un gran defecto de la pared torácica, con inestabilidad, disrupción de la mecánica pulmonar y considerables complicaciones respiratorias. Esas secuelas son particularmente percibidas cuando se resecan múltiples costillas o el esternón [2]. La reconstrucción protege además a los órganos torácicos, previene el atrapamiento de la escápula y mantiene la forma cosmética de la pared torácica [3]. Se acepta generalmente que los defectos de menos de 5 cm de diámetro usualmente no requieren reconstrucción. Los defectos posteriores de menos de 10 cm de diámetro, también pueden ser cerrados con seguridad sin reconstrucción, siempre y cuando no haya riesgo de atrapamiento de la punta de la escápula [4]. Para los defectos más grandes, no existe consenso sobre el método ideal de reconstrucción y se han reportado distintos resultados en la literatura quirúrgica [5].
La fijación rígida con metacrilato o prótesis metálicas, ha sido tradicionalmente considerada como el mejor método para lograr la estabilidad de la pared torácica y prevenir las complicaciones respiratorias [4-6]. No obstante, si surge una infección, la presencia de material extraño rígido, complica significativamente el manejo. En consecuencia, una reparación ideal debería mantener adecuadamente la estabilidad de la pared torácica, para prevenir las complicaciones pulmonares, pero evitando la fijación rígida. El propósito de este estudio fue examinar el rol de los colgajos miocutáneos pediculados, con o sin prótesis blanda, en la reconstrucción de defectos pequeños y grandes de la pared torácica.
Material y métodos
Después de la aprobación del comité de ética, todos los pacientes que fueron sometidos a una resección mayor por tumores primarios o metastásicos de la pared torácica, en una institución de atención terciaria, afiliada a universidad, entre 2003 y 2010, fueron identificados en una base de datos prospectivamente ingresados. Todos los pacientes con cánceres primarios de pulmón o pleura, con invasión de la pared del tórax, fueron excluidos para eliminar potenciales factores de confusión, dado que las complicaciones respiratorias fueron el resultado de mayor interés. Entre los pacientes incluidos, 4 habían sido sometidos a resecciones pulmonares previas no relacionadas y 3 tuvieron 2 resecciones separadas de la pared torácica con reconstrucción.
A través de la revisión retrospectiva de las historias clínicas, se registró la información sobre las características de los pacientes, incluyendo edad, sexo, naturaleza del tumor de la pared torácica y presencia de comorbilidad pulmonar. También se registró el tratamiento con radiación o quimioterapia neoadyuvantes. Los reportes operatorios y anatomopatológicos fueron revisados para conocer el número de costillas resecadas, resección concurrente del esternón o clavícula, tamaño del defecto residual y método de reconstrucción. Un análisis de regresión lineal identificó un punto de corte para el tamaño del defecto, como un predictor independiente para la reconstrucción con malla y, por lo tanto, los pacientes fueron estratificados en 2 grupos: aquellos que tenían un área de defecto pequeña < 60 cm2 (ADP) y aquellos que tenía un área de defecto grande ≥ 60 cm2 (ADG). Sólo se usaron mallas no rígidas compuestas de polipropileno (Marlex, Davol, Warwick, RI y Prolene, Ethicon, Inc, Somerville, NJ), poliéster (Mersilene, Ethicon) politetrafluoroetileno (Gore-Tex y Gore-Dualmesh, W.L. Gore & Associates, Inc, Flagstaff, AZ) y poliglactina-910 (Vicryl, Ethicon). Ningún paciente fue sometido a una fijación rígida con metil metacrilato o placas de metal.
Todas las complicaciones postoperatorias fueron identificadas de la base de datos con ingreso prospectivo. Las complicaciones pulmonares incluyeron neumonía y admisión a la unidad de cuidados intensivos (UCI) para ventilación asistida. La neumonía fue definida de acuerdo con las normas del Center for Disease Control and Prevention (CDC) [8]. La ventilación asistida fue definida como la necesidad de ventilación mecánica, ya sea con medios invasivos o no. La infección del sitio quirúrgico fue definida por la necesidad de abrir y drenar el sitio operatorio, independientemente de si se obtenía o no bacteriología. La infección de la malla fue definida como una colección líquida en la vecindad de la malla con bacterias comprobadas en la tinción de Gram o por cultivo. El resultado primario de interés fue la tasa de complicaciones pulmonares. Los resultados secundarios incluyeron la tasa de infecciones del sitio quirúrgico, infecciones de la malla, necesidad de reoperación, duración de la hospitalización y mortalidad intrahospitalaria. Los datos son presentados como medianas (rango) y la prueba exacta de Fisher o la prueba U de Mann-Whitney fueron usadas para determinar la significación estadística (P < 0,05).
Resultados
Un total de 37 pacientes fue incluido en el estudio. El 62% fueron hombres y la edad media para todos los pacientes fue de 49 años (rango, 19-75). Nueve pacientes fueron estratificados en el grupo de ADP y 28 en el grupo de ADG. Cuatro pacientes (11%) había sido sometidos a resección de la pared torácica en el pasado, todos ellos en el grupo ADG. Un equipo multidisciplinario, incluyendo cirujanos torácico, plástico y ortopédico, determinaron el método de reconstrucción para cada paciente. Aunque esa decisión se basó en el tamaño del tumor, su ubicación en la pared del tórax, número de costillas a ser resecadas y posibilidad de movilizar colgajos de tejido autólogo, la preferencia y el juicio del cirujano jugaron un papel mayor en la selección (Fig. 1).

• FIGURA 1: Ilustración de los pasos de la reconstrucción quirúrgica después de resección de la pared torácica. (A) apariencia preoperatoria del tumor de la pared del tórax. (B) defecto en la pared torácica después de la resección. (C) primer paso de la reconstrucción con prótesis blanda. (D) segundo paso de la reconstrucción, con colgajo miocutáneo y apariencia final.
En el grupo de ADP, el 33% de los pacientes era fumador, pero ninguno tenía diagnóstico de Enfermedad Pulmonar Obstructiva Crónica (EPOC), basado en las pruebas de función pulmonar. Los sarcomas primarios de la pared torácica fueron la indicación más común para la resección (57%), seguido por las metástasis en la pared del tórax (22%) y los tumores desmoides (14%). El tamaño medio del defecto creado en la pared torácica fue de 50,8 cm2 (rango, 14-59) en el grupo ADP y de 149,4 cm2 (rango, 60-405) en el grupo ADG (P = 0,001). La incidencia de resección parcial del esternón fue similar en ambos grupos (33% en el grupo ADG vs 27% en el grupo ADP; P = 0,12). En el grupo ADG, el 50% de los pacientes tuvo 3 o más costillas resecadas, mientras que ninguno en el grupo ADP (P = 0,007). La quimioterapia neoadyuvante fue suministrada al 18% de los pacientes en el grupo ADG, versus ninguno en el grupo ADP (P = 0,05). Se brindó radioterapia neoadyuvante al 14% de los pacientes en el grupo ADG, versus ninguno en el grupo ADP (P = 0,05; Tabla 1).
• TABLA 1: Características demográficas, tumorales y terapéuticas para todos los pacientes que fueron sometidos a resección y reconstrucción de la pared torácica.

No hubo diferencia significativa entre los 2 grupos en términos de utilización de colgajos de músculo autólogo, que fueron construidos en el 56% de los pacientes en el grupo ADP y en el 75% de los pacientes en el grupo ADG (P = 0,24). Cuando se construyó un colgajo, el músculo pectoral mayor fue utilizado en el 41% de los casos y el dorsal ancho en el 16%. Las prótesis blandas fueron empleadas mucho más frecuentemente en el grupo ADG (61% de los pacientes) que en el grupo ADP (11%; P = 0,018). Un cuarto de los pacientes en el grupo ADG (25%) requirió un injerto de piel para cubrir la reconstrucción, mientras que no fue necesario en ninguno del grupo ADP (P = 0,11; Tabla 2).
• TABLA 2: Parámetros de la resección y reconstrucción para ambas cohortes de pacientes

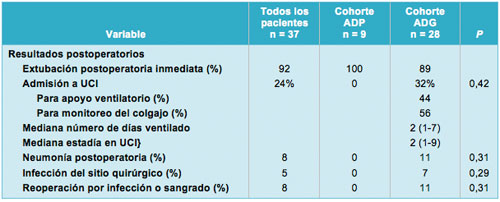
La tasa de extubación postoperatoria inmediata fue del 100% en el grupo ADP, vs 89% en el grupo ADG (P = 0,32). Los pacientes permanecieron intubados en el postoperatorio por varias razones, incluyendo tiempo operatorio prolongado, magnitud de la reconstrucción, necesidad de monitoreo del colgajo y analgesia en ausencia de un funcionamiento adecuado del catéter epidural. Todos los pacientes fueron exitosamente extubados al segundo día después de la operación. Un paciente fue reintubado al 3º día postoperatorio debido a un estado respiratorio deteriorado y permaneció intubado por 7 días. La tasa de admisión postoperatoria a la UCI fue del 0% en el grupo ADP y del 32% en el grupo ADG (P = 0,06). De los pacientes admitidos en la UCI, la mitad (56%) fueron admitidos para el monitoreo del colgajo muscular y no requirieron apoyo ventilatorio. De esos pacientes, el 75% había sido sometido a reconstrucción sólo con tejido autólogo, sin el uso de prótesis blandas. El numero medio de días en el ventilador fue 2 [1-7] y la mediana de la estadía en la UCI fue de 2 días [1-9]. Dos pacientes desarrollaron neumonía postoperatoria, ambos en el grupo ADG (7% vs 0% en el grupo ADP; P = 0,56). Se desarrolló infección del sitio quirúrgico en el 7% de los pacientes en el grupo ADG, pero ninguna en el grupo ADP (P = 0,56). Un paciente en el grupo ADG requirió reoperación para remoción de la malla debido a infección, mientras que el resto de los pacientes fueron tratados conservadoramente, ya sea con intervención local o antibióticos sistémicos. Otro paciente en el grupo ADG requirió reoperación por sangrado significativo, haciendo mayor la tasa de reoperación en el grupo ADG que en el grupo ADP (7% vs 0%, respectivamente; P = 0,56). La mediana de la duración de la estadía hospitalaria para el grupo ADP fue de 6 días (rango, 5-10), comparado con 9 días (rango, 7-15) en el grupo ADG (P = 0,41). Dos pacientes en el grupo ADG (7%) requirieron readmisión por embolia pulmonar y neumonía, respectivamente. No hubo mortalidad dentro del período postoperatorio de 30 días, Tabla 3.
• TABLA 3: Resultados postoperatorios en ambas cohortes de pacientes
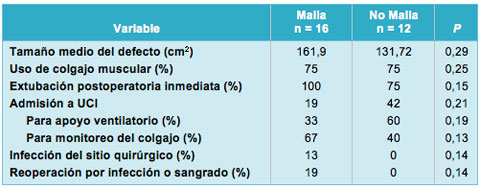
Se efectuó un análisis de subgrupo en la cohorte de ADG, apuntando a dilucidar todas las diferencias en los resultados postoperatorios, en los pacientes en los que se utilizó una prótesis (Malla) vs aquellos en los que la reconstrucción fue hecha sólo con tejidos autólogos (No Malla; Tabla 4). En la cohorte de No Malla, la incidencia de admisión en la UCI para apoyo ventilatorio fue más alta que en el grupo Malla (60% vs 33%; P = 0,19). En contraste, las tasas de infección del sitio quirúrgico y de reoperación fueron más altas en el grupo Malla. No se alcanzó significación estadística en ninguno de esos parámetros.
• TABLA 4: Análisis de subgrupo de los resultados postoperatorios en pacientes de la cohorte de defectos grandes
Los pacientes fueron vistos postoperatoriamente cada 3 meses durante los 2 primeros años después de la operación, luego a intervalos de 6 meses, con un período medio de seguimiento alejado de 42 meses. Durante cada visita, el paciente fue examinado con inspección visual de la cicatriz, palpación de la pared torácica, auscultación de los sonidos pulmonares y provocación de tos. Aunque no se suministraron cuestionarios para evaluar resultados postoperatorios específicos, los registros de las visitas no reportaron incidencia de disnea en el hogar, limitación de los ejercicios, requerimiento de oxígeno, tos crónica, dolor crónico, injuria nerviosa, deterioros del movimiento o defectos cosméticos, como percibidos por el paciente. A los pacientes no se les efectuó tomografía computada (TC) postoperatoria de manera rutinaria. En aquellos a los que se les realizó TC para el seguimiento oncológico, no se reportó, en ninguno, hernias pulmonares.
Discusión
En la institución de los autores de este trabajo, en los últimos 7 años, se ha realizado la reconstrucción de la pared torácica usando exclusivamente colgajos musculares autólogos y mallas no rígidas. Esa elección fue parte de su estrategia para abandonar la fijación rígida, debido a resultados largamente desalentadores, en términos de infección protésica, dolor postoperatorio y deformaciones de la pared torácica. En esta serie, la tasa de extubación postoperatoria inmediata, fue comparable con la de la mayoría de las series que usaron fijación rígida con metil metacrilato [7,9]. Esos mismos estudios demostraron una incidencia del 7-10% de derrames pleurales que requirieron drenaje, mientras que en la presente serie no hubo ninguno. Los autores han mostrado también, que la reconstrucción protésica con mallas no rígidas, conlleva una tasa más baja de infección del sitio quirúrgico (5%) que con la fijación rígida (7-20%) [7,9-11]. Más importante aún, han documentado la ausencia de infección de la prótesis, más allá de los 30 días de la cirugía, mientras que la infección retardada con el metil metacrilato ha sido reportada tan tarde como 12 meses después de la operación [7]. Es importante señalar que la tasa de reoperación por infección de la malla en esta serie (3%), fue considerablemente más baja que la usualmente asociada con la fijación rígida (8-12%) [7,9]. Aunque en la presente serie, la reconstrucción no rígida acarreó una tasa ligeramente más alta de neumonía postoperatoria que lo históricamente reportado para la fijación rígida, la duración de la estadía hospitalaria fue considerablemente más corta [7]. En el seguimiento alejado de 12 meses, los autores no han registrado ninguna incidencia de dolor crónico, deterioro neurológico o deformaciones cosméticas o en el movimiento, asociadas con la reconstrucción de la pared torácica con prótesis blandas. Esto contrasta con la fijación rígida, en donde el dolor alejado, la deformidad y la estética, han sido temas mayores con ese tipo de reconstrucción. Por lo tanto, los datos del presente trabajo sugieren que, cuando no se puede evitar el uso de material protésico, las prótesis no rígidas pueden ofrecer resultados más favorables a corto y largo plazo, que lo históricamente demostrado en la literatura, con la fijación rígida.
Asimismo, estos datos sugieren que la reconstrucción con colgajo miocutáneo, es crucial para la obtención de buenos resultados en los pacientes con defectos residuales grandes de la pared torácica. En la cohorte de pacientes con grandes defectos, los cirujanos de este estudio eligieron usar un colgajo miocutáneo en el 75% de los casos, aún cuando se usaba una prótesis. Aunque estos datos sugieren que la incidencia de admisión a la UCI y la incidencia de neumonía postoperatoria pueden ser más altas cuando se usa el colgajo miocutáneo, esa diferencia no alcanza significación estadística. Como era esperable, la incidencia de infección del sitio quirúrgico y de reoperación, son considerablemente más bajas cuando se usa sólo el colgajo miocutáneo, sin la malla, pero también sin significación estadística. Es importante enfatizar, sin embargo, que el tamaño pequeño de la muestra de este análisis de subgrupo, puede impedir la generación de resultados estadísticamente significativos, aún cuando esté presente una significación clínica. En consecuencia, estos datos sugieren que, para los defectos de la pared torácica mayores a 60 cm2, la reconstrucción puede hacerse sin usar material protésico, con pequeña diferencia en los resultados postoperatorios, pero con el posible requerimiento de ventilación prolongada. Es importante señalar que el tamaño del defecto, por sí solo, no es el único determinante de si se debe usar o no una malla en la reconstrucción. La ubicación del defecto en la pared del tórax (anterior vs posterior), el número de costillas resecadas y el hábito corporal del paciente (delgado vs obeso) son factores que no pueden ser ignorados, cuando se planifica la reconstrucción.
El presente estudio está limitado por varios factores. Aunque la información fue rigurosamente recolectada de una base de datos ingresados prospectivamente, la naturaleza retrospectiva del estudio predispone a un fuerte desvío de los datos, especialmente en relación con la elección de la técnica reconstructiva y la planificación operatoria. El pequeño número de pacientes incluido en este estudio, es un reflejo de la rareza de la resección electiva de la pared torácica por tumores primarios, pero también implica que las conclusiones tienen que ser extrapoladas desde una muestra de tamaño reducido. Finalmente, aunque los resultados postoperatorios a largo plazo estuvieron muy bien documentados en el seguimiento alejado, la falta de cuestionarios estandarizados y de pruebas de la función pulmonar, hacen difícil evaluar objetivamente esos datos y compararlos a través de todos los pacientes.
En conclusión, los autores de este trabajo han demostrado que, en los pacientes con defecto de la pared torácica menor de 60 cm2, parece haber poco beneficio en la reconstrucción con prótesis, porque los resultados postoperatorios con el cierre primario de la pared del tórax son excelentes. En los defectos de tamaño moderado, mayores de 60 cm2, y en pacientes cuidadosamente seleccionados, la reconstrucción sólo con colgajos miocutáneos pediculados ofrece resultados postoperatorios similares a la reconstrucción con prótesis no rígidas, a expensas de una posible necesidad de un corto período de ventilación mecánica.
♦ Comentario y resumen objetivo: Dr. Rodolfo D. Altrudi
Bibliografía
1. R. Nirula and J.C. Mayberry, Rib fracture fixation: controversies and technical challenges. Am Surg, 76 (2010), pp. 793–802.
2. K.A. Mansour, V.H. Thourani, A. Losken, J.G. Reeves, J.I. Miller and G.W. Carlson, et al. Chest wall resections and reconstruction: a 25-year experience. Ann Thorac Surg, 73 (2002), pp. 1720–1725.
3. C. Deschamps, B.M. Tirnaksiz, R. Darbandi, V.F. Trastek, M.S. Allen and D.L. Miller, et al. Early and long-term results of prosthetic chest wall reconstruction. J Thorac Cardiovasc Surg, 117 (1999), pp. 588–591.
4. J. Pfannschmidt, P. Geisbüsch, T. Muley, H. Hoffmann and H. Dienemann, Surgical resection of secondary chest wall tumors. Thorac Cardiovasc Surg, 53 (2005), pp. 234–239.
5. P.A. Thomas and L. Brouchet, Prosthetic reconstruction of the chest wall. Thorac Surg Clin, 20 (2010), pp. 551–558.
6. A. Granetzny, M. Abd El-Aal, E. Emam, A. Shalaby and A. Boseila, Surgical versus conservative treatment of flail chest. Evaluation of the pulmonary status. Interact Cardiovasc Thorac Surg, 4 (2005), pp. 583–587.
7. D. Lardinois, M. Müller, M. Furrer, A. Banic, M. Gugger and T. Krueger, et al. Functional assessment of chest wall integrity after methylmethacrylate reconstruction. Ann Thorac Surg, (2000), pp. 919–923.
8. T.C. Horan, M. Andrus and M.A. Dudeck, CDC/NHSN surveillance definition of health care–associated infection and criteria for specific types of infections in the acute care setting. Am J Infect Control, 36 (2008), pp. 309–332.
9. M.J. Weyant, M.S. Bains, E. Venkatraman, R.J. Downey, B.J. Park and R.M. Flores, et al. Results of chest wall resection and reconstruction with and without rigid prosthesis. Ann Thorac Surg, 81 (2006), pp. 279–285.
10. A. Losken, V.H. Thourani, G.W. Carlson, G.E. Jones, J.H. Culbertson and J.I. Miller, et al. A reconstructive algorithm for plastic surgery following extensive chest wall resection. Br J Plast Surg, 57 (2004), pp. 295–302.
11. R.R. Chang, B.J. Mehrara, Q.Y. Hu, J.J. Disa and P.G. Cordeiro, Reconstruction of complex oncologic chest wall defects: a 10-year experience. Ann Plast Surg, 52 (2004), pp. 471–479