Mundialmente, las tasas de mortalidad estandarizadas del cáncer gástrico (CG) son 14,3/100.000 en los hombres y 6,9/100.000 en las mujeres. La incidencia muestra variaciones regionales y sexuales bien claras—las tasas son más elevadas en el este asiático, este de Europa y Sudamérica y más bajas en el norte y el sur de África. El diagnóstico precoz es muy importante por la posibilidad que tiene el CG de dar metástasis tempranas en el hígado, páncreas, epiplón, esófago, conductos biliares y ganglios linfáticos regionales y distantes. Sobre la base de la evidencia surgida de grandes estudios aleatorizados y controlados, metaanálisis, estudios de cohorte y de casos y controles, los estudios de esta revisión tienen como objetivo delinear las estrategias preventivas, destacando los cuadros de presentación del CG, y orientar a los médicos generales en el diagnóstico precoz, la derivación al especialista y el tratamiento.
¿Qué es el cáncer gástrico?
El CG se refiere a los tumores del estómago que se originan en la mucosa gástrica (adenocarcinoma), tejido conectivo de la pared gástrica (tumores del estroma gastrointestinal) o del tejido linfático (linfomas).
Esta es una revisión sobre todo del adenocarcinoma gástrico, que constituye más del 90% de los CG y macroscópicamente se presenta como polipoide, ulcerado o infiltrante difuso (linitis plástica).
¿Quiénes padecen cáncer gástrico?
Los datos epidemiológicos de la American Cancer Society indican que el CG es el cuarto cáncer más común en los hombres, después del cáncer de pulmón, próstata y colorrectal, y el quinto más común en la mujer, después del cáncer de mama, cervical, colorrectal y de pulmón. Es responsable del 8% del total de casos de cáncer y del 10% de las muertes anuales por cáncer en todo el mundo. Tiene una mortalidad significativamente superior al porcentaje de casos (70%) que los cánceres de próstata (30%) y de mama (33%). Los hombres tienen 3 veces más posibilidad de desarrollar CG que las mujeres con un pico de la incidencia entre los 60 y los 84 años. La incidencia global de CG ha disminuido significativamente a lo largo del tiempo—la incidencia estandarizada de la edad en el Reino Unido disminuyó de 44/100.000 en 1975-77 a 18/100.000 en 2006-08). En parte, esto se debe a la disminución de la infección crónica por Helicobacter pylori y al tabaquismo en el mundo desarrollado, y por otra parte, al mayor uso de la refrigeración, la disponibilidad de frutas y vegetales frescos y la disminución del consumo de alimentos salados o en conserva.
¿Cuáles son los factores de riesgo de cáncer gástrico?
Helicobacter pylori
La infección por H. pylori es considerada el factor de riesgo de CG modificable más importante. Más de 2 mil millones de personas están infectadas en todo el mundo, aunque menos de 0,5 % desarrolla adenocarcinoma gástrico. Un metaanálisis de 34 cohortes y estudios de casos y controles encontró que H. pylori conlleva un riesgo relativo de CG de 3,02 en contextos de alto riesgo (China, Japón y Corea) y 2,56 en contextos de bajo riesgo (Europa Occidental, Australia, y Estados Unidos).
Consumo de cigarrillos
Un metaanálisis de 42 cohortes, casos-cohorte y estudios de casos y controles anidados, de Asia, Europa y EE.UU. halló que los fumadores tienen un riesgo relativo de 1,53 de desarrollar CG. Los resultados de un estudio retrospectivo de cohorte, de 699 pacientes, de los cuales el 59% eran fumadores actuales o ex fumadores mostraron que el uso del tabaco se asoció con un aumento del 43% en la recurrencia de la enfermedad y muerte por CG (riesgo 1,43). Fumar también fue un factor de riesgo independiente importante para otras mediciones de la recurrencia, entre ellas la supervivencia de 5 libre de enfermedad (1,46) y la supervivencia global (1,48). En un estudio de cohorte prospectivo noruego, con 69.962 participantes, el riesgo absoluto de CG fue 0,776% para los fumadores empedernidos (≥20 cigarrillos/día), 1,511% para los fumadores de muchos años (≥30 años) y 0,658% en los que nunca fumaron.
Alcohol
Un metaanálisis de 44 estudios de cohortes, 34 de casos y controles y 557 casos de CG halló un ligero aumento del riesgo (riesgo relativo [RR]: 1,07) en las personas con consumo de alcohol de leve a moderado y un aumento más pronunciado (1,20) en los bebedores de alcohol pesados (≥4 bebidas/día) 0,14. Un estudio retrospectivo de cohorte europeo calculó que un consumo elevado de alcohol (>60 g/día) añade un RR de CG de 1,65 y un riesgo absoluto de por vida de 0,256%.
Sal y conservación de los alimentos de la dieta
Un metaanálisis de estudios de cohorte del World Cancer Research Fund halló que cada gramo de sal consumida por día aumentó el RR de CG, en un factor de 1,08. Un estudio de cohorte prospectivo japonés con 2.467 participantes comprobó una asociación independiente entre la ingesta de sal y la incidencia de CG. En comparación con las personas que consumen menos de 10 g de sal/día, aquellos que consumen más de 16 g/día tenían un RR de desarrollar CG de 2,98. Esta correlación era más estrecha en presencia de infección por H. pylori y gastritis atrófica, lo que sugiere que la lesión de la mucosa inducida por la ingesta de sal aumenta el riesgo de persistencia de infección por H. pylori.
La falta de refrigeración y el uso de conservantes de alimentos en base a la sal se han asociado con un riesgo más elevado de CG en las regiones de bajo nivel socioeconómico. Un estudio transversal o de prevalencia coreano basado en datos estadísticos nacionales halló una mortalidad por CG estandarizada por la edad 3 veces menor, entre 1983 y 2007 (46,1/1.000.000 vs. 16,9/100.000), que se correlacionó significativamente y en forma independiente con un aumento del número de refrigeradores por hogar.
Frutas y verduras de la dieta
Un estudio sueco de cohorte de 82.002 participantes y un total de 139 casos de CG ha comprobado que una ingesta de 2-4 raciones de fruta y verdura por día disminuyeron el riesgo de CG en comparación con menos de una porción por día (razón de riesgo 0,56). Esto representa una reducción del 44% en la incidencia del CG con la mayor ingesta de frutas y vegetales. Un metaanálisis de estudios de cohorte del World Cancer Research Fund mostró que el consumo de 100 g/día de vegetales sin almidón y frutas se correlacionó con un RR de 0,81.
Anemia perniciosa
Un metaanálisis reciente de 27 estudios de cohorte y de casos y controles encontró que la anemia perniciosa se acompaña de un RR de CG de 6,8. Aunque la heterogeneidad de los estudios no fue significativa (5 %), la calidad de los estudios fue variable; antes que promover la vigilancia de estos pacientes, se requieren estudios de mayor calidad para confirmar este aumento del riesgo.
Síndromes genéticos
El CG difuso hereditario es un síndrome causado por una mutación de la línea germinal del gen CDH1, que codifica la E-caderina, una proteína de adherencia celular calcio dependiente que interviene en la interacción intercelular y la polaridad de la célula. La condición se caracteriza por el inicio temprano (<40 años) del adenocarcinoma gástrico difuso, un patrón de herencia autosómica dominante, y un riesgo más elevado de cáncer de mama lobular y cáncer de colon de células en anillo de sello.
Un análisis prospectivo de una base de datos genética demostró que esta mutación conlleva un riesgo acumulado de CG del 67% en los hombres y del 83% en las mujeres. El síndrome de Lynch, un síndrome autosómico dominante que implica un desajuste defectuoso de la reparación del ADN y un mayor riesgo de cánceres viscerales, colorrectal y otros, también se asocia con una mayor incidencia de CG. Un estudio de cohorte prospectivo holandés de 2.014 personas comprobó un riesgo mayor de por vida de CG tanto en hombres (8%) como en mujeres (5,3%), que dio lugar a la vigilancia gastroscópìca de los pacientes con este síndrome que tienen una mutación MLH1 o MSH2.
¿Cómo se presentan los pacientes con cáncer gástrico?
Dado que los pacientes frecuentemente consultan por síntomas vagos e inespecíficos, el diagnóstico de CG es difícil. Los datos del US National Cancer Institute muestran que los pacientes típicos son varones fumadores 60-84 años, que sufren los síntomas cardinales de dolor abdominal superior y pérdida el peso. Los síntomas menos comunes son náusea, disfagia (en los tumores proximales y de la unión gastroesofágica) y melena. Las descripciones típicas de los libros de texto como el ganglio centinela de Virchow (en la fosa supraclavicular izquierda) y el nódulo de la Hermana María José (nódulo periumbilical) rara vez se ven en atención primaria.
Un metaanálisis de 15 estudios de 57.363 pacientes encontró que los signos de "alarma" tenían una sensibilidad combinada promedio del 67%, una especificidad agrupada de 66% y un cociente de probabilidad agrupado positivo de 2,74. El estudio del National Cancer Institute indica que a pesar de que estos síntomas tienen un valor predictivo limitado, en el Reino Unido y EE. UU. su identificación probablemente seguirá siendo parte de las estrategias para el manejo de la dispepsia, hasta contar enfoques mejores.
¿Quién debe ser derivado para proseguir las investigaciones?
La guía por consenso del Reino Unido de 2011 recomendó que los pacientes >55 años con dispepsia de reciente comienzo, y aquellos con síntomas de alarma deben someterse urgentemente (dentro de las 2 semanas) a una endoscopia gastrointestinal superior. Si se hallan signos macroscópicos de tumor (ulceración, tumores, o cambios en la mucosa), se debe hacer la derivación inmediata al especialista.
¿Cómo se diagnostica el cáncer de estómago?
Endoscopia y biopsia del tumor primario
Las guías de consenso británicas recomiendan que el diagnóstico se realice por la visualización de una tumoración en la endoscopia y la confirmación histológica, utilizando al menos 6 muestras de biopsia de dicha tumoración y del tejido adyacente. Si el resultado de la biopsia de una lesión sospechosa es negativo, es necesario repetir la biopsia. El examen anatomopatológico puede incluir estudios inmunohistoquímicos para el HER2/neu, el cual se expresa en exceso en un subconjunto de CG, porque para estos tumores el tratamiento específico puede ser una opción.
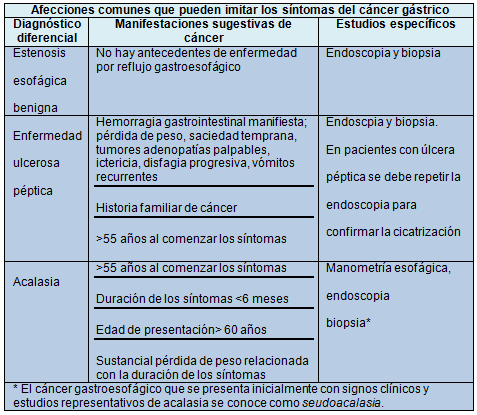
Estadificación del CG confirmado
Los avances recientes en los estudios por imagen han permitido una estadificación más precisa de los CG, y en la actualidad, el número de pacientes con enfermedad avanzada o incurable derivados para un tratamiento agresivo es menor. Un metaanálisis de 54 estudios de 5.601 pacientes halló que la ecografía endoscópica tuvo una sensibilidad y una especificidad del 86 y 91% para los tumores en estadio T y del 69% y 84% para los tumores en estadio N, respectivamente.
Sin embargo, debido a la limitada capacidad de esta técnica para estadificar la enfermedad de la mucosa, las normas actuales del Reino Unido recomiendan su uso solo para los tumores de la unión gastroesofágica y otros CG seleccionados. Un metaanálisis de 33 pacientes mostró que la tomografía computarizada (TC) del abdomen detecta metástasis hepáticas con una sensibilidad del 74% (59% a 85%) y una especificidad del 99% (97% al 100%) y las metástasis peritoneales con una sensibilidad del 33% (16% a 56%) y una especificidad del 99% (98% a 100%). La TC de tórax está indicada sólo en pacientes con tumores proximales o de la unión gastroesofágica; la tomografía por emisión de positrones combinada con la TC está cada vez más disponible en los centros de enseñanza superior. Un estudio de cohorte prospectivo reciente de 113 pacientes encontró que esta técnica detecta la enfermedad metastásica con una sensibilidad del 35% (19% a 55%) y una especificidad del 99% (93% a 100%). Cuando los estudios por imagen son negativos, debe hacerse la estadificación laparoscópica, con el fin de detectar la enfermedad metastásica peritoneal y los tumores de pequeño diámetro (5 mm) que pueden pasar desapercibidos incluso con imágenes radiológicas de alta calidad. La laparoscopia también permite hacer la citología peritoneal y hacer biopsias de las lesiones sospechosas, por lo que debe ser considerada antes del instituir el tratamiento definitivo. La revisión retrospectiva de 511 pacientes encontró que la estadificación laparoscópica cambió efectivamente las decisiones terapéuticas en el 28,0% de los pacientes con CG después de la TC y de la ecografía endoscópica.
¿Cuál es el enfoque para la toma de decisión terapéutica?
La estadificación oncológica y la evaluación preoperatoria son vitales para los pacientes con CG invasivo. Los tumores que presentan invasión local (T4) y metástasis a distancia (M1), normalmente no son pasibles de tratamiento curativo. La aptitud del paciente se determina por su estado general, el edad biológica, y las comorbilidades. Se puede medir objetivamente la función pulmonar y la prueba de ejercicio cardiopulmonar. Las recomendaciones terapéuticas finales se hacen en una reunión del equipo multidisciplinario, con la participación de cirujanos experimentados, radiólogos, anatomopatólogos y oncólogos. La decisión final debe ser hecha junto con el paciente después de que el médico le explica cuidadosamente el tratamiento recomendado.
¿Cuáles son las opciones del tratamiento con intención curativa?
Resección quirúrgica
Las guías actuales del Reino Unido y estadounidenses recomiendan que todos los médicos y los pacientes aptos con enfermedad limitada regionalmente decidan la resección quirúrgica para los tumores hasta el estadio IA y la cirugía después de la terapia neoadyuvante para los tumores en estadios II-III. El grado de resección quirúrgica suele depender de la localización del tumor. Aunque la gastrectomía total se realiza rutinariamente en los tumores proximales, ensayos controlados aleatorizados multicéntricos han demostrado tasas de supervivencia similares a las obtenidas después de la gastrectomía subtotal para los tumores distales. La extensión de la disección ganglionar es un factor clave durante la cirugía. . Ensayos controlados aleatorizados recientes han defendido la linfadenectomía D2 (ganglios perigástricos y a lo largo del tronco celíaco), más que la disección D1 (solo los ganglios perigástricos), porque los resultados de la disección D2 consiguen tasas más bajas de recidiva locorregional y de muerte relacionada con el cáncer, a pesar del aumento de las tasas de morbilidad temprana y de mortalidad. Los centros con mayor volumen de casos actualmente realizan modificaciones de la resección D2 (preservación del bazo).
Ensayos aleatorizados de la gastrectomía mínimamente invasiva versus la cirugía a cielo abierto muestran que los resultados a largo plazo son similares, aunque los procedimientos laparoscópicos ofrecen un mejor control del dolor y se asocian con una reducción de la pérdida de sangre y de complicaciones postoperatorias. Un estudio prospectivo de 827 pacientes halló que la gastrectomía robótica brindó mejores resultados acorto plazo y resultados oncológicos comparables a los de la gastrectomía laparoscópica.
El CG precoz (T1a) se puede tratar mediante la resección mucosa endoscópica, si el cáncer que está confinado a la mucosa es <2 cm de diámetro, tiene una diferenciación baja a moderada y no presenta ulceración o compromiso linfovascular.
Tratamiento neoadyuvante y adyuvante
Para tratar las micrometástasis y mejorar los resultados se administra el tratamiento sistémico antes de la cirugía definitiva (neoadyuvante) o después de la resección (adyuvante). El importante estudio aleatorizado Medical Research Council Adyuvant Gastric Infusional Chemotherapy (MAGIC) dividió aleatoriamente a 503 pacientes con cáncer de la unión gastroesofágica o del cuerpo gástrico para ser sometidos a cirugía sola o a 3 ciclos de quimioterapia preoperatoria (epirubicina, cisplatino, 5-fluorouracilo), seguidos cuando fue posible de 3 ciclos después de la cirugía. La quimioterapia dio como resultado una supervivencia a los 5 años significativamente mayor que la cirugía sola (6% vs. 23%), lo que indica un beneficio significativo para los pacientes con enfermedad en estadio 2 o superior, aunque la necesidad de 6 ciclos no fue resolutiva. En el Reino Unido, esto se ha convertido en el estándar terapéutico para el CG resecable. Un ensayo aleatorizado multicéntrico posterior de pacientes con enfermedad avanzada que comprobó que el oxaliplatino puede sustituir al cisplatino y que la administración oral de fluoropirimidina capecitabina puede sustituir a la inconveniente infusión de 5-fluorouracilo, ha motivado la difusión del uso de estos agentes neoadyuvantes.
La quimiorradioterapia adyuvante también mostró un beneficio en un ensayo aleatorizado de 556 pacientes con adenocarcinoma de la unión gastroesofágica resecado, que fueron asignados al azar a la cirugía más quimiorradioterapia posoperatoria (fluorouracilo/folinato cálcico durante 5 días y luego la radiación de 4.500 cGy, a razón de 180 cGy/día, 5 días por semana, durante 5 semanas) o cirugía sola. Un mes después de finalizada la radioterapia, se administraron ciclos de 2 a 5 días de fluorouracilo más folinato cálcico.
La mediana de la supervivencia del grupo de quimiorradioterapia adyuvante fue 36 meses en comparación con 27 meses del grupo de cirugía sola. El ensayo fue criticado por la mala supervivencia en la rama de cirugía sola, en la cual solo el 10% de los pacientes fue sometido a una resección D2 y más del 50 % a la resección D0. Por otra parte, la toxicidad fue elevada, y este régimen, aunque se utiliza en EE. UU., no ha sido ampliamente adoptado en el Reino Unido.
Un metaanálisis de ensayos de quimioterapia adyuvante muestra que este tratamiento es beneficioso aunque la magnitud del efecto es pequeña y no está claro cuáles son los mejores agentes a utilizar. La quimioterapia adyuvante se asoció con un beneficio significativo en la supervivencia global (cociente de riesgo 0,82) y la supervivencia libre de enfermedad (0,82), con un aumento de la supervivencia global a los 5 años de 49,6% a 55,3 % con la quimioterapia.
Los pacientes que sometidos a quimioterapia por CG presentan fatiga, náuseas, vómitos, alopecia, neuropatía y otros efectos secundarios específicos de los agentes utilizados. La sepsis neutropénica es potencialmente mortal y puede presentarse solo con fiebre. Su reconocimiento y manejo son cruciales en el contexto de la atención primaria.
|
Alarma sugestivos de cáncer gástrico - Dispepsia de reciente comienzo (en >55 años) |
¿Dónde debe hacerse la cirugía para el cáncer gástrico?
En los últimos años, los servicios de oncología se han centralizado en unidades a alto volumen, y los estudios han mostrado mejores resultados hospitalarios cuando los centros y los cirujanos tienen experiencia en cirugía mayor del cáncer. Los datos prospectivos del programa para mejorar la calidad quirúrgica a nivel nacional del American College of Surgeons atribuyeron las tasas más bajas de mortalidad al mejor manejo que se hace de las complicaciones postoperatorias en los centros de alto volumen.
Grandes estudios prospectivos muestran que si bien la mortalidad postoperatoria y la supervivencia a medio plazo son mejores en los centros de alto volumen, la supervivencia y la recurrencia a largo plazo pueden ser independientes del volumen hospitalario.
¿En qué consiste la atención paliativa y cuáles son las consideraciones a tener en cuenta?
Casi la mitad de los pacientes con CG se presenta con un grado de enfermedad incurable y requiere tratamiento paliativo. La aplicación de los mejores cuidados paliativos tiene como objetivo evitar o aliviar los síntomas (sangrado, obstrucción, dolor, náuseas y vómitos) y mejorar la calidad de vida de los pacientes y sus cuidadores. Esto debería ser un enfoque esencial del equipo multidisciplinario, teniendo en cuenta el estado funcional y la preferencia del paciente, con la participación directa del equipo de cuidados paliativos y de enfermería clínica especializada.
Tratamiento de la enfermedad avanzada
Quimioterapia y la quimiorradioterapia
Ensayos aleatorizados han demostrado que en el CG metastásico la quimioterapia mejora más la calidad de vida que la aplicación sola de la mejor atención de apoyo. En el Reino Unido, la epirubicina, el cisplatino y el régimen de 5-fluorouracilo o variantes, incluyendo el oxaliplatino y la capecitabina, son los más ampliamente utilizados. En el estudio REAL 2, que comparó regímenes similares, la supervivencia media fue 9,03 a 11,02 meses.
Un ensayo aleatorizado coreano de pacientes después de la quimioterapia inicial mostró un pequeño beneficio en la supervivencia con el tratamiento de segunda línea con taxanos o irinotecán—5,3 meses para 33 pacientes en la rama de quimioterapia y 3,8 meses para 69 pacientes en la rama de atención de apoyo. Las decisiones terapéuticas deben estar basadas en la preferencia del paciente, su estado general y los efectos secundarios potenciales
.
Una quinta parte de los pacientes con CG tiene tumores con amplificación del HER2 (erbB2). El estudio aleatorizado ToGA (Trastuzumab with Chemoterapy in HER2 Positive Advanced Gastric Cancer) de 594 pacientes mostró que el tratamiento dirigido con trastuzumab y quimioterapia (cisplatino con capecitabina o 5-fluorouracilo) fue superior a la quimioterapia sola, con una supervivencia media de 13,8 versus 11,1 meses, respectivamente. Para los pacientes con tumores que tienen una expresión elevada de HER2, la supervivencia general media para los pacientes tratados con trastuzumab más quimioterapia fue de 16,0 meses versus 11,8 meses para los que recibieron quimioterapia sola. El estudio ToGA estableció este tratamiento estándar para los pacientes con CG avanzado y presencia de HER2.
Cirugía paliativa
La gastrectomía paliativa puede beneficiar a los pacientes con obstrucción de la salida gástrica secundaria a tumores del antro, o con disfagia total causada por tumores del cardias. La decisión de tratar paliativamente a los pacientes no debe limitar el alcance de la cirugía; un gran estudio retrospectivo ha demostrado que los procedimientos más radicales pueden mejorar la supervivencia y la calidad de vida de pacientes elegibles. Para los pacientes que no están en condiciones de someterse a un procedimiento quirúrgico de primera línea se puede realizar una gastroyeyunostomía, la que a menudo puede realizarse por vía laparoscópica; la laparoscopia permite la colocación de stents.
¿Cómo debe hacerse el seguimiento de los pacientes después tratamiento?
Después de la cirugía y durante la quimioterapia se debe controlar la función de la médula ósea mediante análisis de sangre de rutina y hacer la vigilancia nutricional (por ej., el seguimiento de la vitamina B12 después de la gastrectomía proximal o total). A pesar de la falta de evidencia aleatorizada que evalúe las estrategias de seguimiento, la mayoría de los centros especializados del Reino Unido revisan a los pacientes cada 4 meses durante 3 años, y anualmente a partir de entonces, mediante imágenes radiográficas y endoscopia. Los pacientes con enfermedad recurrente pueden beneficiarse de la cirugía, aunque la mayoría de ellos se somete a la quimioterapia de rescate, cuando lo permite su estado general.
¿Se puede prevenir el cáncer gástrico?
Prevención primaria
Un metaanálisis de 7 ensayos aleatorizados realizados en regiones con alto riesgo de CG (6 en Asia) mostró que la erradicación de H. pylori reduce el riesgo de CG del 1,7% al 1,1% ([RR: 0,65). Un análisis de intención de tratar de un ensayo aleatorizado chino reciente de 3.365 participantes halló que un curso de 2 semanas de omeprazol y amoxicilina reduce la incidencia de CG en un 39% dentro de los 15 años de la asignación al azar, con una reducción similar pero no significativa de la mortalidad por CG. La relación costo eficacia de la vacuna contra H. pylori como profilaxis a largo plazo contra el CG en EE.UU. ha sido extrapolada por estudios de simulación, pero no existe evidencia del beneficio de la erradicación del H. pylori en regiones de bajo riesgo.
Un metaanálisis de estudios de casos y controles (14.442 casos y 73.918 controles) encontró que las personas que alguna vez habían fumado tenían un 43% más de riesgo de desarrollar CG (relación de riesgo: 1,43) que los que nunca habían fumado, mientras que los fumadores actuales tenían un 57 % más de riesgo (1,57). Esto sugiere que los esfuerzos para prevenir el consumo de cigarrillos y la ayuda a las personas para dejar de fumar reduciría la incidencia de CG.
Prevención secundaria
Un estudio abierto multicéntrico controlado aleatorizado de 544 pacientes halló que la erradicación de H. pylori (con lansoprazol, amoxicilina y claritromicina) después de la resección endoscópica del CG precoz disminuyó el riesgo de desarrollar carcinoma gástrico metacrónico (índice de riesgo 0,339 ) a los 3 años de seguimiento. Para prevenir el desarrollo de carcinoma gástrico metacrónico se ha recomendado hacer la erradicación profiláctica de H. pylori después de la resección endoscópica del CG precoz.
¿Qué importancia tienen los estudios de detección?
El cribado del CG precoz requiere la presencia de un grupo fácilmente identificable con un riesgo absoluto elevado. Uno de esos grupos podría ser el de hombres fumadores de mediana edad con el antecedente de Infección por Helicobacter pylori u otra pre malignidad, como el esófago de Barrett. Sin embargo, el riesgo absoluto también tiene en cuenta la incidencia de cáncer. El gran número de personas potencialmente de alto riesgo y la baja incidencia del CG hacen imposible aplicar los programas de detección en todas las regiones, por lo que se aplican en las que tienen una incidencia de CG elevada (como Japón y Chile). En estas regiones se están evaluando técnicas de detección serológica como la detección de anticuerpos contra pepsinógenos, gastrina-17 y anti-H. pylori (o anti-Cag-A, o ambos), además de la fotofluorografía y la endoscopia.
Recientemente, un importante ensayo multicéntrico también ha evaluado el test del aliento basado en nanomateriales, y comprobó que esta prueba tiene una sensibilidad del 89% y una especificidad del 90% para distinguir el CG de la enfermedad gástrica benigna.
¿Está mejorando el pronóstico de los pacientes con cáncer gástrico?
Un estudio coreano de un solo centro realizado en 12.026 pacientes con CG encontró que la tasa de supervivencia global a los 5 años aumentó del 64,0% al 73,2% entre 1986 y 2006. Un gran estudio europeo de 10 registros de cáncer de 7 países mostró mejoras similares, pero también detectó una variación notable en las tasas de supervivencia (28,0 a 44,3%) entre ciertos países, que no podría ser explicada solo por la mortalidad operatoria. Tales mejoras en el pronóstico se atribuyen a un mayor acceso a la atención; al perfeccionamiento de las técnicas de diagnóstico para la detección precoz; las estrategias quirúrgicas más racionales; las tasas de complicación más bajas; los avances en la anestesia, los cuidados perioperatorios y nutricionales, y el mayor uso de la quimioterapia sistémica. Estos factores también pueden explicar en parte las discrepancias en las tasas de supervivencia postoperatoria en todo el mundo, si bien se carece de datos cuantitativos.
¿Qué estrategias de tratamiento se esperan en el futuro?
Para el tratamiento del CG se están investigando nuevos agentes biológicos dirigidos. Un ensayo aleatorizado está estudiando el papel de los agentes antiangiogénicos como el bevacizumab (un anticuerpo monoclonal dirigido contra el factor de crecimiento del endotelio vascular) combinado con quimioterapia. Hasta el momento, las moléculas pequeñas o los anticuerpos dirigidos no han mostrado beneficios en el manejo del CG, pero, sin duda, la mayor comprensión de la base molecular subyacente dará lugar a otras estrategias para futuros tratamientos.
|
Consejos para no especialistas • Los síntomas cardinales del CG son: dolor en el abdomen superior, pérdida de peso, disfagia. |
♦ Traducción y resumen objetivo: Dra. Marta Papponetti
