 Se estima que en Estados Unidos el 5,6% de los adultos sufre esófago de Barrett (EB), una afección en la que la mucosa escamosa del esófago es sustituida por epitelio columnar metaplásico, el cual predispone al cáncer del esófago que ha sido dañado a causa de la enfermedad por reflujo gastroesofágico (ERGE). La ERGE y el EB son los principales factores de riesgo de adenocarcinoma de esófago, un tumor mortal cuya frecuencia en los Estados Unidos ha aumentado más de 7 veces durante las últimos 4 décadas. La mucosa columnar metaplásica del EB no ocasiona síntomas, y la enfermedad tiene importancia clínica solo porque confiere predisposición al cáncer.
Se estima que en Estados Unidos el 5,6% de los adultos sufre esófago de Barrett (EB), una afección en la que la mucosa escamosa del esófago es sustituida por epitelio columnar metaplásico, el cual predispone al cáncer del esófago que ha sido dañado a causa de la enfermedad por reflujo gastroesofágico (ERGE). La ERGE y el EB son los principales factores de riesgo de adenocarcinoma de esófago, un tumor mortal cuya frecuencia en los Estados Unidos ha aumentado más de 7 veces durante las últimos 4 décadas. La mucosa columnar metaplásica del EB no ocasiona síntomas, y la enfermedad tiene importancia clínica solo porque confiere predisposición al cáncer.
Patogénesis
La metaplasia, el proceso en el que un tipo de célula adulta sustituye a otro, es una consecuencia de una lesión tisular crónica. En los pacientes con lesión esofágica crónica por ERGE, la metaplasia de Barrett se desarrolla cuando las células columnares secretoras de moco reemplazan a las células escamosas dañadas por el reflujo. Se desconocen cuáles son las células que dan lugar a esta metaplasia.
Se ha propuesto que la ERGE puede inducir alteraciones en la expresión de factores de transcripción claves en el desarrollo, dando lugar a células escamosas esofágicas maduras que se conviertan en células columnares (transdiferenciación) o dan lugar a células progenitoras esofágicas inmaduras que se someten a la diferenciación columnar en vez de a la diferenciación escamosa (transcompromiso).
En un modelo de rata con esofagitis por reflujo, la metaplasia se desarrolló a partir de células madre de la médula ósea que entran en la sangre y se depositan en las células esofágicas dañadas por el reflujo. Estudios en modelos de ratón han sugerido que la metaplasia podría derivar de la migración ascendente de células madre del estómago proximal (cardias gástrico) o de la expansión proximal de las células de tipo embrionario de la unión gastroesofágica. No está claro cuál de estos procesos contribuye a la patogénesis del EB en los seres humanos.
Diagnóstico
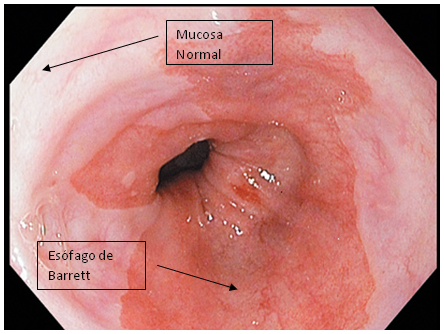
El diagnóstico de EB requiere la visualización endsocópica de mucosa columnar extendida más allá de la unión gastroesofágica y que recubre el esófago distal, además de los resultados de la biopsia esofágica que confirman la presencia de metaplasia columnar. En la endoscopia, la unión gastroesofágica se identifica como la parte más proximal de los pliegues gástricos, mientras que la mucosa columnar se caracteriza por ser gruesa y de color salmón, en contraste con la palidez y brillantez de la mucosa escamosa del esófago.
La medida de la metaplasia columnar del esófago determina el diagnóstico de EB de segmento corto o largo (≥3 cm o <3 cm de metaplasia columnar, respectivamente). Sin embargo, los especialistas no están de acuerdo sobre el tipo histológico de mucosa columnar que establece el diagnóstico de EB.
Para hacer el diagnóstico definitivo de EB, las sociedades gastroenterológicas estadounidenses requieren la presencia de metaplasia intestinal con células caliciformes en las muestras de biopsias esofágicas (también llamada metaplasia intestinal especializada o epitelio columnar especializado).
Esta metaplasia intestinal es un factor de riesgo bien establecido de carcinoma. Sin embargo, para el diagnóstico de EB, otras sociedades como la British Society of Gastroenterology también requieren la presencia de mucosa gástrica en las biopsias esofágicas (comprendiendo células columnares secretoras de moco sin células caliciformes).
La mucosa del cardias, aunque clásicamente considerada el revestimiento normal del cardias gástrico, puede tener características histoquímicas intestinales y anormalidades del contenido de ADN, mientras que en algunos casos, no en todos, parece ser una metaplasia inducida por la ERGE. Sin embargo, no está claro si la mucosa del cardias representa un factor de riesgo importante de adenocarcinoma.
Por lo tanto, el principal desacuerdo en cuanto a los criterios histológicos para el diagnóstico de EB es si el cuadro debe definirse como una curiosidad histológica (metaplasia mucosa, independientemente de su importancia clínica) o como una enfermedad médica (metaplasia de la mucosa que predispone al cáncer). Las sociedades gastroenterología de EE. UU. han tomado este última posición.
Epidemiología
En cada paciente, la extensión de la metaplasia de Barrett varía con la gravedad de la ERGE subyacente. Los pacientes con EB de segmento largo no tratado tienen ERGE grave con esofagitis erosiva mientras que el EB de segmento corto no se asocia con síntomas de ERGE o signos endoscópicos de esofagitis por reflujo.
Se supone que el EB de segmento corto se desarrolla como consecuencia del reflujo ácido prolongado que afecta solamente la porción distal del esófago, un fenómeno que puede ser documentado en personas aparentemente sanas. El EB de segmento corto no era muy reconocido hasta 1994 y en general, los primeros estudios incluían exclusivamente a pacientes con EB de segmento largo.
Estudios más recientes han incorporado una fracción variable de pacientes con EB de segmento corto y largo, y su proporción puede influir notablemente en la frecuencia de los síntomas asociados de ERGE y de las complicaciones. En general, la afección se descubre durante la endoscopia realizada en pacientes de raza blanca, ≥50 años.
A menudo, esta endoscopia está indicada intencionalmente por la presencia de síntomas de ERGGE pero también la afección se detecta en forma incidental cuando la endoscopia se realiza por otra causa no relacionada con la ERGE. El EB es 2-3 veces más común en los hombres que en las mujeres; es infrecuente en personas de raza negra o asiáticas, y es raro en los niños. Entre los factores de riesgo importantes se hallan la obesidad (con distribución predominantemente intrabdominal y, el tabaquismo, existiendo una forma familiar de EB (7-10% de los casos).
La mayoría de las condiciones asociadas a la metaplasia del EB también se asocia a factores de riesgo de adenocarcinoma esofágico. Por el contrario, los factores que podrían brindar protección contra el EB son el uso de antiinflamatorios no esteroides, la infección gástrica con Helicobacter pylori y el consumo de una dieta con elevado contenido de frutas y vegetales.
Aun no se conoce cuál es el factor de riesgo responsable del notable aumento de la incidencia de adenocarcinoma de esófago en los países occidentales durante los últimos 40 años, un período en el que la frecuencia de la ERGE y el EB parecen haber aumentado solo un poco. Ha habido un marcado aumento de la obesidad central, lo cual podría contribuir a la carcinogénesis de Barrett a través de la predisposición a la ERGE y del aumento de la producción de hormonas promotoras de la proliferación celular, como la esliptina, y los factores de crecimiento símil insulina.
La infección por H. pylori, que puede proteger al esófago de la ERGE mediante la producción de gastritis con reducción de la producción de acido gástrico, ha disminuido la frecuencia en el mismo período, durante el cual el adenocarcinoma esofágico ha aumentado en todos los países del mundo. Otra hipótesis que relaciona el aumento de la incidencia del adenocarcinoma esofágico es la mayor ingesta de nitratos, los cuales están más difundidos por el uso de fertilizantes nitrogenados.
La incidencia anual de adenocarcinoma de esófago en los pacientes con EB no displásico ha variado de 0,1% a 2,9%, con un pico máximo en estudios que tienen sesgos de publicación. Un estudio reciente de mejor calidad mostró que el riesgo de adenocarcinoma de esófago en la población general es de pacientes con EB no displásico de solo 0,1% a 0,3% por año.
Sin embargo, existen varios factores que influyen en el riesgo individual de cáncer. Por ejemplo, el riesgo de cáncer en los pacientes con EB es casi el doble en las mujeres y es mayor cuando el segmento de metaplasia de Barrett es más largo; es especialmente elevado en las personas con ciertas formas familiares de EB. Por otra parte, el riesgo parece disminuir cuando en el seguimiento endoscópico no aparecen signos de progresión hacia la displasia.
Detección y vigilancia del esófago de Barrett
Durante décadas, la principal estrategia para la prevención de muertes por adenocarcinoma de esófago ha sido el cribado de los pacientes con síntomas de ERGE por EB, mediante la detección endoscópica del progreso hacia la neoplasia curable. Lamentablemente, no hay ninguna prueba de que esta estrategia sea eficaz, y con una incidencia anual de cáncer de solo 0,1 a 0,3% la logística para realizar un ensayo aleatorizado para demostrar si la detección y vigilancia previenen las muertes por cáncer de esófago es desalentadora.
Estudios de observación demostraron que los pacientes con cánceres asociados al EB que fueron diagnosticados endoscópicamente durante el período de vigilancia tienen tumores en etapas más tempranas y mayor supervivencia que aquellos cuyos tumores se descubrieron por síntomas como la disfagia y la pérdida de peso.
Sin embargo, tales estudios son altamente susceptibles de sufrir sesgos que podrían exagerar los beneficios de la vigilancia. Algunos modelos de estudios computarizados han llegado a la conclusión que el cribado y la vigilancia pueden ser rentables en determinadas circunstancias, pero tales estudios no son definitivos.
A pesar de la falta de evidencia de alta calidad para apoyar la práctica, actualmente las sociedades médicas recomiendan el cribado endoscópico del EB en los pacientes con síntomas de ERGE crónica que tienen al menos un factor de riesgo adicional para el adenocarcinoma de esófago, como la edad ≥50 años, el sexo masculino, la raza blanca, la hernia del hiato, un índice de masa corporal elevado, distribución intraabdominal de la grasa corporal o. tabaquismo.
Si el examen preliminar no identifica al EB, no se recomienda continuar con el cribado endoscópico. Para los pacientes en los que se identifica EB no displásico, ya sea por selección o por casualidad, las sociedades médicas recomiendan la vigilancia endoscópica e a intervalos de 3 a 5 años. No obstante, existen razones para cuestionar el valor del cribado y la vigilancia del EB.
El requisito previo para hacer el cribado de la existencia de síntomas de ERGE limita la utilidad de la práctica porque los pacientes con EB de segmento corto no suelen tener síntomas de ERGE, mientras que aproximadamente el 40% de los pacientes con adenocarcinoma de esófago no tiene antecedentes de ERGE.
Los estudios han mostrado que menos del 10% de los pacientes con adenocarcinoma de esófago han recibió previamente el diagnóstico de EB, lo que indica que esas prácticas de cribado recurrente son altamente ineficaces. Por otra parte, un estudio de casos y controles reciente ha puesto en duda la eficacia de de la vigilancia en la prevención del cáncer en los pacientes con EB.
Ese estudio comparó la frecuencia de la vigilancia endoscópica durante un período de 3 años en 38 casos (pacientes con diagnóstico de EB que fallecieron por adenocarcinoma esofágico) con la utilizada en 101 pacientes vivos, pacientes control con EB, comparables por edad, sexo y duración del seguimiento. Los pacientes de ambos grupos fueron vigilados endoscópicamente con una frecuencia similar (55% y 60%, respectivamente).
La vigilancia no se asoció con menor riesgo de muerte por adenocarcinoma de esófago (riesgo relativo ajustado 0,99; 0,36 a 2,75). Sin embargo, este intervalo de confianza relativamente amplio no excluye la posibilidad de que la vigilancia sea beneficiosa. Una razón importante para el cribado ha sido poder identificar a los pacientes con EB que luego pueden beneficiarse de la vigilancia.
Si, como lo indica el informe antes mencionado, la vigilancia tiene un beneficio limitado, entonces la práctica del cribado podría basarse en una premisa básicamente defectuosa. Lo cierto es que se necesitan mejores métodos para estratificar el riesgo e identificar a aquellos pacientes con EB que podrían beneficiarse de la vigilancia o de las intervenciones.
Con este propósito se han investigado nuevas técnicas de cribado por imágenes endoscópicas, como la cromoendoscopia con tinción, la cromoendoscopia óptica y digital, la autofluorescencia endoscópica y la endomicroscopia con laser confocal. En las muestras de biopsia de pacientes con metaplasia de Barrett, las anormalidades en la presión del p53 y del contenido de ADN celular en la citometría de flujo han sido asociadas la progresión neoplásica.
Las anormalidades citogenéticas detectadas por medio de la hibridación in situ por fluorescencia y los paneles de biomarcadores que identifican a múltiples anormalidades en el contenido de ADN, la expresión genética y la metilación del ADN prometen ser buenos predictores del riesgo de cáncer, como algunos modelos de estratificación de riesgo que incorporan una variedad de cuadros clínicos, histológicos y moleculares. Sin embargo, esos métodos no han sido validados suficientemente como para justificar su aplicación en la práctica clínica.
Existen consecuencias adversas del cribado endoscópico y la vigilancia, además del costo elevado de la endoscopia y del poco riesgo de complicaciones endoscópicas. La identificación de lesiones neoplásicas mucosas por medio de estos procedimientos podría conducir al uso de terapias invasivas, con complicaciones graves o aun fatales.
Algunos estudios han mostrado que el diagnóstico de EB causa estrés psicológico y tiene un efecto negativo sobre la calidad de vida, con mayores primas en los seguros de salud y de vida. Hasta el momento, las sociedades médicas recomiendan que en ausencia de datos definitivos, mejor es equivocarse por realizar un cribado y vigilancia innecesarios que perder la oportunidad de identificar un cáncer esofágico curable.
No está claro si los nuevos datos discutidos más arriba tendrán influencia en las futuras recomendaciones. A pesar de las numerosas limitaciones y dudosos beneficios del cribado y la vigilancia del EB, esas prácticas siguen siendo recomendadas por las sociedades médicas. En general, las recomendaciones para la vigilancia del EB ya establecido son más firmes y explícitas que para el cribado inicial.
Manejo del esófago de Barrett
Tratamiento de la ERGE
En los pacientes con metaplasia de Barrett, el reflujo de ácido gástrico ocasiona inflamación crónica, ruptura de la doble cadena de ADN y aumento de la proliferación celular, todo lo cual puede favorecer la carcinogénesis. Esto indica que la ERGE debe ser tratada agresivamente en los pacientes con EB; hay evidencia indirecta de que los inhibidores de la bomba de protones (IBP) disminuyen el riesgo de desarrollar cáncer. Por ejemplo, un estudio de cohorte de 540 pacientes con EB seguidos durante una media de 5,2 años mostró que los IBP se asociaron con un 75% de reducción del riesgo de progresión neoplásica.
Los ácidos biliares también pueden causar rupturas en la doble cadena del ADN y podrían favorecer la carcinogénesis en los pacientes con metaplasia de Barrett; por otra parte, los IBP no evitan el reflujo biliar. La cirugía antirreflujo puede prevenir el reflujo de todo el contenido gástrico (ácido y bilis) pero los mejores datos disponibles indican que la cirugía no es más efectiva que el tratamiento con IBP para prevenir el cáncer de esófago.
Por lo tanto, no se conseja la cirugía antirreflujo con la única indicación de proteger contra el cáncer. Así como en los pacientes con ERGE sin metaplasia de Barrett, los IBP también se usan en los pacientes con EB para controlar los síntomas de la ERGE y curar la esofagitis por reflujo. Para los pacientes sin síntomas o signos endoscópicos de ERGE, como es común en los pacientes con EB de segmento corto, el tema es si el uso de los IBP para la quimioprevención sigue sin resolverse y es controvertido.
Los autores consideran que las pruebas indirectas que avalan el valor protector de los IBP contra el cáncer en los pacientes con EB son lo suficientemente importantes como para utilizar las dosis convencionales de IBP para el tratamiento de los pacientes asintomáticos, luego de haber sido informados de sus riesgos y beneficios potenciales, aunque este enfoque no es específicamente aceptado por las sociedades médicas.
Erradicación endoscópica de la displasia
EN los pacientes con metaplasia de Barrett, los cánceres evolucionan a través de alteraciones genéticas y epignéticas que activan la oncogénesis, silencian los genes supresores de tumores y liberan a las células de sus controles de crecimiento normal. Antes de que las células se tornen malignas, estas anormalidades del ADN pueden causar alteraciones histológicas esofágicas que los anatomopatólogos reconocen como displasia.
La displasia es un biomarcador imperfecto de potencial maligno debido a que puede presentarse en parches y ser fácilmente salteada durante la toma de la muestra de biopsia del EB mientras que la gravedad de la displasia está graduada mediante el uso de criterios subjetivos, dando como resultado frecuentes desacuerdos entre los anatomopatólogos actuantes. A pesar de las deficiencias, la displasia sigue siendo la base de la toma de decisiones clínicas en los casos de EB.
Las sociedades médicas recomiendan que antes de iniciar tratamientos invasivos, el diagnóstico de displasia sea confirmado por un segundo anatomopatólogo especializado. La rapidez a la que progreso la displasia hacia el cáncer en los pacientes con EB es suficiente para justificar la prevención. Un metaanálisis ha estimado que la velocidad de progresión es de aproximadamente 66% por año, pero es considerablemente superior en los ensayos terapéuticos.
Hasta hace poco tiempo, el tratamiento estándar de la displasia de alto grado era la esofagectomía, pero ahora se dispone de técnicas endoscópicas y de ablación que permiten su erradicación. El riesgo de complicaciones es mucho menor que con la esofagectomía y el riesgo de muerte es prácticamente nulo.
Para la resección de la mucosa se utiliza el asa diatérmica, la que permite resecar un segmento de la mucosa esofágica y de la submucosa subyacente, las cuales luego pueden ser evaluadas histológicamente. Este procedimiento se puede utilizarse para tratar la mucosa neoplásica, siendo el medio más seguro disponible para delimitar la profundidad de la invasión (estadificación T) de la neoplasia inicial en pacientes con EB.
Por el contrario, en los pacientes tratados con técnicas de ablación endoscópicas, las que se usan con energía térmica o fotoquímica para destruir la mucosa esofágica, no permiten obtener muestras de tejido. Luego de la resección o de la ablación endoscópica de la metaplasia de Barrett, los pacientes son tratados con IBP para prevenir el reflujo ácido, lo cual permite la reepitelización con epitelio escamoso del área erradicada.
Las investigaciones indican que en los pacientes con displasia tratados endoscópicamente, la frecuencia de la neoplasia metacromus es menor en todas las metaplasias erradicadas y no solo en las áreas displásicas. Por lo tanto, el objetivo del tratamiento endoscópico actual es erradicar completamente la metaplasia del EB tanto displásico como no displásico. El término “terapia de erradicación endsocópica” se refiere al uso de la resección endoscópica, la ablación o ambas, para alcanzar dicho objetivo.
A diferencia de la esofagectomía, la terapia de erradicación endoscópica no tiene la posibilidad de curar las neoplasias que han hecho metástasis en los ganglios linfáticos regionales. Estas metástasis están presentes en menos del 2% de los pacientes con EB que tienen una neoplasia en la mucosa (displasia de alto grado o adenocarcinoma intramucoso) pero se hallan en más del 20% de aquellos con tumores que se extienden en la profundidad, dentro de la submucosa. En consecuencia, generalmente la terapia endoscópica se usa solo para tratar las neoplasias mucosas.
Ensayos aleatorizados y controlados han mostrado que la erradicación endoscópica de la displasia en pacientes con EB, utilizando la terapia fotodinámica o la ablación por radiofrecuencia (mediante la cual la energía de la radiofrecuencia destruye la mucosa) reduce significativamente la velocidad de la progresión al cáncer. Aunque estas técnicas no han sido comparadas en forma directa en un estudio prospectivo, la ablación por radiofrecuencia parece lograr tasas similares, si no superiores, de erradicación de la displasia y de prevención del cáncer, siendo más fácil de aplicar y con menores efectos colaterales que la terapia fotodinámica.
Por lo tanto, la ablación por radiofrecuencia es el procedimiento de elección para la displasia en los pacientes con EB. Para lograr la erradicación completa de la neoplasia, la ablación por radiofrecuencia generalmente requiere varias sesiones endoscópicas, siendo la estrechez esofágica el efecto colateral más común, la cual ocurre en casi el el 5% de los pacientes sometidos al procedimiento.
Manejo de la displasia de grado bajo
Las investigaciones sobre la historia natural de la displasia de grado bajo en los pacientes con EB han llegado a resultados diferentes, probablemente debido a dificultades para establecer comparaciones entre diagnósticos erróneos utilizados en los estudios.
Por ejemplo, en un estudio de 147 pacientes con displasia de grado bajo diagnosticados en hospitales de la comunidad, los anatomopatólogos que revisaron las biopsias solo confirmaron el diagnóstico en el 15% de los casos. A los 109 meses, los pacientes con la enfermedad confirmada mostraron un riesgo cumulativo de progresión neoplásica del 85%.
Por el contrario, en un estudio de 210 pacientes con displasia de grado bajo que fueron seguidos durante una media de 6,2 años, la tasa anual de progresión neoplásica fue de solo 1,8%. Recientemente, un ensayo aleatorizado de ablación por radiofrecuencia versus vigilancia endoscópica, con 136 pacientes con displasia de grado bajo confirmada que fueron seguidos durante 3 años, mostró que la ablación por radiofrecuencia redujo en 25 puntos el porcentaje (1,5% con la ablación por radiofrecuencia versus 26,5% con la vigilancia).
Sin embargo, en el grupo de vigilancia, durante el seguimiento en el 28% de los pacientes no se detectó displasia no se desarrollaron tumores irresecables en ninguno de los pacientes ni se produjeron muertes relacionadas con el cáncer. Por consiguiente, no está claro si la ablación por radiofrecuencia es el mejor método para tratar la displasia de grado bajo, aunque es la que recomienda los autores del presente estudio. Actualmente, para los pacientes con displasia de grado bajo confirmada, las sociedades de gastroenterología recomiendan la vigilancia endoscópica a intervalos de a 6 a 12 meses o la terapia por ablación endoscópica.
Ablación por radiofrecuencia de la metaplasia de Barrett no displásica
Algunos médicos proponen ofrecer la ablación por radiofrecuencia a todos los pacientes con EB displásico o no displásico, argumentando que la vigilancia endoscópica no es una estrategia eficaz para prevenir el cáncer y que la ablación por radiofrecuencia es segura y efectiva para erradicar la metaplasia de Barrett. Sin embargo, la eficacia de la ablación por radiofrecuencia para prevenir el cáncer en los pacientes con EB no displásico no ha sido establecida en estudios a largo plazo, y hay al menos dos razones por las que el riesgo de cáncer no puede ser eliminado, aun cuando la ablación por radiofrecuencia erradica todos los signos visibles de metaplasia de Barrett. Primero, a menudo, las glándulas metaplásicas del EB en la lámina propia que subyace al epitelio escamoso suelen estar a 1 cm de la unión con la metaplasia.
El epitelio escamoso suprayacente oculta su metaplasia intestinal subescamosa a la visión del endoscopista y puede motivar que en esa zona no se haga la ablación por radiofrecuencia. Se desconoce cuál es la rapidez con la cual la metaplasia intestinal subescamosa progresa a la malignidad pero en esas glándulas metaplásicas subescamosas se han hallado cánceres.
Otra razón para sospechar que la ablación por radiofrecuencia podría no eliminar el riesgo de cáncer es haber observado que con el tiempo, la metaplasia de Barrett puede sufrir una recurrencia. Los estudios previos muestran que la tasa de recurrencia luego de la ablación por radiofrecuencia era baja, pero estudios más recientes han mostrado que a los 2 años hay recurrencias de la metaplasia de Barrett, a veces con displasia y cáncer, hasta en un 33% de los pacientes.
Se desconoce cuál es el riesgo de cáncer a largo plazo asociado con la metaplasia de Barrett recurrente luego de la ablación por radiofrecuencia. Dado que la frecuencia e importancia de la metaplasia intestinal subescamosa recurrente no ha sido establecida, se desconoce cuál es la eficacia de la ablación por radiofrecuencia para prevenir el cáncer en los pacientes con EB no displásico.
Estas dudas indican que los pacientes deben continuar bajo vigilancia endoscópica aun después de la erradicación aparentemente exitosa de la metaplasia mediante la ablación por radiofrecuencia. Un estudio utilizó el análisis de decisión de Markov para explorar la relación costo efectividad de la ablación por radiofrecuencia en hombres de 50 años con EB y concluyó que es un procedimiento rentable para aquellos con displasia pero no para los pacientes con metaplasia no displásica. Actualmente no se recomienda la ablación por radiofrecuencia para la población general de pacientes con EB no displásico.
• Traducción y resumen objetivo: Dra. Marta Papponetti.