La diabetes es una causa importante de ceguera en la población adulta mundial y se espera que en los próximos años alcance proporciones epidémicas.
La microangiopatía de la retina de pacientes diabéticos a largo plazo produce isquemia retiniana e hipoxia. Los pacientes con retinopatía diabética muestran menor densidad en la red capilar perifoveal y aumento de la zona avascular foveal. En pacientes con diabetes prolongada, los múltiples focos de hipoxia del tejido intervienen en la patogénesis de la disfunción vascular y visual. Se ha comprobado que el aumento de la zona avascular foveal y del área intercapilar perifoveal indica isquemia y su consecuencia sobre la agudeza visual.
El tratamiento neuro protector tiene como objetivo evitar la pérdida neuronal, inhibiendo la apoptosis. Los agonistas Alfa-2 evitan la pérdida progresiva de células ganglionares retinianas, manteniendo y mejorando su capacidad de soportar el estrés.
La brimonidina reduce la presión intraocular, aumenta la perfusión ocular, mejora la microcirculación de la retina y por lo tanto la isquemia en el lecho capilar de la retina. La inhibición del aumento de factor de crecimiento endotelial vascular y del colapso de la barrera hemato-retiniana ha sido demostrada con brimonidina en ratas diabéticas. También regula el factor neurotrófico derivado del cerebro lo que evita la muerte de células ganglionares retinianas.
El presente estudio tuvo como objetivo investigar el rol de brimonidina tópica para detener la progresión de cambios isquémicos en la retinopatía diabética con edema macular.
Pacientes y métodos: Se realizó un estudio controlado, aleatorizado, prospectivo en el que participaron 30 pacientes diabéticos metabólicamente estables con edema macular significativo y con alteraciones isquémicas en angiografía fluoresceínica. El grupo I incluyó 17 pacientes que recibieron brimonidina 0,2% tópica, dos veces por día, durante seis meses y el grupo II incluyó 13 ojos que se mantuvieron en observación y actuaron como controles. Se registraron cambios en la agudeza visual, en la zona avascular foveal, la falta de perfusión capilar o dilatación capilar en ambos grupos y se realizó la comparación transcurridos los seis meses.
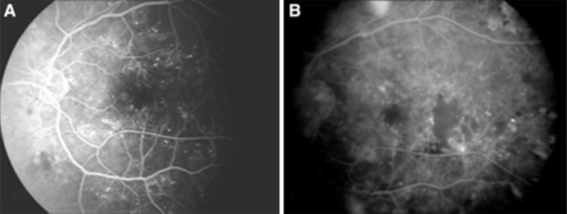
Fig. 1 a) La angiografía fluoresceínica de línea de base muestra microaneurismas, área sin perfusión capilar y aumento de la zona avascular foveal. b) A los seis meses la angiografía fluoresceínica muestra incremento de la falta de perfusión y filtración por neovascularización en paciente del grupo de control.
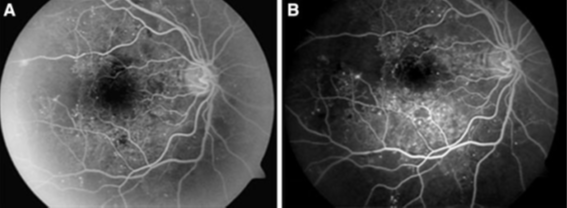
Fig. 2. a) Angiografía fluoresceínica en línea de base muestra aumento de la zona avascular foveal, microaneurismas y falta de perfusión capilar temporal. b) a los seis meses de seguimiento la angiografía muestra disminución de la zona avascular foveal, pero persiste la falta de perfusión capilar temporal en paciente del grupo I de estudio.
Se observó una diferencia significativa en la zona avascular foveal y su radio a los seis meses de seguimiento, al comparar ambos grupos. Aparentemente, el éxito de brimonidina como neuroprotector en modelos animales puede trasladarse a seres humanos.
En ambos grupos, la mejoría significativa de la agudeza visual a los seis meses se debe, probablemente, a la estabilidad metabólica de los pacientes diabéticos o, en algunos pacientes, al tratamiento láser realizado tres meses antes de la inclusión en el estudio.
Mondal et al demostraron en su estudio que no hubo nuevos microaneurismas en el 100% de los pacientes del grupo de estudio que recibió brimonidina tópica durante dos años, mientras que un promedio de cuatro nuevos microaneurismas se desarrollaron en los pacientes del grupo de control. Se observó además que la agudeza visual mejoró una línea en el 60% de los pacientes y se mantuvo sin cambios en el resto de los pacientes del grupo de estudio, mientras que se redujo una línea en el 80% del los pacientes del grupo de control que recibió placebo y dos líneas en el 20%, asimismo 20% desarrolló edema macular significativo. Estos resultados coinciden con los del presente estudio.
Oliver et al informaron aumento significativo de la zona avascular foveal y del área intercapilar perifoveal en pacientes diabéticos, comparados con controles sanos. También determinaron que dichos signos indican isquemia y pueden servir para identificar la presencia de maculopatía diabética isquémica. Aparentemente, brimonidina, que se ha informado logra llegar al segmento posterior ocular en concentraciones terapéuticas al administrarse de forma tópica, podría mejorar la microcirculación macular y aportar un efecto neuroprotector en pacientes con maculopatía diabética.
Aunque brimonidina tópica reduce el radio de la zona avascular foveal y su superficie, no se modifican otros parámetros de dicha zona. Sería necesario un seguimiento más prolongado para poder alcanzar otros cambios significativos de la zona avascular foveal.
Una de las limitaciones del estudio es que se incluyeron pacientes que recibieron tratamiento láser tres meses antes de ingresar en el estudio, dichos pacientes deberían haber sido excluidos.
No se observaron efectos adversos sistémicos importantes. Un paciente presentó ojo rojo y fue excluido del grupo de estudio a las dos semanas de ingresar.
Conclusiones:
Brimonidina 0,2% tópica podría servir para tratar la isquemia macular en pacientes con edema macular diabético ya que se redujo el superficie y el radio de la zona avascular foveal en el grupo tratado. Sin embargo, el tratamiento no afecto la progresión general de la isquemia macular y la agudeza visual luego de seis meses. Es necesario realizar una investigación con una muestra más numerosa y seguimiento más prolongado para confirmar los resultados de este estudio piloto.
Síntesis y traducción: Dr. Martín Mocorrea, editor responsable de Intramed en la especialidad de oftalmología.
Bibliografía:
1. Townsend C et al (1980) Xenon arc photocoagulation for the treatment of diabetic maculopathy. Br J Ophthalmol 64:385–391
2. Arend O et al (1995) The relationship of macular microcirculation to visual acuity in diabetic patients. Arch Ophthalmol 113:610–614
3. Mayes PA (2000) Glycolysis and oxidation of pyruvate. In:Robert K et al (eds) Harper’s biochemistry. Appleton Lange, Mcgraw-hill, Connecticut, pp 190-196
4. Conrath J et al (2003) Foveal avascular zone in diabetic retinopathy: quantitative vs qualitative assessment. Eye 19:322–326
5. Keuhn H et al (2005) Retinal ganglion cell death in glaucoma:mechanisms and neuroprotective strategies. Ophthalmol Clin North Am 18:42–48
6. Lafuente MP et al (2002) Neuroprotective effects of brimonidine against transient ischemia-induced retinal ganglion cell death: a dose response in vivo study. Exp Eye Res 74:181–189