Introducción
Con la proliferación de imágenes de corte transversal, se está descubriendo un número cada vez mayor de lesiones hepáticas quísticas. En efecto, se ha estimado que hasta un 20% de la población general tiene una lesión quística en el hígado [1-3]. Aunque la abrumadora mayoría de esas lesiones son quistes simples benignos, un pequeño subconjunto (3%-5%) de los quistes hepáticos puede representar a tumores quísticos biliares (TQB) [4]. Los TQB se originan en el epitelio biliar y pueden ser clasificados ya sea como cistoadenoma biliar (CAB) o cistoadenocarcinoma biliar (CACB).
El primer reporte de TQB fue hecho por Heuter en 1887, y la primera resección fue reportada 5 años después por Keen [5,6]. Seguidamente, en 1958, Edmonson [7] describió las características anatomopatológicas patognomónicas del TQB, como una lesión multilocular tapizada con epitelio columnar, acompañada por un estroma celular denso, de “tipo ovárico”. Más recientemente, el microscopio de luz y las características inmunohistoquímicas del TQB hepatobiliar han sido adicionalmente definidas y caracterizadas [8]. A pesar de ello, menos de 250 casos de TQB han sido reportados en la literatura mundial [4].
Aunque raro, el manejo del TQB es importante, porque se cree que esas lesiones son premalignas y pueden tener un riesgo de transformación maligna tan alto como de un 20% a 30% [8,9]. Por lo tanto, es crítico el diagnóstico de certeza de un TQB. Dos estudios previos han sugerido ciertos factores clínicos y características radiológicas que pueden ayudar a diferenciar un CAB de un CACB [9,10]. No obstante, es difícil obtener conclusiones clínicas significativas de esos 2 estudios, dado que esos reportes incluyen sólo 20 y 30 pacientes, respectivamente [9,10].
En general, varios investigadores han sugerido que lesiones anecoicas con tabicamiento interno, caracterizadas por engrosamiento septal, proyecciones papilares y nódulos murales, pueden ayudar para diferenciar un CAB de un CACB [11.15]. Sin embargo, las características clínicas y radiológicas diferentes del CAB versus el CACB nunca han sido investigadas rigurosamente. Además, el manejo óptimo de los pacientes con CAB y CACB sigue estando pobremente descrito.
Las diferentes opciones de manejo previamente reportadas para los TQB han incluido: aspiración percutánea, esclerosis, y procedimientos quirúrgicos, tales como destechamiento/fenestración o resección hepática parcial [2,16-18]. Dado el potencial maligno del TQB, el manejo terapéutico inapropiado de esas lesiones puede llevar a un aumento en la incidencia de la recidiva post procedimiento, así como a resultados adversos a largo plazo.
Desafortunadamente, virtualmente todos los reportes previos sobre el manejo del TQB, han sido reportes de casos de instituciones aisladas o series pequeñas con 30 o menos pacientes. Los datos actuales sobre el manejo quirúrgico y resultados en los pacientes con TQB son, en consecuencia, mayoritariamente anecdóticos, quedando un mínimo de datos para guiar la práctica clínica.
Dado el tamaño limitado de las muestras y la naturaleza de centro asistencial único, los autores de este trabajo buscaron utilizar datos de una base internacional multicéntrica, derivada de los 10 mayores centros hepatobiliares, para caracterizar mejor las propiedades, manejo y resultados de los pacientes con lesiones biliares quísticas del hígado. El propósito del presente estudio fue dilucidar la presentación clínica y el manejo quirúrgico de los pacientes con TQB.
Específicamente se buscó evaluar y validar las características clínicas y radiológicas previamente pretendidas para diferenciar el CAB del CACB [9,10]. Además, se buscó definir la sobrevida libre de enfermedad (SLE) y la sobrevida global (SG) de los pacientes con TQB, en relación con el tipo de procedimiento quirúrgico realizado (por ej., destechamieno/fenestración vs resección hepática), así como la histología subyacente (por ej., CAB vs CACB).
Métodos
Población de pacientes
Utilizando una base de datos internacional multicéntrica de los 10 mayores centros en Norteamérica, Europa y Australia [Johns Hopkins Hospital, Baltimore, MD (n = 38); Emory University, Atlanta, GA (n = 25); Medical College of Wisconsisn, WI (n = 12); University of Pittsburg Medical Center, Pittsburg, PA (n = 30); University of Virginia, Charlottesville, VA (n = 9); Mayo College of Medicine, Rochester, MN (n = 77); Ohio State University, OH (n = 14); Institute for Digestive Diseases and Liver Transplantation Fundeni, Bucarest, Rumania (n = 11); Royal Prince Alfred Hospital, Sidney, Australia (n = 28) y Hospital Curry Cabral, Lisboa, Portugal (n = 4)], se identificaron 248 pacientes que fueron tratados por CAB o CACB entre 1984 y 2013 (1983-1993: 30, 194-2003: 64, 2004-2013: 154). Cada paciente fue diagnosticado con CAB o CACB sobre la base del examen anatomopatológico en la respectiva institución. El comité de revisión institucional de cada centro participante aprobó el protocolo del estudio.
Recolección de datos
Las variables demográficas estándar incluyeron: edad, sexo, y raza, así como la recolección de comorbilidades basales, tales como enfermedad arterial coronaria, hipertensión, y diabetes mellitus, de las historias clínicas. Los datos sobre la enfermedad hepática subyacente, así como los síntomas de presentación y los valores de la función hepática, fueron registrados.
Los detalles de todos los estudios por imágenes preoperatorios, incluyendo ecografía, tomografía computada (TC) y resonancia magnética nuclear (RMN), fueron recolectados. Cada institución volvió a revisar las imágenes del caso, en busca de las características designadas en la base de datos. Además, los procedimientos preoperatorios, tales como biopsia, drenaje percutáneo del quiste, colangiopancreatografía endoscópica retrógrada (CPER) con o sin colocación de un stent endobiliar, y colangiografía percutánea transhepática, fueron revisados.
Los datos sobre el tratamiento quirúrgico fueron recolectados también, incluyendo el abordaje y la extensión de la resección quirúrgica, así como una estimación de la pérdida de sangre. Las resecciones fueron categorizadas como destechamiento/fenestración o resección hepática formal; la resección hepática fue categorizada como menos que una hemihepatectomía (2 segmentos o menos) versus hemi o hepatectomía extendida (al menos 3 segmentos). La linfadenectomía, (si era completa), fue documentada.
Se identificaron las condiciones anatómicas, incluyendo la localización, así como el tamaño del TQB dentro del hígado. Cuando fueron realizadas, los resultados de las biopsias intraoperatorias por congelación fueron revisados comparados con los reportes anatomopatológicos finales. El epitelio del TQB fue clasificado como mucinoso o seroso y se documentó la presencia de estroma de tipo ovárico, así como la presencia de atipia. La evaluación anatomopatológica del espécimen fue realizada en cada centro y no se efectuó una revisión anatomopatológica central.
Las complicaciones postoperatorias fueron evaluadas hasta los 30 días después de la operación y fueron graduadas de acuerdo con el sistema de clasificación de Clavien-Dindo; una complicación mayor fue definida como grado III o superior [19]. Se calculó la mortalidad perioperatoria sobre la base del número de pacientes que falleció dentro de los 90 días de la operación [20]. Se examinaron los resultados a largo plazo, incluyendo la incidencia de recidiva, tratamiento de la enfermedad recurrente y SG en el último control alejado.
Análisis estadístico
Las variables continuas fueron presentadas como media ± desvío estándar (DE) o con la mediana y el rango intercuartilar (RIC). Las variables categóricas fueron mostradas como números enteros y porcentajes. Las características basales de la población en estudio fueron resumidas de acuerdo con el tipo de tumor (esto es, CAB vs CACB). El análisis comparativo de las variables continuas se efectuó utilizando la prueba de Wilcoxon para datos paramétricos y no paramétricos y análisis de varianza de 1 vía, según lo apropiado. La prueba exacta de Fisher o la de 2 fueron usadas para comparar las variables categóricas. Se realizó la evaluación de ciertas variables utilizando curvas ROC (receiver operating characteristic), según los valores de corte previamente propuestos, sugeridos por Wang y col. [10].
La SLE y la SG fueron estimadas utilizando el método de Kaplan-Meier y las diferencias en la sobrevida fueron examinadas con la prueba de log-rank. Un modelo multivariado de regresión de riesgos proporcionales de Cox, fue usado para identificar los predictores del desarrollo de un CACB. El modelo más parsimonioso fue creado empleando un abordaje paso a paso, que incluyó factores estadísticamente significativos del análisis univariado (esto es, P < 0,20). Para los análisis estadísticos, los valores de P menores que 0,05 (2-colas) fueron considerados significativos. Las tasas de riesgo (TR) fueron presentadas con intervalos de confianza (IC) del 95%. Todos los análisis fueron llevados a cabo con el programa STATA, versión 12.0 (StataCorp LP, College Station, TX).
Resultados
Paciente, presentación y características de la enfermedad
La mediana de la edad al momento del diagnóstico fue de 54 años (rango, 14-83). Los pacientes fueron abrumadoramente femeninos (86,7%) y blancos (99,3%). La mayoría de ellos se presentó inicialmente con dolor abdominal (57,3%), mientras que otros pacientes se quejaron de plenitud abdominal (20,2%), saciedad precoz (12,5%) o pérdida de peso (3,6%). Interesantemente, el 13,7% de los pacientes fue completamente asintomático. Mientras que un pequeño subgrupo (11,3%) se presentó con ictericia.
No obstante, la mayoría de los pacientes presentó valores de laboratorio normales, incluyendo bilirrubina (mediana 0,6 mg/dL) y alanino aminotransferasa (mediana, 27 U/L), así como los niveles de los marcadores tumorales, incluyendo CA19-9 (mediana, 15 U/mL) y antígeno carcinoembrionario (CEA) (2,7 ng/mL). Las características clínicas preoperatorias de los pacientes con CAB versus CACB fueron comparables, excepto que los pacientes con CACB tuvieron una mayor probabilidad de ser hombres y mayores (P para ambos < 0,05).
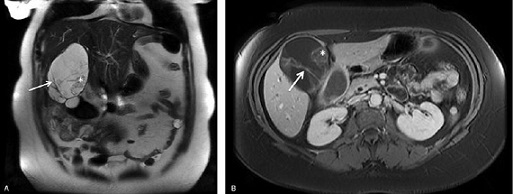
Aunque la mayoría de los pacientes fue sometida a ecografía (58,5%), se obtuvieron imágenes adicionales de corte transversal en la inmensa mayoría de ellos (87,9%; Fig. 1). En la mayoría de los casos, la imagen de corte transversal involucró sólo una TC (62,5%), mientras que unos pocos pacientes fueron sometidos sólo a una RMN (6,9%) o a TC + RMN (18,5%). No hubo diferencias en el tipo de imagen de corte transversal utilizado entre los pacientes con CAB versus CACB (P para todos > 0,05).
Los exámenes radiológicos preoperatorios encontraron que los TQB están localizados más a menudo en el hemi-hígado izquierdo (43,5%), comparado con el hígado derecho (30,6%) o central (20,2%) (P = 0,033). En la mayoría de los casos, la lesión fue única (73,4%); la mediana del tamaño fue 10 cm (RIC, 7-13 cm). La mayoría de los TQB fue multilocular (56,9%) y tuvo tabicamiento (65,7%), mientras que pocas lesiones tuvieron nodularidad mural (16,5%), dilatación ductal biliar (17,7%) o calcificación (10,1%).
• FIGURA 1: Ejemplo de RMN (A) coronal y (B) axial mostrando una gran masa quística lobulada con tabiques engrosados (flecha) y modularidad (asterisco), sospechosos de cistoadenoma/cistoadenocarcinoma biliar. El informe anatomopatológico final reveló un cistoadenoma biliar.
Las intervenciones preoperatorias incluyeron CPER (16,1%), aspiración del quiste (19,8%), esclerosis (2,0%) o biopsia con aguja fina (BAF) (20,6%). Entre todos los pacientes que fueron sometidos a BAF (n = 52), 5 que tuvieron un CACB en la anatomopatología final, tuvieron una BAF preoperatoria que fue leída como no diagnóstica, consistente con CAB, o “quiste benigno”. En contraste, la BAF sugirió adenocarcinoma en 6 pacientes de los cuáles 5 tuvieron posteriormente un CACB confirmado en la anatomopatología final. En consecuencia, la sensibilidad y especificidad de la BAF para detectar un CACB fue del 50% y 97,6%, respectivamente.
Tratamiento, resultados perioperatorios y hallazgos anatomopatológicos
La mayoría de los pacientes fue sometida a un procedimiento abierto (n = 191); 10 pacientes tuvieron un abordaje inicial mínimamente invasivo que fue convertido a laparotomía, mientras que 45 tuvieron un abordaje quirúrgico totalmente laparoscópico; todos los procedimientos laparoscópicos ocurrieron después del año 2000. Al momento de la cirugía, la intervención quirúrgica consistió en destechamiento/fenestración (14,1%), menos que una hemihepatectomía (44,8%) o una hemihepatectomía/hepatectomía extendida (36,3%).
Comparado con el CAB, los pacientes con un CACB tuvieron una probabilidad menor de ser sometidos a destechamiento/fenestración (15,4% vs 3,7%, respectivamente) y una mayor probabilidad de ser sometidos a una hepatectomía mayor (31,7% vs 74,1%, respectivamente; P < 0,001).
La linfadenectomía fue realizada en el 6,4% de los pacientes (CAB 2,7% vs CACB 37,0%). La mediana estimada de pérdida de sangre fue de 300 mL. No hubo muertes postoperatorias dentro de los 90 días de la cirugía. Un total de 62 pacientes (25,0%) experimentó una complicación postoperatoria.
La mayoría de las complicaciones fueron menores (51,6%), de grados I-II, mientras que el 45,2% de los pacientes tuvieron complicaciones más serias, de grados III-IV, que requirieron una intervención. Las complicaciones fueron más comunes siguiendo a una hepatectomía mayor (39,8%) versus destechamiento/fenestración o una resección menor (13,6%) (P < 0,05). La duración global de la estadía fue de 6 días (RIC, 4-7).
En la evaluación anatomopatológica final, la mayoría de las lesiones de CACB fueron señaladas como siendo un CAB (89,1%), mientras que 27 (10,9%) fueron CACB. Entre los pacientes con CAB, el 8,6% tuvo evidencia de atipia. Globalmente, casi un tercio de todos los especímenes de CAB tuvo evidencia de células en huso/estroma ovárico (33,3%), siendo esa característica anatomopatológica mucho más común entre las pacientes mujeres (P < 0,001).
Entre los 248 pacientes, el estado anatomopatológico de los márgenes, estuvo disponible en 209 pacientes (84,3%). Mientras que la mayoría de los pacientes (89,5%) tuvo un margen quirúrgico negativo (R0), un subgrupo fue señalado como teniendo enfermedad microscópica/macroscópica (R1/R2) (10,5%). Entre los pacientes que fueron sometidos a una resección formal (esto es, no un destechamiento/fenestración), el 94,6% tuvo un margen R0 y el 5,4% tuvo un margen R1/R2.
Diferenciación entre CAB y CACB
Entre los 248 pacientes con CAB, se evaluó la habilidad de las imágenes preoperatorias de corte transversal para predecir un CACB, en relación con un CAB. Específicamente, la presencia de características de “alto riesgo”, tales como multinodularidad, septos, nódulos murales, componente sólido, proyección papilar, calcificación, hipervascularidad, aumento de la pared quística después de la inyección de contraste y dilatación ductal biliar, fueron examinados.
Sobre la base de la presencia de cualquiera de esas características, la sensibilidad y la especificidad de las imágenes preoperatorias de corte transversal para predecir el CACB, fue del 81% y 21%, respectivamente. Además de las características radiológicas, ciertas características clínicas y tumorales, así como valores de laboratorio, que habían sido propuestos previamente como formas de diferenciar un CAB de un CACB, fueron examinados [9,10].
La edad y el sexo estuvieron asociados con un riesgo de CACB en relación con el CAB en los análisis univariados. Cuando se los evaluó usando ROC, la habilidad del tamaño del tumor para discriminar CAB de CACB fue pobre (área bajo la curva [ABC] 0,532). Otros factores tales como la edad (ABC 0,647), así como el CEA (ABC 0,690) y el CA19-9 (ABC 0,690), fueron sólo moderadamente buenos predictores de CACB. En contraste, la localización del tumor en el hemi-hígado derecho se asoció más fuertemente con el riesgo de CACB en relación con el CAB (TR 2,77; 95% IC: 0,16-0,83; P = 0,01).
Pronóstico: SLE y SG
Entre los 248 pacientes, hubo 46 (18,5%) recidivas. La mediana de la SLE fue de 12,1 años (95% IC: 6,5-18,1), mientras que la SLE a 1, 3, y 5 años fue del 89,1%, 72,6% y 61,4%, respectivamente. Se asoció una mayor probabilidad de recidiva con el tipo de procedimiento quirúrgico efectuado. Específicamente, la incidencia de recidiva fue del 48,6% entre los pacientes que fueron sometidos a destechamiento/fenestración, versus 15,7% y 19%, respectivamente, para los pacientes que tuvieron una hepatectomía parcial o mayor (P < 0,001). Entre los pacientes que fueron sometidos a destechamiento/fenestración, 16 de 35 (45,6%) con CAB y 1 paciente con CACB (100%), recidivaron.
La mayoría de los procedimientos de destechamiento/fenestración fue realizada laparoscópicamente, un abordaje mínimamente invasivo que también fue señalado como asociado con una proporción más alta de recidivas (laparoscopía 33,3% vs abierto 14,7%; P = 0,033). La incidencia de recidiva fue del 9,5% entre los pacientes con resección R0, versus 59,1% entre los pacientes con resección R1/R2. Entre el subgrupo de pacientes que tuvieron una resección laparoscópica R0, la recurrencia global fue del 20,7% (CAB: 14,8%; CACB: 100%). Para señalar: la incidencia global de recidiva fue generalmente más alta entre los pacientes con CACB (33,3%) versus CAB (16,7%) (P = 0,04), independientemente del procedimiento efectuado.
El otro factor asociado con el riesgo de recidiva fue la presencia de células en huso/estroma ovárico. En efecto, los pacientes con células en huso/estroma ovárico tuvieron una tasa de recidiva del 26,3% versus sólo el 10,7% para los pacientes que no tenían esa característica anatomopatológica (P = 0,003). Para señalar: 2 pacientes (0,9%), que tuvieron inicialmente un CAB, recidivaron con un CACB; esos 2 pacientes habían sido sometidos a una hepatectomía izquierda y un destechamiento/fenestración, respectivamente.
Examinando toda la cohorte, la mediana de la SG no fue alcanzada; la SG a 1, 3 y 5 años fue del 95,0%, 86,8% y 84,2%, respectivamente. La mediana de la SG para los pacientes con CAB no fue alcanzada, versus 8,4 años para los pacientes con CACB (TR 3,91; P = 0,01). Entre los pacientes con CACB, la presencia de células en huso/estroma ovárico se asoció también con la sobrevida (mediana de sobrevida: células en huso/estroma ovárico, 8,3 años vs ausencia de esas características, no alcanzada; P = 0,003). En los análisis univariados y multivariados, ningún otro factor se asoció con el pronóstico a largo plazo.
De los 46 pacientes que recidivaron, 33 (78,6%) fueron sometidos a una repetición de la hepatectomía. La repetición de la cirugía involucró resección hepática parcial (33,3%) o hemi-hepatectomía/resección extendida (66,7%). En el último seguimiento alejado, 26 de esos 46 pacientes (56,5%) estaban libres de enfermedad, con una mediana para el seguimiento a largo plazo de 18,5 meses desde el momento de la segunda cirugía.
Discusión
Los quistes hepáticos son diagnosticados cada vez con más frecuencia y un subgrupo de esas lesiones será potencialmente categorizado como un TQB. Aunque esas lesiones pueden representar una premalignidad (CAB) o una franca malignidad (CACB), los datos sobre la presentación, manejo y pronóstico de los TQB son escasos. En efecto, los datos disponibles están limitados únicamente a reportes de casos o series de casos de centros asistenciales aislados [2,6,9,10,12,14,18,21,22].
Asimismo, los datos sobre los resultados a largo plazo de pacientes con TQB después de la cirugía, permanecen pobremente definidos. Aunque han sido reportados datos sobre la SG, la información sobre la recidiva global y los factores asociados con la misma, no ha sido reportada.
El presente estudio es valioso porque los autores examinaron una cohorte grande, multi-institucional, de pacientes con TQB, e identificaron ciertos factores que influenciaron la SLE y la SG. Específicamente, señalaron que la SG fue del 84,2%. Quizás más interesante, encontraron que la recidiva después de la resección quirúrgica del TQB fue relativamente alta, con cerca de 1 de 5 pacientes experimentando una recurrencia (18,4%).
Asimismo, identificaron ciertos factores asociados con el riesgo de recidiva, incluyendo la intervención quirúrgica (esto es, destechamiento/fenestración vs resección hepática formal) y los hallazgos anatomopatológicos (esto es, presencia vs ausencia de células en huso/estroma ovárico). Además, mientras que el sexo masculino se asoció con el riesgo de CACB, ningún marcador radiográfico específico podría diferenciar confiadamente un CAB de un CACB.
Los datos del presente estudio confirman la fuerte predilección de los TQB para ocurrir en mujeres, en la edad media de la vida. No obstante, es importante señalar que tanto el CAB como el CACB ocurrieron en hombres. Otros investigadores han sugerido que un TQB en un paciente masculino, se asocia con una alta posibilidad de un CACB [10]. Los autores de este trabajo corroboraron ese hallazgo, dado que el sexo masculino se asoció con un riesgo aumentado de CACB en este estudio. En su reporte de 20 casos de CAB y 10 casos de CACB, Wang y col., sugirieron también que la edad del paciente y el tamaño del tumor eran útiles para discriminar CAB de CACB.
Sin embargo, en la cohorte mucho más grande del presente estudio, los autores no fueron capaces de validar esos hallazgos. En efecto, notaron que el tamaño del tumor tenía una pobre habilidad para distinguir el CACB del CAB, mientras que la elevación de los marcadores tumorales, como el CA19-9, fue sólo moderadamente buena. Otros investigadores han sugerido que ciertas características radiológicas, tales como un nódulo mural, componente sólido o hipervascularidad, eran útiles para distinguir un CACB de un CAB [9,10]. Interesantemente, los autores del presente trabajo hallaron que esas características se asociaban con un alto valor predictivo negativo (91%), pero un bajo factor predictivo positivo.
En otras palabas, la ausencia de todas esas características sugería fuertemente un CAB más que un CACB; no obstante, la presencia de cualquiera de esas características no necesariamente implicaba que la lesión debía ser ciertamente un CACB. También es importante señalar que a un subgrupo de pacientes se les realizó sólo una TC o una RMN, lo que pudo no haber permitido una evaluación completa de la lesión. Por ejemplo, las calcificaciones, cuando están presentes, son frecuentemente delgadas y septales y, por lo tanto, pueden ser omitidas en la RMN. Dados los desafíos para diagnosticar un TQB preoperatoriamente, puede ser prudente un abordaje realizando una biopsia por congelación al momento de efectuar el destechamiento/fenestración para un quiste presumiblemente simple, para excluir un TQB [23].
Aunque los pacientes con TQB tuvieron una sobrevida alejada a 5 años de casi un 85%, la tasa de recidiva fue relativamente alta, del 18,4%. No sorprendentemente, la recidiva fue considerablemente más alta entre los pacientes que fueron sometidos a destechamiento/fenestración, comparado con una resección hepática formal. Otros autores han señalado que el potencial para un tratamiento curativo está fuertemente asociado con la remoción completa del TQB [2,8,9,24].
Aunque en la presente serie el abordaje laparoscópico se asoció también con la recidiva, ello se debió indudablemente al hecho de que la mayoría de los procedimientos laparoscópicos involucró una resección incompleta de la lesión, con un destechamiento/fenestración. Aunque la recidiva puede ser tratada frecuentemente con una operación adicional, es importante señalar que 2 pacientes que tuvieron inicialmente un CAB, recidivaron con un CACB.
Dado el peor pronóstico asociado con un CACB, la chance de recidiva debería ser obviamente evitada, o al menos minimizada en la mayor extensión posible. En consecuencia, sobre la base de estos datos, en conjunción con otros reportes, la resección completa es obligatoria para las lesiones de TQB, independientemente del abordaje quirúrgico.
El otro factor asociado con el riesgo de recidiva y peor resultado fue la presencia de células en huso/estroma ovárico. En efecto, los pacientes con células en huso/estroma ovárico tuvieron una incidencia 2 veces mayor de recidiva, comparado con los pacientes que no tuvieron esas características anatomopatológicas. Aunque algunos autores creyeron inicialmente que la presencia de células en huso/estroma ovárico era una característica esencial de los tumores CAB y CACB, otros autores han reconocido que ese no es necesariamente el caso.
Por ejemplo, en la serie reportada por Devaney y col. [8], el 15% del 30% de lesiones CAB/CACB tuvo evidencia de estroma de tipo ovárico. En el presente estudio, los autores notaron similarmente que cerca de un tercio de los pacientes tenía esas características anatomopatológicas. Sin embargo, a diferencia de la serie de Devaney, quien señaló que esas características distintivas ocurrían sólo en pacientes femeninas, los autores de este trabajo encontraron un subgrupo de especímenes de pacientes masculinos que tenía evidencia de estroma de tipo ovárico, aunque esa característica fue mucho más común entre las mujeres. Otros han puntualizado que el estroma de tipo ovárico encontrado en los TQB es similar en apariencia a las células estromales vistas en el tracto biliar en desarrollo y, por lo tanto, su presencia no está necesariamente restringida a las pacientes femeninas [8,25,26].
Este estudio tuvo varias limitaciones. A pesar de ser la serie más grande de TQB reportada en la literatura, tuvo aún una muestra de tamaño relativamente pequeño. Por ejemplo, hubo sólo 27 casos de CACB. Sin embargo, la presente serie fue varias veces mayor que los estudios previamente publicados sobre TQB. Aunque el diseño multi-institucional del estudio ofreció los beneficios de un poder estadístico mayor y la generalización de los resultados, la colaboración con múltiples instituciones limitó la habilidad para estandarizar fácilmente todos los criterios diagnósticos y de tratamiento.
Por ejemplo, todos los especímenes anatomopatológicos no fueron revisados centralmente. Eso puede explicar en parte la incidencia dispar de estroma ovárico y de hallazgos séricos que se reportaron, en comparación con estudios previos [4]. Hay varias razones por las que el estroma ovárico pudo haber sido subreportado, incluyendo que es notoriamente focal, que los CAB tienden a ser tumores grandes y que el análisis histológico completo de toda la superficie del área no es realizado frecuentemente, así como el hecho de que el estroma ovárico puede ser difícil de reconocer y que los marcadores inmunohistoquímicos no han sido ampliamente usados o conocidos hasta los últimos 10 años.
Las razones por las que aparece “seroso” en el reporte anatomopatológico son también multifactoriales. El epitelio biliar normal varía desde cúbico bajo en la periferia a columnar en el hilio. Las células en el quiste pueden mostrar variaciones similares a través de los casos y ocasionar que el observador refiera sólo las versiones epiteliales columnares como mucinosas y aquellas con epitelio cúbico bajo como seroso, porque la mucina es menos evidente en ese tipo de epitelio.
Muchos observadores usan también una tinción de mucina para demostrar la mucina celular en la región apical del epitelio; no obstante, cambios secundarios en el quiste, tales como esfacelo epitelial y aplanamiento local, podrían ser responsables por una tinción de mucina erróneamente negativa. En esos casos, es frecuentemente asumido que una tinción de mucina negativa debe significar que la lesión es serosa. Además, la metaplasia pilórica y foveolar es común y puede ser mal interpretada como un tipo de epitelio seroso, porque contiene una mucina que tiene un color diferente, más claro, en las tinciones de rutina, y es reactiva a un pH diferente en las tinciones de mucina, que el tipo de mucina intestinal más común.
Conclusiones
Los TQB se presentan más comúnmente como grandes quistes en mujeres, aunque cerca del 15% de los pacientes son hombres. Aunque la malignidad subyacente (CACB) no fue común ( 10%) entre los pacientes que fueron sometidos a cirugía por un TQB, parece que los pacientes masculinos con un TQB tuvieron una mayor probabilidad de tener un CACB versus un CAB. Otros factores clínicos (edad, tamaño del tumor) y radiológicos (nodularidad, componente sólido, hipervascularidad), no predicen confiadamente un CACB.
Después de la resección del CAB, los resultados a largo plazo fueron buenos; no obstante, los pacientes con CACB tuvieron un peor pronóstico alejado. Además, la recidiva ocurrió en hasta 1 de cada 5 pacientes y cerca de la mitad de los pacientes que tuvieron una resección incompleta experimentaron una recidiva. En consecuencia, los cirujanos deberían buscar rutinariamente una resección completa de la lesión durante el procedimiento inicial. Además, se requiere la vigilancia a largo plazo de todos los pacientes – tanto CAB como CACB – a causa del riesgo de recidiva.
Comentario y resumen objetivo: Dr. Rodolfo Altrudi