Introducción
La enfermedad pélvica inflamatoria (EPI) es una inflamación inducida por la infección del tracto reproductivo superior femenino (endometrio, trompas de Falopio, ovarios o peritoneo pélvico); la misma tiene una amplia gama de manifestaciones clínicas. La inflamación se disemina desde la vagina o el cuello uterino hacia el tracto genital superior, siendo la endometritis una etapa intermedia en la patogénesis de la enfermedad. El sello diagnóstico distintivo es el dolor pélvico combinado con la inflamación del tracto genital inferior; las mujeres con EPI tienen a menudo síntomas y signos muy sutiles. Muchas mujeres tienen diseminación asintomática de la infección hacia el tracto genital superior, lo que resulta en EPI subclínica.
"El sello diagnóstico distintivo es el dolor pélvico combinado con la inflamación del tracto genital inferior; las mujeres con EPI tienen a menudo síntomas y signos muy sutiles."
La EPI es un cuadro clínico preocupante, ya que puede provocar a largo plazo discapacidad reproductiva, incluyendo infertilidad, embarazo ectópico y dolor pélvico crónico. Después de la introducción de la laparoscopia en la década de 1960, la investigación sobre la EPI proliferó a través de los años 1970, 1980 y 1990, llevando a grandes avances en la comprensión de las causas microbianas de la enfermedad y su relación con la discapacidad reproductiva, y permitiendo la estandarización del tratamiento antimicrobiano.
De acuerdo con una estimación nacional, en el 2001 se produjeron más de 750.000 casos de EPI en los Estados Unidos. Durante las últimas dos décadas, las tasas y la gravedad de la EPI han disminuido en América del Norte y el oeste de Europa. Estos descensos han ocurrido en asociación con los esfuerzos en salud pública para controlar la infección por Chlamydia trachomatis y Neisseria gonorrhoeae. A pesar de los avances, sin embargo, la EPI sigue siendo un problema, ya que los resultados reproductivos entre las pacientes tratadas siguen siendo subóptimos, la EPI subclínica sigue estando mal controlada, y los programas destinados a la prevención de la enfermedad no son factibles en gran parte del mundo en desarrollo.
Fisiopatología y causas microbianas
La EPI aguda (≤ 30 días de duración) diagnosticada clínicamente es causada por la ascensión espontánea de microbios desde el cuello uterino o la vagina al endometrio, las trompas de Falopio y las estructuras adyacentes. Más del 85% de las infecciones se deben a patógenos cervicales de transmisión sexual o a microbios asociados a vaginosis bacteriana, y aproximadamente el 15% se deben a organismos respiratorios o entéricos que han colonizado el tracto genital inferior (Tabla 1). La EPI subclínica tiene causas similares a las de la EPI aguda y puede ser el doble de común.
La EPI crónica (> 30 días de duración) se define como la infección crónica por Mycobacterium tuberculosis o especies de Actinomyces más que como dolor pélvico recurrente crónico, que sigue siendo común después del tratamiento de la EPI aguda. Esta revisión se centra en la EPI aguda y subclínica.
La infección ascendente desde el cuello uterino se debe frecuentemente a infecciones por N. gonorrhoeae o C. trachomatis adquiridas sexualmente. Mycoplasma genitalium de transmisión sexual ha sido identificado como una probable causa de cervicitis, endometritis, salpingitis, e infertilidad, pero la evidencia es inconsistente. Los factores que determinan qué infecciones ascienden al tracto genital superior no han sido completamente dilucidados, pero los datos de estudios prospectivos sugieren que aproximadamente el 15% de las infecciones por clamidia no tratadas progresan a EPI de diagnóstico clínico.
El riesgo de EPI después de una infección gonocócica puede ser aún mayor. Las relaciones sexuales y la menstruación retrógrada pueden ser particularmente importantes en el movimiento de los organismos desde el tracto genital inferior al superior.
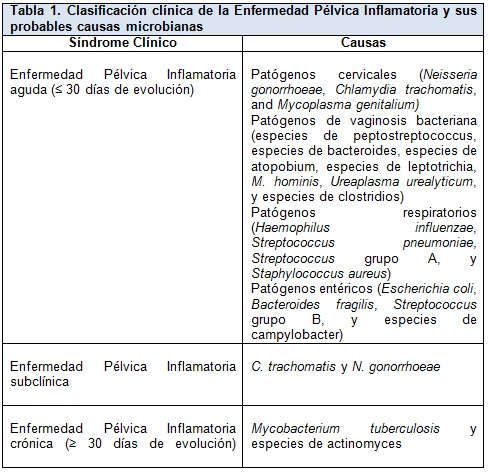
Las bacterias anaerobias y facultativas que se encuentran en la flora vaginal han sido aisladas solas o con N. gonorrhoeae y C. trachomatis en las trompas de Falopio de mujeres con EPI aguda (Tabla 1). Estos organismos se encuentran en mayores concentraciones en asociación con la vaginosis bacteriana, una disbiosis polimicrobiana caracterizada por la reducción de los lactobacilos vaginales normales y el crecimiento excesivo de un microbioma asociado a biofilm anaeróbico mucho más complejo. La vaginosis bacteriana se asocia con la producción local de enzimas que degradan el moco cervical y los péptidos antimicrobianos asociados. Esta degradación puede alterar la barrera cervical a la infección ascendente y facilitar la propagación de los microorganismos hacia el tracto genital superior.
La infección resulta en daño inflamatorio fibrinoso o supurativo a lo largo de la superficie epitelial de las trompas de Falopio y de la superficie peritoneal de las trompas de Falopio y los ovarios, lo que conduce a cicatrices, adherencias, y posiblemente obstrucción tubaria parcial o total. La respuesta inmune adaptativa juega un papel en la patogénesis de la EPI porque la reinfección aumenta considerablemente el riesgo de infertilidad por factor tubario (es decir, incapacidad para concebir debido al daño estructural o funcional de las trompas de Falopio).
La pérdida selectiva de las células epiteliales ciliadas inducida por la infección a lo largo del epitelio de las trompas de Falopio puede causar alteración del transporte del óvulo, dando como resultado infertilidad de causa tubárica o embarazo ectópico. Las adherencias peritoneales a lo largo de las trompas de Falopio pueden prevenir el embarazo y las adherencias dentro de la pelvis se relacionan con dolor pélvico.
Manifestaciones clínicas y diagnóstico
La EPI es particularmente común entre las mujeres adolescentes y jóvenes sexualmente activas, que son tratadas frecuentemente en clínicas ambulatorias, consultorios médicos o departamentos de emergencias. La aparición repentina de un dolor abdominal bajo severo durante o poco después de la menstruación ha sido el síntoma clásico utilizado para identificar la EPI aguda, aunque actualmente es bien reconocido que tanto el inicio como la gravedad de los síntomas pueden ser más vagos y sutiles.
Las manifestaciones clínicas más leves, atípicas, se han vuelto más comunes debido al descenso de las tasas de infección por N. gonorrhoeae. Los síntomas asociados con EPI aguda incluyen dolor abdominal inferior o pélvico de gravedad variable, flujo vaginal anormal, sangrado inter-menstrual o postcoital, dispareunia, y disuria. El cuadro clínico puede presentarse con fiebre, pero las manifestaciones sistémicas no son una característica prominente de la EPI. Ocasionalmente, un dolor en el cuadrante superior derecho sugestivo de inflamación y formación de adherencias en la cápsula del hígado (peri-hepatitis o Síndrome de Fitz-Hugh-Curtis) puede acompañar a la EPI.
Hay mucha evidencia que sugiere que puede ocurrir infección e inflamación en el tracto genital superior dando lugar a complicaciones reproductivas a largo plazo en ausencia de síntomas, una condición llamada EPI subclínica. Las infecciones asintomáticas del tracto genital superior han sido bien documentadas, y la mayoría de las mujeres con infertilidad de causa tubaria no tienen antecedentes de EPI diagnosticada clínicamente, como se ha observado en estudios que muestran una fuerte asociación entre la infertilidad y la evidencia serológica de infección previa por C. trachomatis o N. gonorrhoeae.
Entre mujeres con infertilidad de causa tubaria, las muestras de biopsia muestran daño tubario patológico similar en las mujeres que tienen una historia de EPI y en las que no. Sin embargo, en un estudio que involucró mujeres infértiles sin antecedentes de diagnóstico de EPI, el 60% de las mujeres con infertilidad por factor tubario, en comparación con sólo el 19% de aquellas sin infertilidad de causa tubaria, reportó haber consultado por dolor abdominal; esto sugiere que muchos casos de EPI se pasan por alto y que los médicos deben tener un bajo umbral para considerar el diagnóstico.
"Hay mucha evidencia que sugiere que puede ocurrir infección e inflamación en el tracto genital superior dando lugar a complicaciones reproductivas a largo plazo en ausencia de síntomas, una condición llamada EPI subclínica."
El diagnóstico clínico de EPI se basa en el hallazgo de dolor en los órganos pélvicos, como se indica por el dolor a la movilización cervical, la sensibilidad anexial o el dolor a la compresión uterina en el examen bimanual, en conjunto con signos de inflamación del tracto genital inferior. Los signos de inflamación del tracto genital inferior incluyen mucopus cervical, que se visualiza como un exudado del endocérvix o como un moco amarillo o verdoso en un hisopo con punta de algodón colocado suavemente en el orificio cervical ("hisopado" positivo); friabilidad cervical (sangrado epitelial columnar fácilmente inducido); o aumento de glóbulos blancos en el examen microscópico con solución salina de las secreciones vaginales (preparación en fresco).
El dolor pélvico de cualquier tipo tiene alta sensibilidad (> 95%) para EPI, pero poca especificidad. Los hallazgos de inflamación del tracto genital inferior aumentan la especificidad del diagnóstico.
Desafortunadamente, el diagnóstico clínico de la EPI es impreciso. Sólo cerca del 75% de las mujeres que han recibido un diagnóstico clínico de EPI en base a síntomas de dolor pélvico e inflamación del tracto genital inferior tienen confirmación laparoscópica de salpingitis (visualización de inflamación tubaria y uterina, exudados, adherencias, o absceso). Aunque la laparoscopia ha sido considerada el estándar para el diagnóstico de EPI, tiene alta variabilidad interobservador y podría no detectar la endometritis o la inflamación tubaria temprana.
Además, es un procedimiento quirúrgico invasivo que no está fácilmente disponible en muchos lugares y que no se realiza de forma rutinaria, especialmente en mujeres con síntomas leves a moderados. La aspiración endometrial transcervical con hallazgos histopatológicos de aumento del número de células plasmáticas y neutrófilos es más comúnmente utilizada para confirmar el diagnóstico de EPI, y estos resultados se ven a menudo en asociación con salpingitis confirmada laparoscópicamente. Sin embargo, la biopsia endometrial es algo invasiva, requiere habilidad para la interpretación patológica de las muestras, y da como resultado un retraso en el diagnóstico.
Las imágenes por ecografía transvaginal y resonancia magnética (RM) que revelan trompas engrosadas, llenas de fluido están disponibles durante la evaluación diagnóstica y son altamente específicas para salpingitis. Sin embargo, la sensibilidad de la ecografía es solo justa, y aunque la RM tiene una alta sensibilidad, es cara y no suele estar fácilmente disponible en ambientes de bajos recursos. Los estudios Doppler que muestran un aumento del flujo sanguíneo en las trompas de Falopio son altamente sugestivos de infección. Los estudios por imágenes también pueden ser útiles para elaborar alternativas diagnósticas, tales como quiste ovárico, endometriosis, embarazo ectópico o apendicitis aguda; estas condiciones se pueden encontrar en el 10 a 25% de las mujeres con sospecha de EPI.
Todas las pacientes con sospecha de EPI deben someterse a pruebas de PCR para infección cervical o vaginal por N. gonorrhoeae y C. trachomatis; si los resultados son positivos, la probabilidad diagnóstica de EPI aumenta sustancialmente. Las pruebas moleculares para M. genitalium no están aún disponibles comercialmente. El fluido vaginal debe ser evaluado en busca de un aumento del número de glóbulos blancos (más de un neutrófilo por célula epitelial) y de signos de vaginosis bacteriana, incluyendo células del epitelio vaginal con sus márgenes celulares oscurecidos por las bacterias adheridas (es decir, células clave), un pH elevado, y un olor a amina con la adición de hidróxido de potasio (prueba positiva).
Normalmente, la vaginosis bacteriana es una condición no inflamatoria, y si los glóbulos blancos acompañan a las células clave, esto sugiere una EPI. Debe solicitarse una prueba de embarazo de forma rutinaria para ayudar a descartar un embarazo ectópico. Deben realizarse pruebas serológicas para el virus de la inmunodeficiencia humana (VIH); el VIH aumenta el riesgo de absceso tuboovárico. La elevación de la eritrosedimentación o de la proteína C reactiva puede aumentar la especificidad del diagnóstico de EPI.
Tratamiento
Las guías para el tratamiento de la EPI fueron desarrolladas por los Centros para el Control y Prevención de Enfermedades (CDC) en base a los resultados de ensayos clínicos y de consensos de recomendaciones de expertos clínicos (Tabla 2). El tratamiento de la EPI es empírico e implica el uso de una combinación de regímenes de agentes antimicrobianos de amplio espectro para cubrir probables patógenos. El tratamiento debe cubrir los principales patógenos, N. gonorrhoeae y C. trachomatis, independientemente de los resultados de las pruebas.
La necesidad de cubrir anaerobios no ha sido definitivamente establecida en ensayos clínicos aleatorios, pero dado que la vaginosis bacteriana es frecuente en las mujeres con EPI y que a menudo se recuperan anaerobios de las muestras del tracto genital superior, se recomienda el uso de antimicrobianos con cobertura anaeróbica. La cobertura confiable del M. genitalium es problemática, porque la mayoría de las cepas son resistentes a la doxiciclina.
| Tabla 2. Tratamiento antimicrobiano de primera línea recomendado por los Centros para el Control y Prevención de Enfermedades (CDC) para la enfermedad pélvica inflamatoria.* |
| Régimen ambulatorio para la enfermedad pélvica inflamatoria leve a moderada: •Doxiciclina (100 mg por vía oral dos veces al día durante 2 semanas) con o sin metronidazol (500 mg por vía oral dos veces al día durante 2 semanas), más uno de los siguientes: •Ceftriaxona (250 mg por vía intramuscular en una dosis única) •Cefoxitina (2 g por vía intramuscular) con probenecid (1 g por vía oral) simultáneamente en una sola dosis •Otra cefalosporina de tercera generación parenteral (cefotaxima o ceftizoxima) |
| Régimen para pacientes hospitalizadas por enfermedad pélvica inflamatoria moderada a severa con o sin absceso tubo-ovárico† Uno de los siguientes: •Cefotetan (2 g por vía intravenosa cada 12 horas), además de doxiciclina (100 mg por vía oral o por vía intravenosa cada 12 horas) •Cefoxitina (2 g por vía intravenosa cada 6 horas), además de doxiciclina (100 mg por vía oral o por vía intravenosa cada 12 horas) •Clindamicina (900 mg por vía intravenosa cada 8 horas) más gentamicina (3 a 5 mg por kilogramo de peso corporal por vía intravenosa una vez al día) |
*Información sobre el tratamiento completo, incluyendo regímenes alternativos y consideraciones adicionales, está disponible en el sitio web del CDC
†La transición a la terapia oral por lo general puede ser iniciada dentro de 24 a 48 horas después de la mejora clínica, y se debe continuar hasta completar 2 semanas de tratamiento.
La moxifloxacina erradica de manera confiable al M. genitalium; sin embargo, N. gonorrhoeae ha adquirido resistencia a quinolonas, por lo que la monoterapia con quinolonas para la EPI ya no se recomienda como rutina. La sustitución de azitromicina por doxiciclina cubre M. genitalium y simplifica la dosificación. Sin embargo, en un ensayo reciente sobre el tratamiento de la uretritis no gonocócica, se halló que la azitromicina era menos confiable que la doxiciclina para la erradicación de C. trachomatis, por lo que se considera un régimen alternativo.
El estudio de Salud Clínica y Evaluación de la Enfermedad Pélvica Inflamatoria (conocido como PEACH) mostró que entre las mujeres con EPI leve a moderada, la eficacia de la terapia con cefoxitina-doxiciclina, con respecto a las complicaciones a corto y a largo plazo, fue similar en pacientes hospitalizados y ambulatorios. Lo mismo pareció ser cierto para las adolescentes. Las razones para la hospitalización por EPI actualmente incluyen: embarazo, incapacidad para descartar otros diagnósticos, enfermedad severa combinada con incapacidad para tomar medicamentos orales, o absceso tubario.
La mayoría de las mujeres son tratadas con éxito como pacientes ambulatorias con una dosis única de ceftriaxona intramuscular, cefoxitina más probenecid, u otra cefalosporina de tercera generación (cefotaxima o ceftizoxima), seguido de doxiciclina oral con o sin metronidazol durante 2 semanas (Tabla 2). Para las pacientes hospitalizadas, se recomienda la terapia con cefotetan o cefoxitina (administrados por vía parenteral hasta 24 a 48 horas después de la mejoría clínica) junto con doxiciclina, seguido por doxiciclina con o sin metronidazol hasta completar las 2 semanas de tratamiento.
Un régimen de clindamicina y un aminoglucósido puede ser particularmente apropiado para las pacientes con absceso tubo-ovárico. El tratamiento adyuvante con antiinflamatorios no esteroideos no mejora los resultados clínicos. La remoción del dispositivo intrauterino (DIU) no acelera la resolución clínica (y puede retrasarla), y en la mayoría de los casos, el DIU se deja en su lugar.
"El tratamiento de la EPI es empírico e implica el uso de una combinación de regímenes de agentes antimicrobianos de amplio espectro para cubrir probables patógenos. El tratamiento debe cubrir los principales patógenos, N. gonorrhoeae y C. trachomatis, independientemente de los resultados de las pruebas."
Resultados reproductivos a largo plazo
Aunque más del 90% de las pacientes con EPI tendrá una respuesta clínica al tratamiento recomendado por el CDC, el resultado del tratamiento a largo plazo es aún subóptimo. En estudios clásicos realizados entre 1960 y 1984, Westrom y colegas siguieron a 2501 mujeres suecas durante varios años después de que se sometieran a laparoscopia y tratamiento para EPI sospechada clínicamente; 1844 mujeres (74%) tenían salpingitis confirmada. En general, se desarrolló infertilidad (es decir, incapacidad de concebir después de 1 año de tratar de quedar embarazada) en el 16% de las mujeres con salpingitis confirmada por laparoscopia, en comparación con el 2,7% de las mujeres con sospecha clínica de EPI pero sin salpingitis. Adicionalmente, el 9% de las mujeres con salpingitis tuvieron un embarazo ectópico subsiguiente.
El estudio PEACH proporciona estimaciones más modernas del riesgo de secuelas reproductivas entre 831 mujeres americanas urbanas tratadas con cefoxitina y doxiciclina por EPI leve a moderada diagnosticada clínicamente entre 1996 y 1999. Después de 3 años de seguimiento, aproximadamente el 18% de las mujeres informó infertilidad, el 0,6% tenía un embarazo ectópico, y el 29% tenía dolor pélvico crónico (dolor reportado en dos o más consultas consecutivas con 3-4 meses de diferencia durante un período de 2 a 5 años); 15% de las mujeres tenía EPI recurrente. Ambos estudios indican que los episodios repetidos de EPI empeoran marcadamente los resultados reproductivos. Es de destacar que el retraso en la consulta por EPI también se ha asociado fuertemente con peores resultados a largo plazo.
Queda poco claro por qué el resultado a largo plazo de la EPI se manifiesta de esa manera, dadas las altas tasas de respuesta clínica. Tal vez el daño en las trompas de Falopio inducido por la infección es producido al mismo tiempo que se administra el tratamiento. Esta observación, junto con la frecuente aparición de EPI subclínica, han puesto de relieve la importancia de reconocer a la prevención de la EPI como una prioridad de salud pública.
Prevención
La medida más importante de salud pública para la prevención de la EPI es la prevención y control de las infecciones de transmisión sexual por C. trachomatis o N. gonorrhoeae. Muchos países de altos ingresos han implementado programas para detectar y tratar a las mujeres con infección asintomática por C. trachomatis, en base a la evidencia de ensayos controlados aleatorios que indican que la detección y el tratamiento de la infección del cuello uterino por C. trachomatis puede reducir el riesgo de EPI en una mujer en aproximadamente un 30 a 50% por más de 1 año.
El Grupo de Trabajo de los Servicios Preventivos de Estados Unidos, el CDC, y otras organizaciones profesionales recomiendan el screening anual para C. trachomatis de todas las mujeres sexualmente activas menores de 25 años de edad y mujeres mayores con aumento del riesgo de infección (por ejemplo, mujeres con parejas sexuales múltiples o nuevas). Estos grupos también recomiendan la realización de pruebas para N. gonorrhoeae entre las mujeres con mayor riesgo de infección (por ejemplo, mujeres con múltiples parejas sexuales o infección gonorreica anterior y mujeres de comunidades con alta prevalencia de la enfermedad).
La educación sexual integral, la promoción del uso de preservativos, y la provisión de condones son pilares de la prevención de las infecciones de transmisión sexual a nivel mundial y también ofrecen beneficios para la prevención de la EPI. Los datos del estudio PEACH mostraron que el uso persistente del condón durante el seguimiento se asoció con un menor riesgo de EPI recurrente, dolor pélvico crónico e infertilidad. En las mujeres con EPI debida a N. gonorrhoeae o C. trachomatis, la reinfección y la EPI recurrente son frecuentes.
Por lo tanto, la pronta evaluación y tratamiento empírico de las parejas sexuales masculinas de las mujeres con EPI o infección del cuello uterino es esencial. Si las parejas sexuales no pueden vincularse a la atención, el tratamiento expeditivo de las mismas (por ejemplo, proporcionando recetas o medicamentos al paciente para que tome su pareja, sin realizar examen clínico) es un enfoque útil y ha demostrado que reduce el riesgo de reinfección.
Preguntas sin respuesta y necesidades sin dirección
Los Institutos Nacionales de Salud convocaron recientemente a un taller para identificar las necesidades de investigación para la mejora del diagnóstico, el tratamiento, y la prevención de la EPI (Tabla 3). Una de las necesidades más importantes de investigación con respecto a la EPI y a la atención clínica de las mujeres con la enfermedad es el desarrollo de una prueba exacta no invasiva o mínimamente invasiva para confirmar la infección de las trompas de Falopio o los cambios inflamatorios que predicen la enfermedad del tracto reproductivo a largo plazo.
Los biomarcadores de la respuesta inmune a C. trachomatis pueden predecir la infertilidad por factor tubario debido a enfermedad subclínica. Sin embargo, se necesitan biomarcadores adicionales. Los niveles de CA-125 y E-cadherina en suero se correlacionan con el diagnóstico de EPI aguda y se pueden utilizar para realizar un seguimiento de la respuesta al tratamiento.
Se necesitan más estudios antes de que estos ensayos se adopten en la práctica clínica. El análisis inmunohistoquímico y la citometría de flujo están siendo utilizados para definir los patrones de infiltrado celular específicos a partir de muestras de biopsia de endometrio que se correlacionan con la infección. Varios estudios que han evaluado el diagnóstico por imágenes han demostrado el potencial de la resonancia magnética, la ecografía transvaginal, y el Doppler de potencia para mejorar el diagnóstico de la EPI, pero se necesitan estudios de seguimiento más grandes para definir mejor el papel de estas técnicas en el tratamiento de las mujeres sintomáticas y asintomáticas con infección del tracto genital inferior.
En estudios recientes en poblaciones de altos ingresos, menos de la mitad de las mujeres con EPI han tenido evidencia de infección por C. trachomatis o N. gonorrhoeae, y la causa microbiológica exacta de la inflamación sigue siendo poco clara. M. genitalium y microbios asociados con vaginosis bacteriana han sido implicados como causas potenciales. Son necesarios estudios confirmatorios para definir el rol independiente de M. genitalium como causante de la EPI y de secuelas a largo plazo.
Los resultados de un ensayo clínico en curso (ClinicalTrials.gov, número NCT01160640) para evaluar la adición de metronidazol a los regímenes de tratamiento de la EPI se esperan para este año y deberían ayudar a aclarar el papel que juegan los organismos que causan vaginosis bacteriana en la patogénesis de la EPI. Los cultivos anaeróbicos y los métodos de secuenciación profunda están siendo utilizados para identificar los organismos específicos asociados con vaginosis bacteriana más tendientes a causar EPI.
Por razones financieras y logísticas, los programas de prevención de la EPI que se basan en la detección simplemente no están disponibles en países de ingresos medios o bajos, donde la carga de EPI puede ser mayor. El perfil epidemiológico mundial de la EPI no ha sido bien definido. Sin embargo, debido a que se producen estimativamente 95,5 millones de infecciones por C. trachomatis y N. gonorrhoeae a nivel mundial entre las mujeres cada año, y que aproximadamente el 15% de las infecciones no tratadas conducen a EPI, la carga mundial de esta enfermedad es probablemente sustancial.
La proporción de infertilidad que se debe a factor tubario - y por lo tanto causada principalmente por la cicatrización secundaria a la infección genital - varía ampliamente según el entorno. En los Estados Unidos, la infertilidad por factor tubario afecta al 14% de las parejas que buscan tecnología de reproducción asistida por infertilidad; en el África subsahariana, la infertilidad por esta causa puede estar presente en el 65 al 85% de las mujeres que buscan atención médica por infertilidad.
Tabla 3. Necesidades de investigación identificadas por médicos, profesionales de la salud pública, e investigadores en el Taller de los Institutos Nacionales de Salud del 2011*
• Caracterizar los aspectos fisiopatológicos de la enfermedad
Determinar si M. genitalium y organismos asociados a vaginosis bacteriana desempeñan un papel causal en la enfermedad pélvica inflamatoria y sus secuelas
Determinar si la endometritis histopatológica se correlaciona con la enfermedad pélvica inflamatoria subclínica y sus secuelas
• Identificar biomarcadores
Identificar biomarcadores inmunológicos y otros biomarcadores que se correlacionan con la enfermedad pélvica inflamatoria y sus secuelas, así como pruebas no invasivas para detectarlos y medirlos
• Mejorar la detección de la enfermedad
Desarrollar pruebas polimicrobianas para la infección del tracto genital inferior
Evaluar las pruebas diagnósticas que se administran al paciente para mejorar la detección de casos
Determinar los valores predictivos individuales y combinados de la detección de C. trachomatis y N. gonorrhoeae, de la biopsia endometrial, y de las imágenes (RMN y ecografía) para la detección de la enfermedad pélvica inflamatoria
• Determinar el tratamiento más eficaz
Determinar los beneficios de la cobertura antimicrobiana para anaerobios y especies de micoplasmas
Mejorar los regímenes orales ambulatorios
Determinar los beneficios de los agentes de modulación inmune
• Prevenir la reinfección
Mejorar los mecanismos de tratamiento de la pareja
La mayoría de los médicos en países de bajos y medianos ingresos confían en el manejo sindrómico (por ejemplo, utilizando algoritmos de síntomas genitales para guiar el tratamiento) sin pruebas de diagnóstico. Dado que la mayoría de las infecciones por C. trachomatis y N. gonorrhoeae en las mujeres son asintomáticas, gran parte se pierde en el diagnóstico. Además, el diagnóstico sindrómico de flujo vaginal es un pobre predictor de infección cervical por N. gonorrhoeae y C. trachomatis.
Se requieren urgentemente pruebas diagnósticas para C. trachomatis y N. gonorrhoeae que sean fáciles de usar en ambientes de bajos recursos. Sin embargo, los costos y la complejidad de los programas de detección aún pueden ser prohibitivos. Además, el espectro de N. gonorrhoeae resistente a las cefalosporinas se cierne en el horizonte. Por lo tanto, la Organización Mundial de la Salud ha concluido que el desarrollo de vacunas contra C. trachomatis y N. gonorrhoeae es una prioridad crítica para la prevención de la EPI y sus secuelas a largo plazo a nivel mundial.
El proceso está más avanzado para C. trachomatis, para el que han emergido vacunas inactivadas o vivas de la investigación básica que requieren un mayor desarrollo clínico. Las vacunas y otras estrategias de prevención de la EPI están en el centro de los esfuerzos para mejorar la salud reproductiva de las mujeres a nivel mundial
Resumen y comentario objetivo: Dra. María Eugenia Noguerol