En los últimos años, hubo avances significativos en la comprensión de la injuria renal aguda (IRA) y su impacto en los resultados a través de la medicina. La investigación basada en cohortes de un solo centro indica que la IRA neonatal es muy común y se asocia con pobres resultados.
En esta revisión actualizada sobre IRA neonatal, se destacan los aspectos únicos de la fisiología renal neonatal, definiciones, factores de riesgo, epidemiología, resultados, evaluación, y manejo de la IRA en neonatos. Se describen los cambios en la función renal con la edad gestacional y cronológica. Se priorizan y describen los criterios de IRA modificados para neonatos y se proporciona la justificación para su uso en base a una definición estandarizada de IRA neonatal.
Se discuten los factores de riesgo para la IRA neonatal y se sugiere las poblaciones de pacientes que pueden justificar una vigilancia más estrecha, incluyendo recién nacidos < 1500 g, niños que experimentan asfixia perinatal, lactantes pretérmino/término con bajas puntuaciones de Apgar, aquellos tratados con oxigenación por membrana extracorpórea, y los que requieren cirugía cardiaca.
Se proporcionan recomendaciones para la evaluación y el tratamiento de estos pacientes, incluyendo medicamentos y terapias de reemplazo renal. Se discute la necesidad de seguimiento a largo plazo de los neonatos con IRA para identificar a los niños que desarrollarán enfermedad renal crónica. Esta revisión destaca los déficits en la comprensión de la IRA neonatal que requieren mayor investigación. En un esfuerzo para empezar a abordar estas necesidades, se formó el Grupo Colaborativo Renal Neonatal en 2014 con el objetivo de comprender mejor la IRA neonatal, para comenzar a responder preguntas críticas, y mejorar los resultados en estas poblaciones vulnerables.
Introducción
Durante los últimos 15 años, ha habido avances significativos en el estudio de la injuria renal aguda (IRA) en relación al diagnóstico, el reconocimiento, la intervención, y el impacto de la IRA en la morbilidad y mortalidad de niños críticamente enfermos. Se ha puesto de manifiesto que los niños que sobreviven a un episodio de IRA están en mayor riesgo de enfermedad renal crónica (ERC) y esto garantiza un seguimiento a largo plazo. Los estudios sobre IRA neonatal han comenzado a mostrar conclusiones similares: la IRA es frecuente y se asocia con pobres resultados. Estos estudios siguen estando limitados a pequeñas cohortes de un solo centro que utilizan diversas definiciones de IRA, haciendo difícil la generalización.
Aunque se ha avanzado en la comprensión de la IRA neonatal, es necesaria una enorme cantidad de trabajo para optimizar la capacidad para detectar e intervenir en los recién nacidos con IRA. Para avanzar en este campo, el Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales (INDEDR) patrocinó un taller dedicado a la IRA neonatal en abril de 2013.
Un resultado importante de esta reunión fue el reconocimiento de que la colaboración entre neonatólogos y nefrólogos era imperativa para avanzar en el estudio de la IRA neonatal y para mejorar los resultados en estos pacientes vulnerables. En esta revisión actualizada, se examinan los aspectos de la IRA neonatal, incluyendo la fisiología renal neonatal, definiciones, factores de riesgo, epidemiología y resultados, y la evaluación y manejo de la IRA.
Fisiología renal neonatal:
Aunque una discusión detallada del desarrollo renal está fuera del alcance de esta revisión, hay una serie de características de la fisiología renal neonatal que son pertinentes a la IRA en recién nacidos, incluyendo la duración de la nefrogénesis, el flujo sanguíneo renal, la tasa de filtración glomerular (TFG), y la inmadurez tubular. La nefrogénesis comienza en la quinta semana de gestación y continúa hasta las 34 a 36 semanas, llevando a la dotación adulta de 200.000 a 2.700.000 nefronas. El impacto de la prematurez, la restricción del crecimiento intrauterino y la IRA en la nefrogénesis no ha sido totalmente delineado, pero estudios pequeños sugieren que el ambiente extrauterino y la IRA son perjudiciales para una nefrogénesis óptima.
Hay cambios significativos en el flujo sanguíneo renal neonatal después del nacimiento que son relevantes para el estudio de la IRA en los recién nacidos. En comparación con el 20% a 25% del gasto cardíaco recibido por el riñón adulto, al nacer los riñones reciben 2,5% a 4% del gasto cardíaco. Con el tiempo, esto aumenta al 6% a las 24 horas de vida, 10% a la semana, y 15% a 18% a las 6 semanas de edad. Los cambios en el flujo sanguíneo renal después del nacimiento resultan del aumento de la presión de perfusión renal, del aumento de la resistencia arteriolar sistémica y de la disminución de la resistencia vascular renal debido a cambios neurohumorales, con la angiotensina II y las prostaglandinas jugando los roles principales.
En el período fetal y neonatal, el sistema renina-angiotensina es fundamental para el desarrollo renal normal y el flujo de sangre. La angiotensina II, molécula efectora del sistema renina-angiotensina, causa vasoconstricción en las arteriolas aferentes y eferentes con un mayor impacto en la arteriola eferente. Las prostaglandinas representan las moléculas contrarreguladoras más importantes en el período neonatal y producen dilatación de la arteriola aferente. La importancia de cada uno de estos sistemas se ve en la respuesta exacerbada que los neonatos críticamente enfermos tienen a la inhibición de estos sistemas por medicamentos cuando se desarrolla oliguria y/o IRA después de la exposición.
La TFG representa la medida de función renal más reconocida. En lactantes de término, la TFG mejora de 10 a 20 ml/min/1,73 m2 durante los primeros días de vida a 30 a 40 ml/min/1,73 m2 a las 2 semanas de vida. En lactantes prematuros, la TFG al nacimiento es aún menor y aumenta más lentamente que en los niños de término. La TFG mejora constantemente durante los primeros meses de vida, hasta alcanzar la TFG de los adultos a los 2 años de edad. La naturaleza dinámica de la TFG neonatal tiene implicaciones para el cuidado de los recién nacidos, en particular con respecto a la exposición a fármacos, dosis, y susceptibilidad al desarrollo de IRA.
El neonato de término tiene una función tubular renal más madura, que puede responder adecuadamente a las necesidades homeostáticas. La función tubular es inmadura en los lactantes prematuros, con una disminución de la capacidad para reabsorber electrolitos y proteínas y para concentrar la orina. Esto tiene importantes implicaciones para el manejo y el diagnóstico de la IRA en prematuros, confiando en que el clínico prescribe los líquidos y reemplaza las pérdidas de electrolitos apropiadamente. La inmadurez de estos mecanismos en el riñón neonatal explica algunas de las sutilezas de los hallazgos urinarios (excreción fraccional de sodio) en la IRA neonatal que difieren en niños mayores.
Definición de IRA neonatal:
La IRA se define clásicamente como una disminución repentina de la función renal que resulta en alteraciones del equilibrio de líquidos, electrolitos y productos de residuo. En la actualidad, el diagnóstico de IRA es dependiente de un aumento de la creatinina sérica (Cr) o de una disminución de la diuresis.
Desafortunadamente, la Cr es un biomarcador subóptimo, ya que es un marcador de función renal, no de daño. Como resultado, hay un retraso significativo en el aumento de la Cr después de una injuria (48-72 horas) y se pierde una cantidad significativa de función antes de que se eleve la Cr (> 50% de la TFG). La Crs también tiene particularidades únicas en la población neonatal, incluyendo la presencia de creatinina materna, grados variables de reabsorción de creatinina en los túbulos proximales, TFGs generales inferiores, y diferencias madurativas.
Como resultado, ha habido una significativa cantidad de investigación para identificar nuevos biomarcadores de daño para permitir la identificación temprana de los recién nacidos con IRA (hasta 48 horas antes del aumento de la Cr). Estos nuevos biomarcadores incluyen a la lipocalina urinaria asociada a gelatinasa de neutrófilos, la cistatina-C, la molécula de injuria renal-1, y otros. Al detectar las primeras etapas de la lesión renal, estos biomarcadores pueden permitir la prevención o la intervención temprana en la IRA en neonatos. Aunque estos biomarcadores continúan siendo una promesa, en la actualidad la Cr es el estándar utilizado para el diagnóstico de IRA en todas las poblaciones.
En 2005 se introdujo una definición empírica para IRA en la literatura pediátrica y de adultos que reconocía estadíos de gravedad en base a una disminución de la TFG y/o producción de orina. Esta definición fue desarrollada en base a la evidencia de que incluso pequeños cambios en la Cr se asociaban con una mayor morbilidad y mortalidad.
Las definiciones actuales han demostrado que incluso pequeños grados de IRA se asocian con una mayor morbilidad y mortalidad en niños y adultos. Esta definición empírica ha evolucionado en base a datos observacionales de millones de pacientes y a cientos de estudios dentro de la definición de IRA de “Enfermedades Renales: Mejora de los Resultados Globales (ERMRG)” publicada en 2013, manteniendo un modelo de estadificación categórica en 3 niveles que representan los estadios leve, moderado y severo de la IRA. El uso de definiciones de IRA estandarizadas ha permitido la comparación entre estudios y ha sido un primer paso fundamental e integral para el estudio de la IRA en medicina.
Antes de 2008, la mayoría de los estudios sobre IRA neonatal utilizaron definiciones arbitrarias de IRA frecuentemente definida por una Cr absoluta ≥ 1,5 mg/dl. En respuesta a las tendencias en el diagnóstico de la IRA, se realizaron una serie de estudios neonatales utilizando las definiciones de IRA de Riesgo, Lesión, Falla, Pérdida de la función renal, y Enfermedad renal en etapa terminal (conocido como RIFLE) y de la Red de Trabajo sobre Lesión Renal Aguda (RTLRA). Una de tales definiciones estandarizadas de IRA descripta en detalle por Jetton y Askenazi se basa en una modificación de la definición ERMRG denominada criterio ERMRG modificado neonatal (Tabla 1).
Tabla 1. Clasificación ERMRG de IRA neonatal
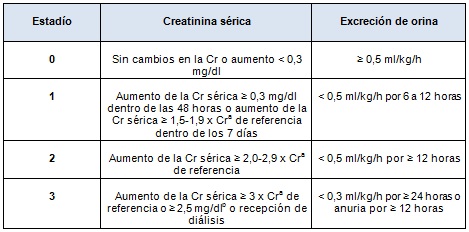
Las diferencias entre la definición de IRA neonatal propuesta y la ERMRG incluyen las siguientes:
aLa Cr sérica de referencia se define como el valor anterior más bajo de Cr sérica.
bEl valor de Cr de 2,5 mg/dl representa < 10 ml/min/1,73m2.
Esta definición clasifica la IRA en etapas en base a un aumento absoluto en la Cr a partir de un control anterior y debe ser utilizada en niños < 120 días de vida. En abril de 2013, neonatólogos y nefrólogos pediátricos participantes del taller del INDEDR escudriñaron cuidadosamente esta definición. Ellos concluyeron que, en este momento, esta definición ofrece un punto de partida razonable y permitiría la consistencia a lo largo de los estudios.
Como esta definición es empírica, se requieren grandes estudios multicéntricos para validar esta definición y abarcar todos los aspectos de las definiciones, incluyendo el grado de aumento de la Cr, la edad de utilización, y cómo hacer frente a un aumento de la Cr sérica de 0,2 a 0,3 mg/dl, lo que técnicamente representa un aumento de 1,5 veces y calificaría como IRA. Algunos han sugerido que la Cr debería elevarse a un valor absoluto de 0,5 mg/dl y cumplir con los criterios anteriores para calificar como IRA.
Factores de riesgo para IRA Neonatal
El cambio en la función renal que define a la IRA debe ser pensado como el resultado de una combinación de factores de susceptibilidad y exposiciones. Aunque los recién nacidos están sujetos a los mismos factores de riesgo presentes en los niños críticamente enfermos de todas las edades, debe hacerse una consideración especial con respecto a los factores de riesgo inherentes al desarrollo y a la fisiología renal neonatal. Por lo tanto, se revisan los factores de riesgo perinatales y postnatales asociados con IRA, incluyendo eventos/exposiciones perinatales, sepsis, y exposición a medicamentos nefrotóxicos que permiten identificar a los neonatos que requieren una mayor vigilancia (Tabla 2).
Tabla 2. Factores de riesgo para IRA en neonatos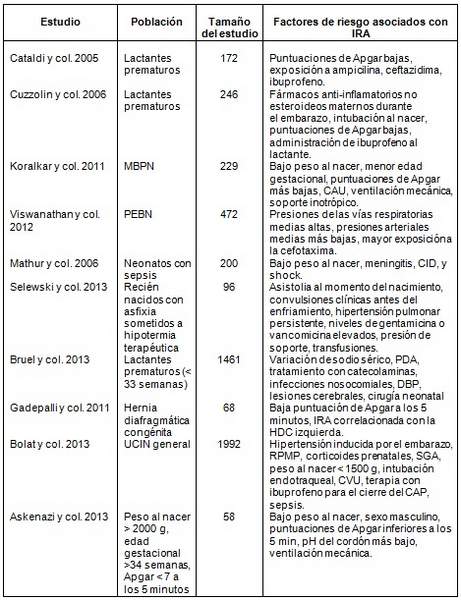
DBP: Displasia broncopulmonar; HDC: Hernia diafragmática congénita; CID: Coagulación intravascular diseminada; RPMP: Ruptura prematura de membranas en pretérmino; CAU: Catéter arteria umbilical; CVU: Catéter vena umbilical
Exposiciones y eventos perinatales
Como resultado de la fisiología renal neonatal única, un número de exposiciones maternas y eventos perinatales pueden conducir a IRA neonatal. Por ejemplo, la exposición materna a fármacos anti-inflamatorios no esteroideos predispone a los recién nacidos a oliguria e IRA. Las múltiples funciones del sistema renina-angiotensina en el desarrollo renal prenatal, así como el mantenimiento del flujo sanguíneo renal después del nacimiento, pueden conducir a una amplia gama de resultados en los recién nacidos expuestos a inhibidores de la enzima convertidora de angiotensina que van desde la agenesia renal a la IRA, dependiendo del tiempo y la duración de la exposición. Los factores de riesgo perinatales asociados con el desarrollo de IRA se esbozan en la Tabla 2 e incluyen puntajes de Apgar bajos, intubación, pH de cordón bajo, y asistolia.
Sepsis
La sepsis es una causa significativa de morbilidad y mortalidad en los recién nacidos. Se ha demostrado consistentemente que la sepsis es un factor de riesgo para el desarrollo de IRA en las poblaciones neonatales, contribuyendo en hasta un 78% de los casos de IRA. Mathur y col. describieron a 200 neonatos de término con sepsis de los cuales 52 desarrollaron IRA. Aquellos que desarrollaron IRA tenían un menor peso al nacer y eran más propensos a tener meningitis, coagulación intravascular diseminada, y shock séptico.
Se considera clásicamente que los recién nacidos que desarrollan sepsis están predispuestos a sufrir IRA secundaria a hipotensión asociada con la inflamación sistémica, pero también parece ser por impacto directo en los riñones. Además, puede desarrollarse IRA a pesar del mantenimiento de la presión arterial sistémica y del flujo sanguíneo renal, lo que sugiere que la sepsis puede dañar directamente al riñón por sus efectos sobre la microvasculatura.
Medicamentos nefrotóxicos
Los medicamentos nefrotóxicos son conocidos por ser una causa de IRA en niños críticamente enfermos y hospitalizados. La exposición a fármacos nefrotóxicos también se asocia con IRA en neonatos y puede representar un factor de riesgo modificable. La Tabla 3 ofrece una descripción de los medicamentos nefrotóxicos comúnmente utilizados en la UCIN.
En 2013, Rhone y col. evaluaron la epidemiología y el impacto de la exposición a medicamentos nefrotóxicos en 107 neonatos de muy bajo peso al nacer (MBPN). En este estudio, el 87% de los recién nacidos fueron expuestos a por lo menos un medicamento nefrotóxico y en promedio estos recién nacidos fueron expuestos a 14 días de medicamentos nefrotóxicos durante su estadía en la UCIN. Aunque este estudio representa un paso importante, la epidemiología de la exposición a medicamentos nefrotóxicos en poblaciones generales de UCIN permanece sin estudiar.
Epidemiología y resultados de la IRA neonatal:
Hubo un número de estudios de un solo centro que han evaluado el impacto de la IRA en neonatos con MBPN, neonatos con peso extremadamente bajo al nacer (PEBN), neonatos enfermos pre-término/término, recién nacidos con oxigenación por membrana extracorpórea (ECMO), y recién nacidos con asfixia que muestran que la IRA es común y que se asocia con malos resultados. En este artículo se revisan los estudios sobre IRA en algunas poblaciones de pacientes ejemplares.
Neonatos con MBPN y EBPN
Existen 3 grandes estudios de un solo centro hasta la fecha que han evaluado la IRA en neonatos de MBPN (500-1500 g). En 2011, Koralkar y col. informaron sobre 229 niños de MBPN seguidos prospectivamente desde el nacimiento hasta las 36 semanas de edad post-menstrual. La incidencia de IRA, utilizando los criterios ERMRG neonatales modificados, fue del 18%. La mortalidad en los lactantes con IRA fue significativamente mayor que en los que no tenían IRA (42% vs. 5%, P < 0,001).
Después de ajustar por potenciales factores de confusión, aquellos con IRA tenían una probabilidad significativamente mayor de muerte (Razón de riesgo 2,4; Intervalo de confianza del 95% [IC] 0,95 a 6,0; P < 0,06). Viswanathan y col. informaron hallazgos similares en un estudio retrospectivo de un solo centro, donde el 12,5% (59/472) de todos los neonatos con PEBN desarrollaron IRA y la mortalidad entre aquellos con IRA fue significativamente mayor que en los controles (70% vs. 22%, respectivamente).
En un gran estudio retrospectivo de lactantes con MBPN, Carmody y col. examinaron 455 niños con MBPN y hallaron una incidencia de IRA del 39,8%. En este estudio, la IRA se asoció independientemente con un aumento de la mortalidad (odds ratio 4,0; IC 95%: 1,4 – 11,5) y de la estadía hospitalaria (11,7 días de hospitalización, IC 95% 5,1-18,4).
Asfixia perinatal
Los lactantes con asfixia perinatal han sido reconocidos como un grupo con alto riesgo de padecer IRA. Recientemente se presentaron 2 estudios de un solo centro que examinaron la incidencia de IRA utilizando definiciones modernas. Kauret y col. reportaron una incidencia de IRA del 41,7%. Selewski y col. evaluaron recién nacidos sometidos a hipotermia terapéutica por asfixia perinatal y hallaron que 36 (38%) de 96 tenían IRA.
Incluso después de controlar importantes factores de confusión potenciales, los niños con IRA en promedio estuvieron ventilados 4 días más (P < 0,001) y hospitalizados 3,4 días más (P = 0,023). Además, estos investigadores también mostraron que la IRA durante la hipotermia terapéutica se asoció con hallazgos cerebrales anormales en la RMN a los 7 a 10 días de vida, implicando a la IRA como un marcador potencial para resultados neurológicos.
ECMO
Los neonatos apoyados con ECMO representan una población de pacientes única que es particularmente propensa a IRA en base a la gravedad de su enfermedad y a la respuesta inflamatoria que acompaña a la exposición al circuito extracorpóreo. Zwiers y col. evaluaron la IRA en 242 neonatos en ECMO durante un período de 14 años mostrando una incidencia de IRA del 64% y una mortalidad del 65% cuando la IRA progresó a su estadío mayor. Esto refleja los resultados de Gadepalli y col. en neonatos con hernia diafragmática congénita en ECMO donde la IRA se produjo en el 71% de los recién nacidos, con una mortalidad del 73% en aquellos con IRA en su forma más grave.
Cirugía Cardíaca Neonatal
La asociación de IRA y cirugía cardíaca en niños mayores ha sido bien estudiada y la asociación de IRA con una mayor mortalidad es clara. Alabbas y col. publicaron un estudio retrospectivo de 122 neonatos (28 días) con IRA en el 62% de los mismos. La fase más severa de la IRA se asoció con aumento de la mortalidad y aumento de la duración de la estadía en UCI. Estos hallazgos son similares a los resultados reportados por Blinder y col. en 430 lactantes (90 días) sometidos a cirugía cardíaca.
Tabla 3. Medicaciones nefrotóxicas frecuentes en UCIN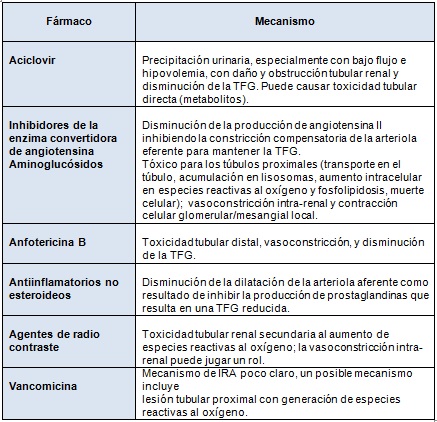
Evaluación y manejo de la ira neonatal:
La evaluación de un neonato que desarrolla IRA requiere un enfoque sistemático, que implica frecuentemente la evaluación de las causas pre-renales, intrínsecas, y post-renales. Los autores destacan los aspectos importantes de la evaluación. La historia clínica detallada debe incluir la evaluación de la edad gestacional, y de los eventos prenatales (ecografías), maternos (medicamentos nefrotóxicos), del nacimiento (monitoreo fetal de la frecuencia cardíaca y reanimación), y post-natales (medicamentos nefrotóxicos, hipotensión).
El examen físico debería centrarse en el estado de volumen y en los signos vitales. Una evaluación minuciosa del estado de volumen también requiere la evaluación de los electrolitos séricos, del balance de líquidos y, más importante, del peso corporal.
La utilización de estas 3 mediciones puede ayudar a determinar tanto la hipovolemia a partir de las pérdidas insensibles, como la hipervolemia por sobrecarga de líquidos. La evaluación de la excreción fraccional de sodio puede ayudar a diferenciar la causa de IRA pre-renal (hipovolemia) de la intrínseca (necrosis tubular aguda), aunque en los lactantes prematuros esta métrica puede no ser tan útil. Finalmente, para evaluar las potenciales causas post-renales de IRA (obstrucción), se debe realizar un ultrasonido.
Tras el diagnóstico de IRA, es importante prevenir el desarrollo de secuelas. La evaluación diaria de los medicamentos y la participación de un farmacéutico son de suma importancia en el manejo del neonato crítico para monitorear los niveles de fármaco y evitar exposiciones a nefrotóxicos cuando es clínicamente factible. La documentación estricta del ingreso y la salida de fluidos, de los electrolitos séricos, y del peso es esencial para optimizar el estado de los líquidos. El seguimiento de la sobrecarga de líquido acumulada proporciona una evaluación global del estado de los fluidos. La hipervolemia puede dictar la consulta y la intervención nefrológica.
Hay escasos datos que documenten las intervenciones que pueden prevenir la IRA en pacientes de riesgo o mejorar la IRA una vez establecida. En los recién nacidos con asfixia perinatal, los antagonistas de los receptores de adenosina (teofilina) pueden prevenir la IRA mediante la inhibición de la vasoconstricción inducida por la adenosina. Varios estudios aleatorios independientes en lactantes con asfixia han mostrado que la teofilina profiláctica, dada en forma temprana después del nacimiento, se asoció con una mejor función renal.
Como resultado, las guías ERMRG recomiendan una dosis única de teofilina para los lactantes con asfixia en riesgo de IRA. Debe tenerse precaución ya que la teofilina tiene algunos efectos neurológicos potencialmente dañinos. Otros fármacos que han sido estudiados para prevenir el desarrollo de IRA y mejorar el flujo sanguíneo renal incluyen a los agonistas dopaminérgicos (dopamina y fenoldopam). Aunque cada uno de estos agentes han mostrado beneficios promisorios en la prevención de la IRA, los estudios clínicos han sido mixtos, y no se pueden hacer recomendaciones firmes sobre su uso.
Los diuréticos se utilizan con frecuencia en pacientes con IRA con la intención de mantener la producción de orina. Estudios en poblaciones de pacientes críticamente enfermos no han demostrado un efecto beneficioso de los diuréticos sobre los resultados, y ocasionalmente han demostrado peores resultados en pacientes con IRA tratados con diuréticos. Por ejemplo, en un estudio de casos y controles retrospectivo, la bumetanida demostró mejorar la salida de orina en los lactantes PEBN con IRA a expensas del aumento de su creatinina sérica.
En otro estudio, también se demostró que la bumetanida aumenta significativamente la excreción de orina en neonatos prematuros con IRA oligúrica, pero a expensas de un aumento transitorio en la Cr. A pesar de la falta de pruebas en neonatos, se justifica un ensayo de diuréticos en recién nacidos oligúricos con IRA dada la complejidad de la terapia de reemplazo renal. Se requieren ensayos multicéntricos a gran escala de estos medicamentos en los recién nacidos.
Debido a la falta de estrategias exitosas para prevenir o mejorar la IRA, el tratamiento primario de los casos severos de IRA es la terapia de reemplazo renal. Las indicaciones para la terapia de reemplazo renal en los recién nacidos incluyen acidosis refractaria, uremia, alteraciones electrolíticas, incapacidad para proporcionar una nutrición adecuada, y sobrecarga de líquidos.
La asociación entre sobrecarga de líquidos y mortalidad en pacientes críticos es uno de los temas más candentes en la atención nefrológica aguda y merece una mención especial. Los pediatras han estado a la vanguardia en la identificación de la sobrecarga de líquidos como un factor de riesgo para mortalidad en pacientes críticamente enfermos. Esto se vislumbra por los resultados del registro prospectivo de la terapia de reemplazo renal continua pediátrica (TRRC).
Sutherland y col. mostraron en un registro prospectivo de 227 niños que estaban en TRRC que aquellos con un porcentaje de sobrecarga de líquidos < 20% al inicio de la terapia de reemplazo renal habían mejorado las tasas de sobrevida en comparación con aquellos con un balance de líquidos acumulado > 20% (46% vs. 68%, P < 0,01). Estas conclusiones ya han sido verificadas en un número de diferentes poblaciones de pacientes pediátricos destacando la importancia de la sobrecarga de líquidos y el momento de la terapia de reemplazo renal en niños críticamente enfermos.
Datos recientes extienden estos resultados a niños y adultos críticamente enfermos independientemente de la terapia de reemplazo renal. El impacto de la sobrecarga de líquidos se destaca en las directrices de práctica propuestas por el Colegio Americano de Medicina de Cuidados Críticos para el shock séptico pediátrico y neonatal, que recomiendan garantizar intervenciones para abordar el balance de fluidos cuando los niños críticamente enfermos presentan una sobrecarga de volumen ≥ 10%.
Existen datos limitados disponibles sobre la sobrecarga de fluidos en los recién nacidos. Askenazi y col. mostraron que neonatos prematuros tardíos enfermos con IRA tuvieron una mayor sobrecarga mediana de líquidos al 3º día de vida que aquellos sin IRA (+ 8,2% vs. - 4%, P < 0,001). Como la sobrecarga de líquidos es un factor de riesgo potencialmente modificable para la mortalidad, la investigación sobre su impacto en los resultados neonatales es fundamental para proporcionar información a los médicos sobre la administración de fluidos y el momento de la terapia de reemplazo renal.
A lo largo de la medicina intensiva de adultos y pediátrica, la terapia de reemplazo renal ha hecho la transición de ser un "último recurso" a convertirse en una terapia temprana dirigida a apoyar al paciente crítico mediante el mantenimiento de la homeostasis de electrolitos, lo que permite la provisión de una nutrición adecuada, y la prevención/reducción de la hipervolemia. Esta visión de la intervención temprana no ha alcanzado plenamente a la población neonatal, posiblemente debido al riesgo añadido de las máquinas de diálisis, las consideraciones éticas, y a la falta de estudios que ilustran el papel de la sobrecarga de fluidos en los pobres resultados en estos pacientes.
La terapia de reemplazo renal plantea desafíos particulares en los recién nacidos, ya que la mayoría del equipo está diseñado para niños mayores. Actualmente, la diálisis peritoneal (DP) es la modalidad de elección en los lactantes. La DP es técnicamente más fácil, ya que no hay necesidad de un acceso vascular o de un circuito de sangre extracorpóreo. Si se considera que la diálisis peritoneal va a ser un requerimiento a corto plazo, debe colocarse un catéter temporario. Varios estudios describen el éxito de la DP por varias técnicas diferentes en neonatos críticamente enfermos tan pequeños como de 830 gramos.
Cuando la DP es técnicamente difícil debido a defectos de la pared abdominal, infecciones de la piel, comunicación al espacio pleural, o necesidad de alta ultrafiltración, se puede realizar TRRC. La TRRC se realiza con un catéter de hemodiálisis colocado en una ubicación central y, bien anticoagulación regional o sistémica. El volumen del circuito extracorpóreo es particularmente crítico en la población neonatal y frecuentemente estos recién nacidos requerirán que la máquina de TRRC se cebe con sangre si el volumen del circuito excede el 10% a 15% del volumen sanguíneo total.
En los Estados Unidos, las máquinas actuales de TRRC están aprobadas sólo para los que pesan > 20 kg, pero estas máquinas se han utilizado fuera de protocolo en niños < 5 kg. Hay una serie de consideraciones cuando se evalúa la TRRC en un recién nacido, incluyendo la experiencia del centro, la prescripción, y las tasas de error de las máquinas actuales, que ha sido reconocidas y han llevado al desarrollo de máquinas para TRRC neonatal.
Los sistemas de TRRC, tales como CARPEDIEM (Bellco, Mirandola, Italia) y Nidus, están siendo utilizados en neonatos en países fuera de los Estados Unidos. Estas máquinas prometen, ya que tienen menores volúmenes extracorpóreos y son de alta precisión. A pesar de estos avances recientes, la evidencia sobre la práctica de la TRRC en los recién nacidos se limita a series de casos de un solo centro con una total falta de datos multicéntricos.
Consecuencias y seguimiento neonatal:
Anteriormente, se asumía que los que sobrevivían a un episodio de IRA recuperaban la función renal sin efectos a largo plazo. Datos recientes en animales, niños críticamente enfermos, y adultos con IRA sugieren que los sobrevivientes están en riesgo de desarrollo de ERC. Mammen y col. informaron que el 10% de los niños que desarrollaron IRA en la UCIP tuvieron TFG < 60 ml/min/1,73 m2, 1 a 3 años más tarde. Tal vez aún más alarmante fue el hallazgo de que casi el 50% de esta cohorte estaba "en riesgo" de ERC.
El papel que juega la IRA en el desarrollo de ERC en la población neonatal se desconoce. Varios informes de casos documentan que la ERC se produce en los lactantes que tuvieron IRA; sin embargo, estos estudios son reportes pequeños, retrospectivos, de un solo centro. Reconociendo las implicaciones a largo plazo de la IRA, las directrices de práctica ERMRG recientes recomiendan que todos los pacientes que experimentan IRA sean evaluados después de 3 meses para determinar la aparición o el empeoramiento de la ERC. Ellos advierten que incluso si la ERC no está presente en ese momento, las personas con IRA siguen teniendo un mayor riesgo de ERC a largo plazo.
Aunque estas recomendaciones son probablemente pertinentes a los lactantes, en la actualidad no hay suficiente evidencia firme para hacer recomendaciones oficiales sobre el seguimiento después de episodios de IRA neonatal. Los pediatras generales deben considerar a los recién nacidos que han sufrido IRA como con un aumento del riesgo y monitorear la presión sanguínea, considerando la realización de más pruebas con una base caso por caso. Grandes estudios multicéntricos longitudinales diseñados para el seguimiento de neonatos después de la enfermedad crítica son en gran medida necesarios para definir protocolos de vigilancia más apropiados, así como para identificar a las personas con mayor riesgo.
Conclusiones:
La IRA neonatal representa un área en la investigación clínica en rápida evolución, pero falta una cantidad significativa de trabajo para mejorar los resultados en estos pacientes. Un primer paso importante para avanzar es el desarrollo de una definición estandarizada de IRA. Inicialmente, la definición ERMRG modificada neonatal de IRA será utilizada como nomenclatura común para unificar y comparar la investigación en la IRA neonatal.
Aunque esta definición representa la mejor disponible, sigue estando limitada en que no ha sido sistemáticamente estudiada de una manera multicéntrica para evaluar la asociación de la IRA con los resultados. Se requiere seguir trabajando en la IRA neonatal focalizando en la definición de los factores de riesgo, las implicaciones del balance de fluidos, la terapia de reemplazo renal, y los resultados a largo plazo, incluyendo el desarrollo de ERC en esta población susceptible.
Después del taller patrocinado por el INDEDR sobre IRA neonatal, se formó un grupo internacional, multi-institucional, multidisciplinario, el Grupo de Colaboración Renal Neonatal. Este grupo tiene como objetivo responder a algunas de las preguntas que rodean a la IRA neonatal con el fin de mejorar los resultados y optimizar la atención en estos pacientes vulnerables.
Comentario
La injuria renal aguda en la población neonatal presenta ciertas particularidades con respecto a factores de riesgo, fisiología renal y adaptación a los cambios patológicos que aún no han sido completamente desarrolladas. Si bien es un área de investigación creciente, se requieren nuevos estudios que ayuden a mejorar los resultados en estos pacientes. La supervisión de los lactantes en riesgo, la detección precoz de las causas desencadenantes, el manejo clínico y terapéutico adecuado, y el seguimiento adecuado a largo plazo para prevenir y detectar el desarrollo de enfermedad renal crónica ayudarán a mejorar la sobrevida en estos pacientes vulnerables.
Resumen y comentario objetivo: Dra. María Eugenia Noguerol