|
Resumen • Las infecciones intraabdominales constituyen un grupo de procesos intra y retroperitoneales, desde cuadros localizados hasta infecciones complicadas, sepsis o shock séptico, con elevada mortalidad. • Representan la tercera causa de sepsis y la segunda causa de muerte en unidades de terapia intensiva. • El tratamiento antimicrobiano debe iniciarse lo antes posible, especialmente en pacientes en estado crítico, pero también es fundamental el procedimiento de control del foco. • Dada la importancia del tema, representantes de la Sociedad Argentina de Infectología junto con especialistas en Terapia Intensiva elaboraron estas recomenda- ciones sobre su diagnóstico, tratamiento y prevención. A tal fin, revisaron y analizaron la bibliografía publicada sobre el tema en los últimos 10 años, además de la opinión de expertos y datos locales. • El documento ofrece herramientas básicas de diagnóstico basadas en criterios clínicos y microbiológicos, orientación sobre esquemas antibióticos empíricos y dirigidos según foco de origen, lugar de adquisición (comunidad o asociadas al cuidado de la salud) y gravedad de la infección, duración del tratamiento, importancia del control del foco y medidas preventivas para reducir el riesgo de infección del sitio quirúrgico. • Asimismo, se presenta un algoritmo sencillo de diagnóstico y tratamiento para uso en la actividad asistencial. • El trabajo pone en evidencia la preocupación por el tratamiento de las infecciones intraabdominales, estableciendo pautas locales para mejorar su diagnóstico, tratamiento y prevención, con el objeto de disminuir morbimortalidad, días de internación, costos y resistencia antimicrobiana. |
El objetivo principal de este documento es establecer recomendaciones basadas en bibliografía y opinión de expertos locales sobre el diagnóstico, el tratamiento y la prevención de las infecciones intraabdominales (IIA). Es el resultado del trabajo realizado por miembros del Comité de Infecciones asociadas al Cuidado de la Salud y Segu- ridad del Paciente (IACS-SP) de la Sociedad Argentina de Infectología (SADI) y especialistas en Terapia Intensiva, sobre la temática general de abordaje de las infecciones en unidades de cuidados intensivos. El documento está estructurado de la siguiente manera:
1. Conceptos generales
2. Atención inicial: sospecha y métodos habituales de diagnóstico
3. Consideraciones generales sobre el tratamiento antibiótico
4. Tratamiento
> Tratamiento antibiótico empírico
> Tratamiento antibiótico según resultados de cultivos
> Duración
5. Pancreatitis aguda infectada
6. Conclusiones
Se realizó una búsqueda sistemática en Medline, Pubmed, Embase, LILACS, Ovid, Cochrane. Se utilizaron palabras claves, términos MESH, en idioma español-inglés en el periodo de búsqueda 2006-2018 en poblaciones de adultos. Los tipos de estudios fueron guías, revisiones sistemáticas, ensayos clínicos aleatorizados y estudios observacio- nales.
Se estableció como bibliografía principal las guías más reconocidas internacionalmente en la actualidad y se las adaptó a las características y la epidemiología de nuestras unidades críticas. Este documento forma parte de recomendaciones de la SADI, diseñadas para asistir a los médicos en el tratamiento de las IIA.
| Conceptos generales |
Las IIA constituyen un diverso grupo de procesos intra y retroperitoneales que incluyen infecciones no complicadas, en las que el evento se limita al órgano de origen y no involucra el peritoneo (apendicitis, diverticulitis, colecistitis, etc.), y complicadas, cuando se extiende al peritoneo, desencadenando cuadros generales, peritonitis difusas o localizadas, como los abscesos intraabdominales1-3.
Representan la tercera causa de sepsis luego de la neumonía y la infección urinaria y la segunda causa de muerte en unidades de terapia intensiva. Entre el 10% y el 15% de los pacientes con IIA complicadas presentan sepsis o shock séptico con elevada mortalidad (Tabla 1). La fuente de infección es colónica en el 60% de los casos, seguida por la infección apendicular, biliar y de otros órganos3.
Según su fisiopatogenia se clasifican en:
a) Peritonitis secundarias:
Se producen por extensión de un proceso intraabdominal o perforaciones del tracto gastrointestinal de origen traumático, quirúrgico, isquémico o espontáneo. La mortalidad global anual asociada oscila entre 19% (mortalidad intrahospitalaria) y 23 %, y se multiplica en presencia de sepsis o shock4,5.
b) Peritonitis terciarias:
Son infecciones difusas que recurren o persisten después de fracasar el tratamiento adecuado de una peritonitis. Indica fallo en el control del foco, fracaso del tratamiento antimicrobiano y/o de los mecanismos defensivos. Hasta en un 20% de los casos ocurre como progresión de una peritonitis secundaria (especialmente en pancreatitis necrotizantes).
Las comorbilidades y la presencia de microorganismos resistentes (MOR) son factores de riesgo para su desarrollo. Implican mayor mortalidad, estadía en unidades de terapia intensiva y disfunción de órganos.
Las IIA son usualmente polimicrobianas. El espectro de microorganismos depende del sitio del daño, lugar de adquisición y de modificaciones de la flora por la administración previa de antimicrobianos y comorbilidades.
En las perforaciones del esófago, estómago, duodeno e intestino delgado proximal predominan cocos Gram positivos aerobios, anaerobios (no productores de β lactamasas), Candida spp. y, en menor proporción, enterobacterias.
La flora colónica y del íleon terminal es predominante por la frecuencia de enfermedades focales (apendicitis, diverticulitis, etc.). Los microorganismos más frecuentes son coliformes (Escherichia coli, Klebsiella spp., Proteus spp. y Enterobacter spp.), estreptococos, enterococos, Bacteroides fragilis, Prevotella spp. y Porphyromonas spp. Se aísla Pseudomonas aeruginosa (PAE) con baja frecuencia, preferentemente en el foco apendicular6 y en pacientes neutropénicos.
Debido a su importancia para la elección del esquema empírico inicial es que las IIA se clasifican en:
• Adquiridas en la comunidad: su comienzo ocurre fuera del ámbito de cuidado de la salud e implica ausencia de riesgos de infección asociada a cuidados de la salud y de resistencia a antimicrobianos.
| Criterios de infección intraabdominal grave (uno o más de los siguientes) |
| a) Sepsis* b) Shock séptico** c) Apache II ≥ 15 d) Lactato > 2 mmol/ |
| *Sepsis (según definición consenso SEPSIS-3: infección posible, o documentada, más aumento agudo ≥ 2 puntos score SOFA): mortalidad ≥ 10%42 **Shock séptico (Sepsis con requerimiento de soporte vasopresor para mantener tensión arterial media ≥ 65 mmHg y lactato > 2 mmol/l, luego de corregir hipovolemia): mortalidad ≥ 40% |
• Asociadas al cuidado de la salud: el comienzo puede ocurrir fuera del hospital, pero se da en pacientes con factores de riesgo (procedimiento invasivo, historia de colonización/infección por MOR, cirugía, hospitalización, hemodiálisis o residencia en institución de cuidados crónicos en los últimos 12 meses).
Las infecciones intrahospitalarias aparecen después de 48 horas de internación y la mayoría se debe a infecciones postoperatorias. En estos casos predominan gérmenes resistentes y levaduras7. El uso previo de carbapenems favorece la aparición de enterobac terias productoras de carbapenemasas (KPC).
En la mayoría de las colecistitis agudas no complicadas no se aíslan microorganismos; cuando ocurre infección predominan enterobacterias y anaerobios.
En procedimientos con manipulación previa de la vía biliar (por ej: colangiopancreatografía retrógrada endoscópica) o colocación de stents, se puede aislar MOR, enterococos y anaerobios, con una elevada proporción de enterobacterias resistentes a quinolonas8. Se detecta presencia de bacterias anaerobias estrictas hasta en el 50% de los casos de colangitis, especialmente en enfermos con anastomosis biliodigestivas9.
Son predictores de mala evolución un dificultoso control de foco (peritonitis fecal o colecciones retroperitoneales) y la presencia de comorbilidades3, 10, 11.
| Atención inicial: sospecha y métodos habituales de diagnóstico |
Asociadas al cuidado de la salud: el comienzo puede ocurrir fuera del hospital, pero se da en pacientes con factores de riesgo (procedimiento invasivo, historia de colonización/infección por MOR, cirugía, hospitalización, hemodiálisis o residencia en institución de cuidados crónicos en los últimos 12 meses).
Las infecciones intrahospitalarias aparecen después de 48 horas de internación y la mayoría se debe a infecciones postoperatorias. En estos casos predominan gérmenes resistentes y levaduras7.
> Estudios a solicitar en IIA:
• De rutina: hemograma, hepatograma, urea, creatinina, amilasemia, gasometría arterial, coagulograma, radio- grafía de tórax.
• Concentración de lactato si se sospecha shock séptico.
• Hemocultivos: en IIA de la comunidad no se recomienda tomar hemocultivos en forma rutinaria3.
• Líquido abdominal durante el acto quirúrgico: es opcional en pacientes de bajo riesgo. Se debe enviar al laboratorio una muestra en tubo seco estéril y otra inoculada en un frasco de hemocultivos para aerobios3. No es necesario tomar muestra para anaerobios ya que los esquemas antibióticos recomendados cubren adecuadamente los anaerobios habitualmente presentes en las IIA de la comunidad.
• Radiografía de abdomen: permite detectar aire en cavidad, neumatosis, asas dilatadas.
• Ecografía abdominal: rápidamente disponible a la cabecera del paciente, es operador dependiente. Presenta sensibilidad y especificidad aproximadas de 83% y 93%, respectivamente.
•Tomografía axial computarizada de abdomen: Es considerada el método por imágenes de elección. Requiere traslado del paciente, no es operador dependiente. Presenta sensibilidad y especificidad de aproximadamente 94%12.
Fig. 1.– Algoritmo de diagnóstico en infecciones intraabdominales (IIA)
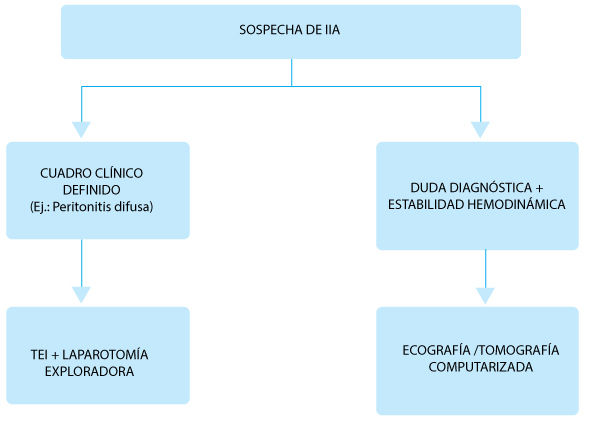
> Diagnóstico en situaciones especiales
• Apendicitis:
- Cuadro clínico, examen físico y de laboratorio: en 50% de los casos
- Ecografía: sensibilidad 44-100%; especificidad 47-99%. TAC: sensibilidad y especificidad > 99%
- La apendicectomía es el tratamiento de elección. En los EE.UU. 60% es laparoscópica
- La estrategia “antibiótico primero” se aplica solo en situaciones especiales3.
• Colecistitis aguda:
- Ecografía: sensibilidad 50-68% y especificidad 80-88%
- Criterios diagnósticos de Tokyo TG18/TG13: sensibilidad 91% y especificidad 97%14.
- Se recomienda la colecistectomía laparoscópica por sobre la colecistectomía abierta en centros con experiencia en ese tipo de procedimientos.
- Se recomienda realizar la colecistectomía precoz (< 72 horas del inicio del cuadro).
- El cirujano no debe dudar en proceder a cirugía abierta para evitar complicaciones en caso de dificultades en la realización de la colecistectomía laparoscópica15.
| Consideraciones generales del tratamiento antibiótico en IIA1,3,5,13,16,18 |
• El tratamiento empírico inicial (TEI) debe iniciarse lo antes posible ante la sospecha de IIA. En pacientes graves con shock séptico dentro de la hora del diagnóstico presuntivo2. El tratamiento antibiótico adecuado por un período adecuado reduce el riesgo de resistencia a antimicrobianos (Fig. 2).
• Deben existir niveles adecuados de antimicrobianos en el momento del procedimiento de control de foco. Puede requerir dosis adicional pre- y/o intraquirúrgica16.
• Para la elección del TEI hay que tener en cuenta el sitio de adquisición de la infección (de la comunidad vs. asociada a cuidados de la salud), sospecha de MOR, predictores de mal pronóstico, demora en la cirugía y presencia de comorbilidades.
• Procedimiento de control del foco: Se debe drenar el foco, controlar la diseminación peritoneal y restaurar la función anatómica y fisiológica todo lo posible. En la peritonitis difusa este control se debe realizar inmediatamente (Fig. 3).
• Si es posible, el drenaje percutáneo de abscesos es preferible al quirúrgico.
• En pacientes estables con buen control y tratamiento antibiótico, el control del foco podría retrasarse hasta 24 horas, solo si no se tiene acceso al procedimiento en forma inmediata.
• No se recomienda repetir la laparotomía en forma sistemática.
• Los pacientes con flemones y estricto control clínico podrían ser tratados solo con antibióticos13.
> Adquiridas en la comunidad:
a. No está indicada la realización de hemocultivos en forma rutinaria, ya que no aportan información adicional clínica- mente relevante (excepción: colangitis, colangiopancreatografía retrógrada endoscópica previa, inmunocompromiso, presencia de derivaciones biliodigestivas, alto riesgo de endocarditis)8.
b. Para pacientes de bajo riesgo, los cultivos de material quirúrgico son considerados opcionales ya que el resultado no modifica el tratamiento. Son útiles para monitorear patrones de sensibilidad antibiótica.
c. Según los resultados de un estudio multicéntrico realizado en nuestro país (2014-2015) y recientemente publicado, de las cepas de E. coli aisladas de apendicitis agudas en adultos, más del 34% eran resistentes a ampicilina/sulbactam y más del 31% resistentes a ciprofloxacina, por lo cual no recomendamos su uso en infecciones graves y/o con difícil control de foco6.
d. No se recomienda el uso rutinario de clindamicina o cefoxitina por alta tasa de resistencia del grupo Bacteroides fragilis.
e. En pacientes de alto riesgo la toma de cultivos está indicada, especialmente si recibieron antibióticos previos, en infecciones complicadas o si existe alto riesgo de infección por MOR.
f. El TEI debe cubrir bacilos Gram negativos aerobios y facultativos y estreptococos (en particular en vía biliar).
g. El tratamiento antibiótico debe cubrir anaerobios cuando la infección se origina en el intestino delgado distal, colon o perforaciones más proximales del intestino delgado en presencia de íleo u obstrucción.
h. No es necesario cubrir empíricamente Enterococcus spp. (considerar en pacientes con factores de alto riesgo para endocarditis) ni Candida spp.
i. No se recomienda el uso de betalactámicos de última generación en infecciones leves a moderadas ni de tigeciclina a fin de preservar su efectividad.
j. Dada la elevada proporción de bacilos Gram negativos sensibles a aminoglucósidos hallados en IIA en nuestro medio6, consideramos su indicación en el esquema empírico inicial de infecciones no complicadas en pacientes jóvenes con función renal normal.
k. Las IIA que no requieren cirugía de control de foco (diverticulitis o apendicitis flegmonosa) deben tratarse con los mismos antibióticos que las infecciones leves a moderadas adquiridas en la comunidad.
Fig. 2.– Algoritmo de tratamiento de infecciones intraabdominales (IIA). Tratamiento
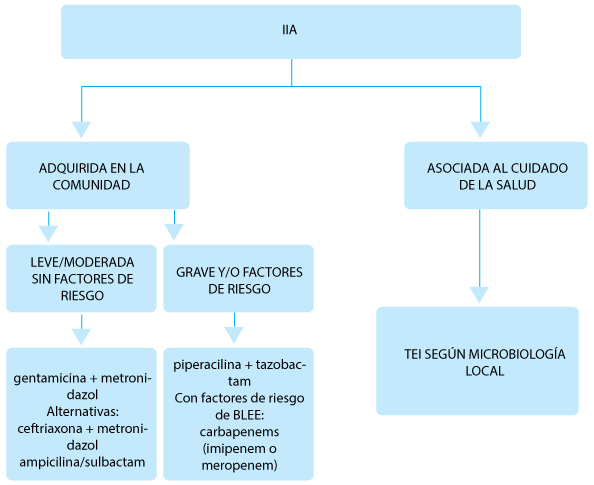
Fig. 3.– Principios de control de foco intraabdominal3
|
Pacientes con peritonitis difusa: Pacientes con abdomen abierto y contenido: Pacientes hemodinámicamente estables sin signos de disfunción orgánica: Pacientes con abscesos intraabdominales sin signos de peritonitis difusa: Pacientes con tratamiento médico y observación: |
I. La prevalencia de enterobacterias productoras de β-lactamasas de espectro extendido en IIA no excede el 10%6, motivo por el cual no está indicado el uso de betalactámicos de última generación en el tratamiento empírico de las mismas. (Fig. 4).
II. Asociadas al cuidado de la salud:
a. El tratamiento antibiótico empírico debe guiarse según patrones de sensibilidad de cada institución y debe ajustarse según resultados de cultivos
b. El tratamiento antifúngico está indicado cuando se aísla Candida de un sitio estéril. Su incidencia es mayor en perforaciones gastrointestinales por encima del ángulo de Treitz19. El fluconazol es la primera elección. Las equinocandinas están indicadas en pacientes con shock séptico y exposición reciente a azoles (30 días previos) o para cepas resistentes al fluconazol, deescalando luego de la estabilización del paciente y según sensibilidad del hongo20.
Se estima que, en Argentina, 5.4% de las cepas de Candida son resistentes a azoles18. Una revisión de siete ensayos clínicos aleatorizados sobre el impacto de diferentes estrategias de tratamiento en pacientes con candidemia o candidiasis invasivas demostró que el tratamiento con equinocandinas era un factor asociado a mayor supervivencia21.
c. Se debe cubrir enterococos cuando se los aísla en cultivos (hemocultivos o único aislamiento del sitio de infección) y se debe considerar su tratamiento en pacientes con uso previo de cefalosporinas u otros agentes que seleccionen enterococos, o en infecciones postquirúrgicas (Fig. 5).
| Tratamiento de las IIA |
> Tratamiento antibiótico empírico
El tratamiento antibiótico debe iniciarse en forma empírica lo antes posible ante la sospecha de IIA. En pacientes graves con shock séptico el tratamiento debe iniciarse idealmente dentro de la hora del diagnóstico presuntivo3.
Para la elección del tratamiento antibiótico empírico hay que tener en cuenta:
• Infección adquirida en la comunidad vs. asociada a cuidados de la salud.
• Riesgo incrementado de infección por MOR.
• Características predictoras de alto riesgo/mal pronóstico: edad > 70 años; demora > 24 horas en el control del foco; drenaje o debridamiento inadecuado; comorbilidades (HIV, neoplasia, insuficiencia renal crónica, diálisis, insuficiencia hepática, otras causas de inmunosupresión); sepsis/shock séptico; grado de compromiso peritoneal; hipoalbuminemia; desnutrición; tratamiento empírico inadecuado.
Las IIA leves/moderadas de la comunidad con buena evolución y control de foco no requieren modificación del TEI, aun si se reportara un aislamiento no sensible al esquema antibiótico empírico.
Los pacientes de alto riesgo deben recibir cobertura empírica de amplio espectro y ajustar rápidamente el tratamiento antibiótico según resultados de cultivos (de-escalamiento). La terapia empírica inadecuada en estos casos aumenta el riesgo de complicaciones y empeora el pronóstico.
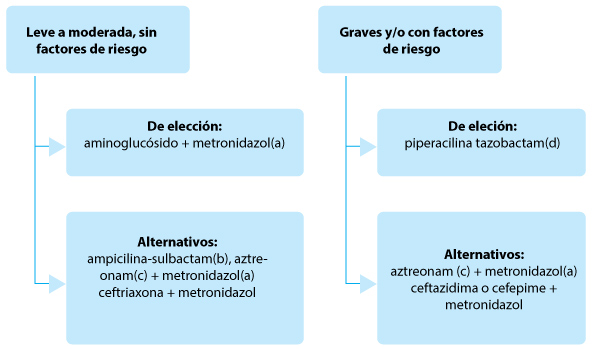
Fig. 4.– Tratamiento empírico de las infecciones intraabdominales de la comunidad
(a)Ornidazol si está disponible
(b)Si la prevalencia de MOR resistentes es < 10%
(c)Aztreoman en alérgicos a penicilina, > 65 años o insuficiencia renal
(d)Si hay riesgo de bacterias b-lactamasas de espectro extendido indicar imipenem o meropenen. Se podría continuar con piperacilina tazobactam (ver texto)
Si bien algunas guías internacionales recomiendan el uso de ertapenem en IIA de la comunidad leve/moderada, y varios estudios han demostrado una eficacia similar a la de piperacilina/tazobactam en este contexto, debido a la posibilidad de generar resistencia a carbapenems y a su elevado costo, no es conveniente usarlo como primera elección y solo se indica en casos individuales22 (Fig.2).
Con respecto al rol de nuevos antibióticos (ceftazidima/avibactam, ceftolozane/tazobactam, meropenem/varbo- bactam), deberían preservarse para pacientes colonizados/infectados con MOR, manteniendo un estricto control de su indicación, hasta tener más experiencia en su uso. Los dos primeros requieren el agregado de metronidazol.
> Tratamiento antibiótico según resultados de cultivos bacteriológicos
a. Antimicrobianos: se recomienda ajustar el esquema antibiótico a los rescates microbiológicos cuando están disponibles (incluido el pasaje a vía oral).
b. Los pacientes de bajo riesgo, con IIA adquiridas en la comunidad no requieren modificaciones en el tratamiento antibiótico si tienen una evolución clínica favorable y adecuado control de foco, aun si se aíslan MOR al TEI.
c. Cultivos con hallazgo de Staphylococcus aureus meticilino resistente (SAMR): En pacientes con IIA asociadas a cuidados de la salud, colonizados con, o con alto riesgo de infección, por SAMR, agregar vancomicina al esquema empírico23.
d. Hallazgo de MOR: en pacientes colonizados agregar aminoglucósidos, polimixina B/colistín o nuevas combi- naciones de betalactámicos (si están disponibles) al esquema empírico24.
e. Cultivo con hallazgo de enterococo vancomicina resistente: solo en trasplante hepático con IIA de origen hepatobiliar, colonizado con enterococo vancomicina resistente agregar daptomicina o linezolid25.
f. Si el paciente inició tratamiento con piperacilina/tazobactam, presenta buena evolución clínica y adecuado control de foco, ante el aislamiento de una enterobacteria productora de β-lactamasas de espectro extendido, sensible in vitro, se podría continuar con este antibiótico, ya que en recientes experiencias se ha obtenido buena respuesta a piperacilina/tazobactam en este contexto26.
> Duración de tratamiento27-29
Fig. 5.– Tratamiento empírico de las infecciones intraabdominales asociadas a cuidados de la salud con inadecuado control de foco, peritonitis terciaria27-29
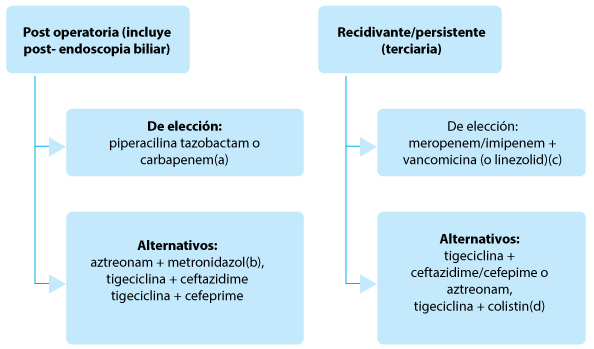
(a)Carbapenems solo si estuvieron más de 48 horas en unidades de terapia intensiva previo a la internación, o tratamiento antibiótico previo. (b)Alergia a betalactámicos. (c)Pacientes con alto riesgo de infección por SAMR. (d)Sospecha de enterobacterias productoras de carbapenemasas
A. 24 horas
• Perforación gástrica o de intestino delgado proximal tratadas dentro de las 24 horas.
• Injuria de intestino delgado distal/colon tratadas dentro de las 12 horas (incluye heridas de arma blanca y de fuego).
• Apendicitis o colecistitis no complicadas, con adecuado control de foco, no es necesario prolongar el tratamiento antibiótico en el postoperatorio30.
B. 4 a 7 días
Se recomienda una duración del tratamiento antibiótico de 4 a 7 días en pacientes con IIA complicadas (aun en presencia de sepsis o shock séptico) con adecuado control de foco.
Ensayos clínicos aleatorizados controlados no hallaron diferencias en el pronóstico de estos pacientes al comparar tratamientos cortos (4 días) vs. cursos más prolongados27- 30.
• El TEI inadecuado se asocia a mal pronóstico en infecciones graves y esto no cambia con la prolongación del antibiótico. Si los signos de infección no se resuelven se debe investigar infección persistente o infecciones asociadas a los cuidados de la salud.
• La prolongación innecesaria del tratamiento antibiótico promueve la emergencia de MOR y Clostridium difficile.
• Situaciones en las que se requiere prolongar el tratamiento antibiótico1
- Control de foco subóptimo (evaluar casos individuales, por ejemplo pancreatitis, pileflebitis, etc.).
- Pacientes con apendicitis no complicada tratados sin cirugía: 10 días de antibiótico13.
- En drenajes percutáneos, hasta drenaje efectivo de la colección (evaluar cada caso).
• Colecistitis: En relación a profilaxis antibiótica para este tipo de infección, una revisión Cochrane de 2010, con análisis de 11 estudios aleatorizados controlados en 1664 pacientes con laparoscopia electiva en pacientes de bajo riesgo, no encontró diferencias significativas al comparar profilaxis con antibiótico vs. placebo en las infecciones post-operatorias31.
• Colecistitis Grado I: Se prefiere administrar una dosis de antibiótico y definir duración de acuerdo a los hallazgos intraoperatorios. Si presentaran perforación, cambios enfisematosos y/o necrosis de la vesícula biliar se recomienda una duración de 4-7 días32.
• Colecistitis Grado II y Grado III: deben ser tratadas con antibióticos incluso luego de colecistectomía. Una vez controlada la fuente de infección se recomienda duración de 4-7 días32. Según otros autores, no existe beneficio con duración mayor a 4 días33.
• No se recomienda guiar la duración del tratamiento mediante el análisis de biomarcadores (procalcitonina, proteína C reactiva) ya que distintos estudios han mostrado resultados variables.
| Pancreatitis aguda infectada |
Debido a sus características clínicas, microbiológicas y terapéuticas particulares, se presenta como entidad separada del resto de las IIA.
La necrosis pancreática infectada es una entidad de difícil tratamiento y es la primera causa de mortalidad entre las pancreatitis agudas (30-39%). Los antibióticos profilácticos no están recomendados. Un metaanálisis publicado en 2009, que incluyó 502 pacientes, demostró que la profilaxis antibiótica en la pancreatitis aguda grave no reduce la mortalidad ni protege contra la infección de la necrosis o la intervención quirúrgica34.
Guías de la Asociación Americana de Gastroenterología recientemente publicadas desaconsejan el uso de antibióticos profilácticos en estas circunstancias35.
Los gérmenes causales son E. coli, Bacteroides spp, Enterobacter spp, Klebsiella spp, Enterococcus faecalis, Staphylococcus epidermidis y Staphylococcus aureus.
Los antibióticos de elección son los que tienen buena penetración en el tejido pancreático: imipenem, ciprofloxacina, ofloxacina y moxifloxacina.
La tomografía axial computarizada con contraste es el gold standard para evaluar la extensión de la necrosis del páncreas y se correlaciona con el riesgo de infección de la misma. Para alcanzar una adecuada caracterización, este estudio debe realizarse 72 horas después del comienzo de los síntomas.
Los pacientes con necrosis sin infección se controlan con estrategias conservadoras.
Se sospecha necrosis pancreática infectada en pacientes inestables, con sepsis sin foco identificado. Para alcanzar el diagnóstico bacteriológico podemos recurrir a la punción- aspiración del material necrótico con aguja y en la tomografía se puede visualizar gas en la colección. Si el área de necrosis está infectada, se indica antibióticos mientras se espera el resultado de los cultivos y se ajustan los mismos de acuerdo con el resultado bacteriológico.
Las colecciones pancreáticas infectadas se deben drenar. Las técnicas disponibles son:
• Drenaje percutáneo. Es el método de elección, ya sea para las colecciones agudas o crónicas.
• Drenaje por vía laparoscópica. Cuando la necrosis es extensa y contiene material purulento y sólido y el drenaje percutáneo puede resultar insuficiente.
• Estrategia combinada: punción percutánea y el drenaje transgástrico, con lavado continuo.
• Necrosectomía transgástrica guiada por endoscopia.
Para este tipo de situaciones las terapéuticas mínimamente invasivas son de elección. La mortalidad es menor con estos procedimientos comparada con la cirugía (18.8 vs. 30.8%)36. Otros autores, si bien no han demostrado reducción en la mortalidad con la necrosectomía endoscópica, observaron una reducción en la tasa de fístulas pancreáticas y en la duración de la estadía hospitalaria37.
Se sugiere evitar la necrosectomía temprana ya que incrementa la mortalidad38. Si el paciente no mejora o tiene otras complicaciones, la cirugía a cielo abierto es el paso siguiente39-41. Las complicaciones descriptas son las fistulas pancreáticas, recidivas de las colecciones líquidas y los pseudoquistes que se presentan en 50%-60% de los casos.
|
Conclusión • Las IIA representan la tercera causa de sepsis y la segunda causa de muerte en unidades de terapia intensiva. Entre 10% y 15% de los pacientes con IIA complicadas presentan sepsis o shock séptico, con elevado riesgo de mortalidad. • El espectro de microorganismos depende del sitio de origen del daño, del lugar de adquisición, de las posibles modificaciones de la flora (administración previa de antimicrobianos) y de las comorbilidades. • Para pacientes de bajo riesgo, los cultivos de material quirúrgico se consideran opcionales ya que el resultado no afecta el tratamiento. • En pacientes de alto riesgo está indicada la toma de cultivos, especialmente si recibieron antibióticos previamente, en infecciones complicadas o si presentan alto riesgo de infección por MOR. • Es fundamental el procedimiento de control del foco: debe drenar, controlar la diseminación peritoneal y restaurar la función tanto como sea posible. • No se recomienda el uso rutinario de ciprofloxacina ni de ampicilina/sulbactam por la alta tasa de resistencia de E. coli, ni clindamicina o cefoxitina, por alta tasa de resistencia del grupo Bacteroides fragilis. • No se recomienda el uso de betalactámicos de última generación en infecciones leves a moderadas, ni de tigeciclina para preservar su efectividad. • En infecciones de la comunidad, no se recomienda prolongar la indicación de antibióticos más de 4-7 días excepto si presentan colecciones retroperitoneales o pileflebitis. • Dada la elevada proporción de bacilos Gram negativos sensibles a aminoglucósidos hallados en IIA en nuestro medio, consideramos su indicación en el esquema empírico inicial en infecciones no complicadas en pacientes jóvenes, con función renal normal. |
 |
Usted puede ingresar a todos los artículos del número de la revista: Medicina Bs. As. Volumen 78 Año 2018 – Nº 6 - Noviembre Diciembre -Índice |