| Aspectos destacados |
|
- La cardio-oncología es una disciplina emergente que implica un espectro clínico de problemas cardiovasculares que pueden surgir durante, inmediatamente después o mucho tiempo posterior al tratamiento del cáncer. - La toxicidad cardiovascular (TCV) puede afectar a cualquier componente estructural del sistema cardiovascular, pero los agentes terapéuticos pueden tener un objetivo predominante. - Los objetivos son detectar y gestionar las consecuencias de la TCV y considerar estrategias cardioprotectoras para mitigar el daño y evitar la suspensión de la terapia contra el cáncer. - A menudo se requiere un seguimiento a largo plazo porque la TCV puede aparecer años después, como se observa con la radioterapia torácica. |
| Introducción |
Durante la última década, con la aparición de tratamientos contra el cáncer innovadores y más eficaces, la supervivencia ha aumentado. La mayoría de las enfermedades oncológicas ocurren en pacientes del mismo grupo de edad que los pacientes con enfermedades cardiovasculares (ECV) porque dichos pacientes comparten perfiles de factores de riesgo similares.
La cardio-oncología es una disciplina en la que la atención a pacientes con ECV preexistente o aquellos que desarrollan toxicidad cardiovascular (TCV) es brindada por un equipo multidisciplinario compuesto por cardiólogos, oncólogos, hematólogos, estudiantes, enfermeras especialistas, fisiólogos y farmacéuticos con el apoyo de médicos de cabecera. Varias directrices y declaraciones de consenso de sociedades internacionales están disponibles para asesorar a los profesionales.
| Toxicidad cardiovascular relacionada con el tratamiento del cáncer |
Aunque la definición clásica de cardiotoxicidad se ha centrado en la disfunción sistólica del ventrículo izquierdo (VI), descripciones recientes destacan la lesión cardíaca directa a cualquiera de los componentes del sistema cardiovascular, con el potencial de causar miocardiopatía e insuficiencia cardíaca, miocarditis, toxicidades vasculares, arritmias, enfermedad de las arterias coronarias, trastornos valvulares prematuros, hipertensión y tromboembolismo.
Se puede desarrollar una toxicidad indirecta a través de efectos sobre la tiroides, las glándulas suprarrenales, pituitaria, páncreas y vasculatura pulmonar, con consecuencias posteriores sobre el sistema cardiovascular.
Los tres escenarios clínicos diferentes incluyen TCV aguda, definida mientras se recibe tratamiento contra el cáncer; toxicidad subaguda, durante los primeros 12 meses después de completar los tratamientos cardiotóxicos y a largo plazo, más de 12 meses: complicaciones cardiovasculares de tratamientos oncológicos previos Las causas más frecuentes de TCV relacionada con el tratamiento del cáncer se resumen en la figura 1.
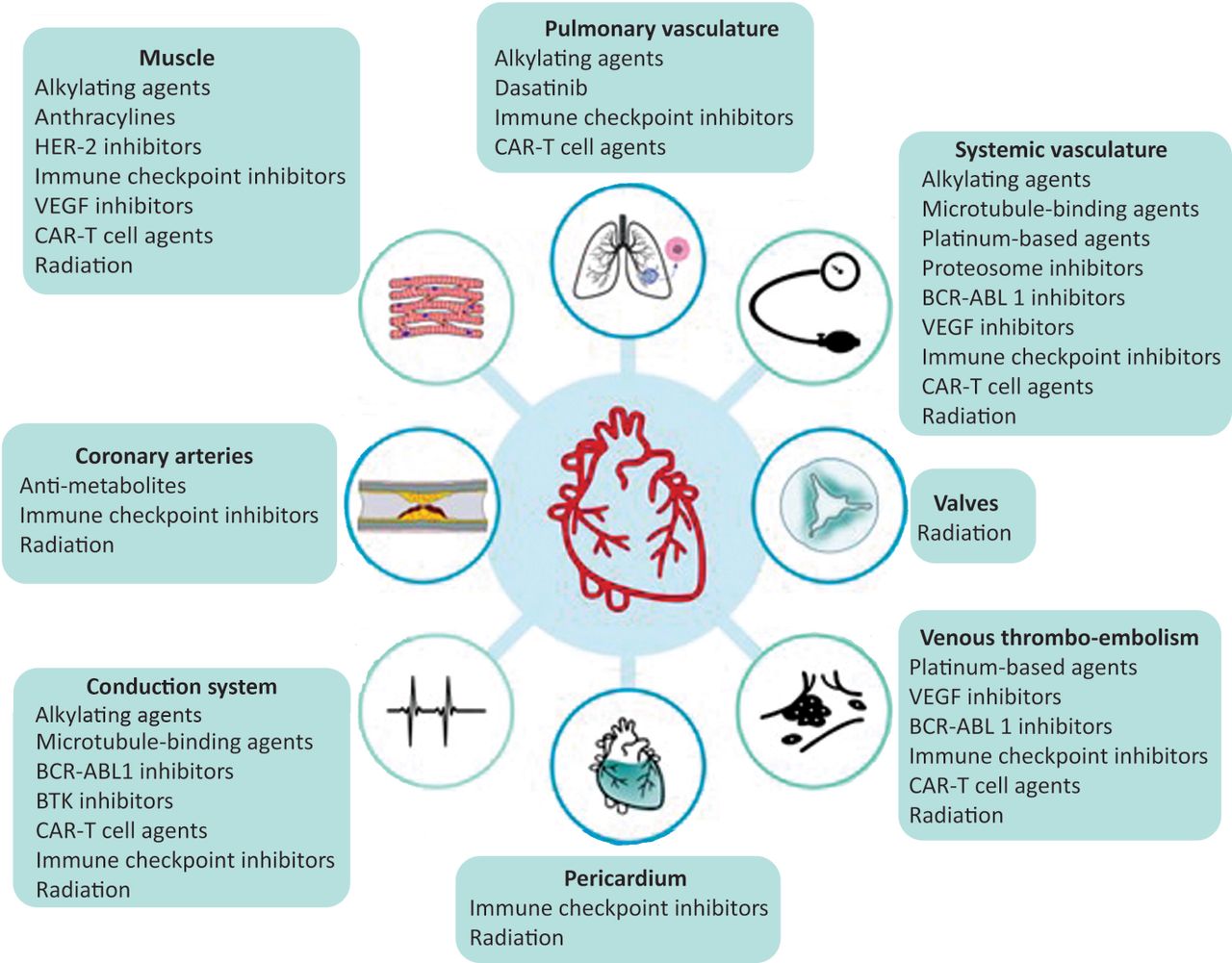
Fig 1. Toxicidad cardiovascular (TVC) relacionada con el tratamiento del cáncer. A pesar de que cada clase terapéutica tiene el potencial de causar múltiples TCV, algunos fármacos oncológicos tienen predilección por ciertos componentes del sistema cardiovascular. Las quimioterapias convencionales más comunes son agentes alquilantes (p. ej., ciclofosfamida), antraciclinas (p. ej., doxorrubicina y epirrubicina), antimetabolitos (p. ej., 5- fluorouracilo (5-FU) y capecitabina), agentes de unión a microtúbulos (p. ej., paclitaxel y docetaxel) y a base de platino (por ejemplo, cisplatino). Las terapias diana utilizadas con mayor frecuencia son los inhibidores del receptor 2 del factor de crecimiento epidérmico humano (HER-2) (p. ej., trastuzumab y pertuzumab), inhibidores del proteosoma (p. ej., bortezomib y carfilzomib), inhibidores del factor de crecimiento endotelial vascular (VEGF) (p. ej., bevacizumab y sunitinib), inhibidores de BCR-ABL1 (p. ej., dasatinib, nilotinib y ponatinib) e inhibidores de la tirosina quinasa de Bruton (BTK) (p. ej., ibrutinib y acalabrutinib). Las inmunoterapias más recientes incluyen inhibidores de puntos de control inmunológico (p. ej., pembrolizumab, nivolumab y atezolizumab) y terapia con células T con receptor de antígeno quimérico (CAR). Los efectos secundarios de la radiación suelen ocurrir años o incluso décadas después de la exposición y pueden afectar cualquier estructura cardiovascular.
| Trayectoria clínica del paciente de cardio-oncología |
> Evaluación basal de estratificación del riesgo cardiovascular
La evaluación clínica inicial de factores de riesgo cardiovascular, antecedentes de ECV y terapias cardiotóxicas, examen físico, electrocardiograma y análisis de laboratorio son obligatorios (figura 2). Aunque la ecocardiografía es la modalidad de imagen de referencia preferida, también pueden ser necesarias la resonancia magnética cardíaca (RMC) y la tomografía computarizada (TC) cardíaca.
En la primera consulta con un cardiooncólogo se formula una estrategia personalizada de vigilancia y prevención cardíaca, basada en el riesgo inicial de TCV, el tipo y estadio del cáncer y la terapia oncológica propuesta. Las estrategias de prevención incluyen medidas para optimizar las opciones de estilo de vida y mitigar los factores de riesgo cardiovascular tradicionales.
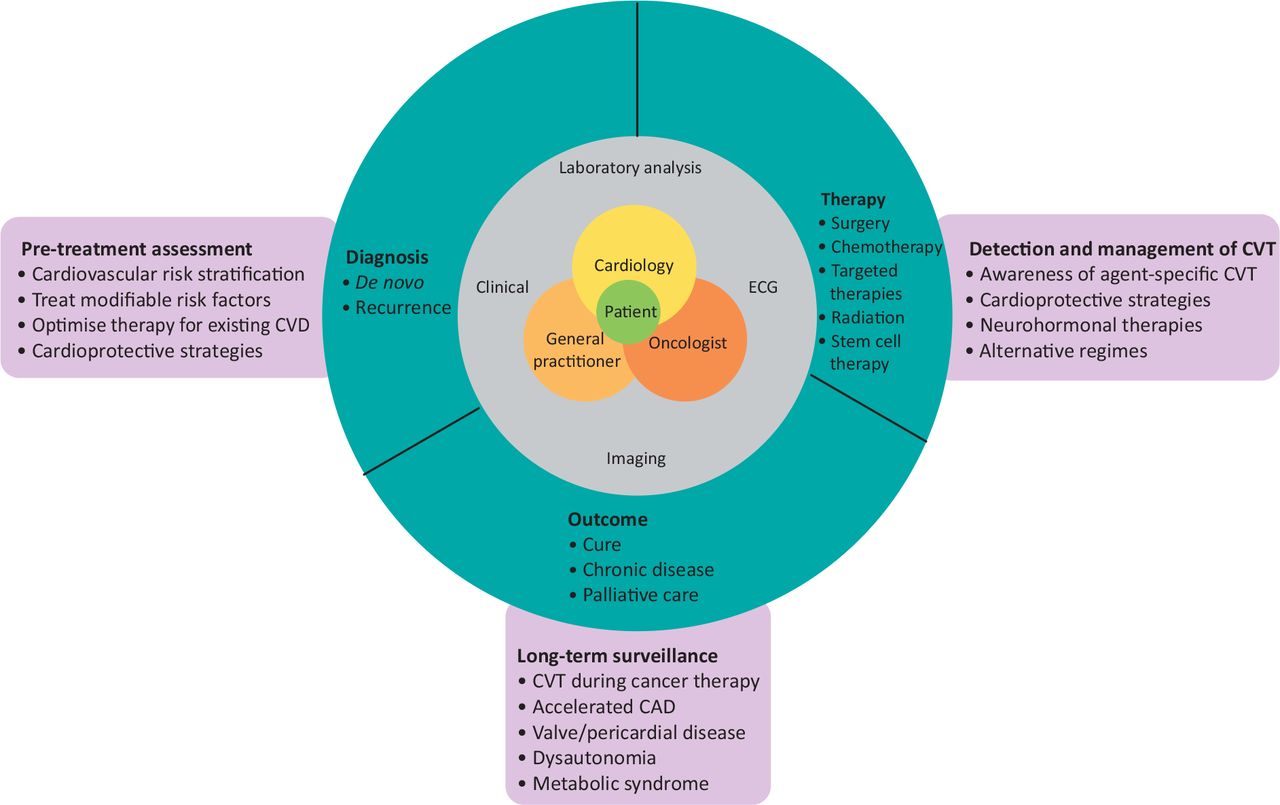
Fig 2. Trayectoria clínica del paciente de cardiooncología. El equipo multidisciplinario realiza un seguimiento del paciente en el centro después del diagnóstico y durante la terapia del cáncer. Ha habido un cambio de paradigma en el cáncer como enfermedad crónica, porque algunos cánceres tienen secuelas incluso cuando se consideran curados. La evaluación cardiovascular previa al tratamiento, la detección y el tratamiento de la TCV y la vigilancia de los supervivientes con mayor riesgo de enfermedad cardiovascular (ECV) son funciones clave de un cardiooncólogo. CAD = enfermedad de las arterias coronarias; ECG = electrocardiograma.
> Diagnóstico y seguimiento de la TCV
Se recomiendan evaluaciones clínicas y exámenes físicos regulares durante el tratamiento del cáncer para detectar síntomas y signos tempranos de TCV. Se requieren electrocardiogramas en pacientes con riesgo de arritmias cardíacas. Los biomarcadores séricos cardíacos, como los péptidos natriuréticos y la troponina cardíaca, pueden ser útiles para monitorear la TCV.
La ecocardiografía puede detectar el deterioro de la función del VI mediante la medición de la fracción de eyección con técnicas convencionales o ecocardiografía 3D. La RMC en pacientes con mala calidad de imagen o cuando el ecocardiograma no es diagnóstico puede detectar cambios tanto funcionales como estructurales valorando la función y estructura cardíaca. Sin embargo, este estudio está limitado por su disponibilidad y costo.
La TC cardíaca se puede utilizar para evaluar las arterias coronarias para excluir síndromes coronarios agudos y evaluar masas cardíacas. En algunos casos, es posible que se requiera una angiografía coronaria para visualizar directamente las arterias coronarias.
| Gestión de TCV |
> Disfunción cardíaca relacionada con el tratamiento del cáncer
La disfunción cardíaca relacionada con el tratamiento del cáncer (CTRCD, por sus siglas en inglés) podría presentarse clínicamente o detectarse en pacientes asintomáticos durante la vigilancia. Se recomienda la interrupción temporal del tratamiento en pacientes que desarrollan CTRCD de moderada a grave y se puede considerar una nueva exposición, utilizando estrategias cardioprotectoras con una estrecha monitorización.
Las estrategias cardioprotectoras incluyen minimizar la dosis del fármaco y, en el caso de antraciclina, cambiar a preparaciones de antraciclina liposomal o pretratamiento con dexrazoxano antes de cada ciclo adicional. Se recomienda el tratamiento de la insuficiencia cardiaca según las directrices en pacientes que desarrollan TCV sintomática o CTRCD de moderada a grave.
Son recomendaciones el uso de un inhibidor de la enzima convertidora de angiotensina/bloqueador del receptor de angiotensina II (IECA/BRA) o un inhibidor del receptor de angiotensina-neprilisina (ARNI), un betabloqueante, un antagonista del receptor de mineralocorticoides (ARM), y se recomienda un inhibidor del cotransportador 2 de sodio-glucosa (SGLT2i), con ajuste ascendente hasta las dosis deseadas según la tolerancia.
> Miocarditis
La miocarditis es una complicación rara pero grave, caracterizada por síntomas cardiovasculares severos, un aumento de la troponina y anomalías electrocardiográficas (trastornos de la conducción auriculoventricular o ventricular, bradicardia y taquiarritmias). Se debe iniciar rápidamente el tratamiento con dosis altas de metilprednisolona en pacientes hemodinámicamente inestables, mientras se esperan pruebas adicionales de confirmación con ecocardiograma y RMC.
> Síndrome coronario agudo
El diagnóstico del síndrome coronario agudo (SCA) se basa en los mismos principios que en pacientes sin cáncer, incluidos los síntomas, un electrocardiograma temprano de 12 derivaciones y mediciones seriadas de troponina. Algunos agentes, como las fluoropirimidinas, pueden inducir vasoespasmo coronario e isquemia miocárdica en reposo varios días después de su administración
> Arritmias
La quimioterapia, radioterapia, cirugía oncológica, cáncer en sí (invasión), alteraciones electrolíticas relacionadas o preexistentes, pueden aumentar el riesgo de arritmias. La fibrilación auricular es la arritmia más prevalente y la relación riesgo-beneficio de la anticoagulación a largo plazo en pacientes con cáncer es una preocupación importante.
Las arritmias ventriculares inducidas por la terapia contra el cáncer son raras y están relacionadas con una prolongación del intervalo QT. Son esenciales la retirada inmediata de cualquier fármaco que prolongue el intervalo QT, la corrección de las anomalías electrolíticas y una estrecha monitorización electrocardiográfica.
> Hipertensión arterial
La hipertensión arterial en pacientes con cáncer puede ser causada por sus tratamientos oncológicos, fármacos no oncológicos y otros factores, como el estrés, el dolor, la insuficiencia renal o trastornos metabólicos. Dados sus efectos cardioprotectores bien establecidos, los IECA o los BRA son terapias de primera línea en este contexto.
> Enfermedad de las arterias coronarias, válvulas y pericardio inducida por radiación
Muchos años después de la radioterapia, se pueden detectar daños en las arterias coronarias, las válvulas cardíacas y el pericardio, especialmente si las cámaras cardíacas se encuentran en el campo de la terapia. Se debe utilizar modulación de dosis y protección torácica adecuada.
> Masas cardíacas e infiltración
Tanto la RMC como la TC pueden ayudar a diferenciar entre un tumor y un trombo en las cámaras cardíacas. Gracias a su capacidad para identificar la actividad metabólica, la tomografía por emisión de positrones (PET) puede ayudar a reconocer tumores primarios y secundarios
| Seguimiento de los supervivientes a largo plazo después del tratamiento: efectos tardíos |
En el primer año después del tratamiento, se debe realizar una evaluación del riesgo de TCV para establecer un plan de seguimiento a largo plazo.
Se requiere una estrategia de vigilancia de los supervivientes a largo plazo para identificar a aquellos con alto riesgo de desarrollar efectos tardíos, en particular los pacientes que han recibido dosis altas de doxorrubicina y radiación previa.
La rehabilitación cardíaca para quienes tienen deterioro funcional también es importante.
| Conclusiones |
La cardio-oncología se ha convertido en una nueva subespecialidad durante la última década, con la expansión de varias unidades integrales y multidisciplinarias. El valor proporcionado por los cardio-oncólogos incluye el desarrollo de estrategias de manejo personalizadas para pacientes con cáncer a pesar de la base de evidencia limitada, aunque creciente.
Se requiere un interés continuo por parte de oncólogos y cardiólogos para establecer nuevos servicios y para que los actuales se desarrollen aún más. Para mejorar los resultados cardiovasculares y del cáncer, los médicos de cabecera y los médicos generales deben ser conscientes de la amplia variedad de posibles inconvenientes. En última instancia, si todos los hospitales tienen referentes locales de cardio-oncología, esto será un gran paso adelante en el tratamiento de la TC.
Traducción, resumen y comentario objetivo: Dr. Esteban Crosio