Introducción
Los tumores del cuerpo carotídeo (TCC) pertenecen a la clasificación de parangangliomas porque se originan de paranganglios en células cromafines negativas del glomus derivados de la cresta neural embrionaria, funcionando como parte del sistema nervioso simpático (una rama del sistema nervioso autónomo). Esas células actúan normalmente como quimiorreceptores especiales localizados a lo largo de los vasos sanguíneos, particularmente en los cuerpos carotídeos (en la bifurcación de la arteria carótida común en el cuello) y en los cuerpos aórticos (cerca del arco aórtico).
En consecuencia, los TCC y otros paragangliomas son categorizados como originándose de la línea celular neural, en la clasificación de la Organización Mundial de la Salud de tumores neuroendócrinos. En la clasificación propuesta por Wick [1], los paragangliomas pertenecen al grupo II. Dado el hecho de que se originan de células del sistema ortosimpático, los paragangliomas están estrechamente relacionados con los feocromocitomas, que son cromafines positivos. El tumor mejor conocido del glomus carotídeo es el TCC.
Los paragangliomas del cuerpo carotídeo son más comunes en las mujeres [2-9]. La incidencia de lesiones bilaterales del cuerpo carotídeo es aproximadamente del 10%. La mayoría de esas lesiones son benignas; no obstante, frecuentemente presentan una conducta maligna. Para el diagnóstico de los paragangliomas malignos del cuerpo carotídeo, no hay características histológicas claras que los diferencien de las lesiones benignas. Ese diagnóstico se reserva para los tumores con metástasis locales, regionales y a distancia. Se reporta una tasa de malignidad del 6% al 12,5% de todos los casos [2-4,10-18]; 7% al 9% de los casos son hereditarios [1,3,5-9,19].
En 1742, von Haller describió el cuerpo carotídeo como una estructura similar a un cuerpo globular situada justo por debajo de la bifurcación carotídea [20]. Reigner fue el primero que intentó la resección de un paraganglioma del cuerpo carotídeo en 1880, pero el paciente no sobrevivió. Maydel fue el primero en remover exitosamente un paraganglioma del cuerpo carotídeo en 1886, pero el paciente quedó afásico y hemipléjico a causa de la ligadura de la arteria carótida interna (ACI) [21]. En 1903, Scudder efectuó la primera remoción exitosa de un paraganglioma del cuerpo carotídeo.
La cirugía del TCC sigue siendo un reto para los cirujanos, a causa de la localización del tumor en la vecindad de vasos sanguíneos y nervios craneales importantes. Debido al deterioro preoperatorio de la función nerviosa, la cirugía puede resultar en déficit de los nervios craneales VII, VIII, IX, X, XI y XII [23-25]. El objetivo de este estudio fue brindar un breve resumen actualizado de los TCC y presentar la experiencia de los autores con 34 tumores que fueron explorados quirúrgicamente.
Métodos
Después de la aprobación del comité institucional de revisión, un estudio retrospectivo identificó 34 tumores en pacientes que fueron sometidos a resección quirúrgica de TCC, confirmados anatomopatológicamente, sobre un período de 10 años, desde 2001 hasta 2011, en Italia. Los pacientes fueron 12 hombres (1 caso bilateral) y 19 mujeres (2 casos bilaterales) y sus edades fueron desde los 39 hasta los 67 años (mediana = 48 años) (Tabla 1).
• TABLA 1: Presentación clínica de 34 casos de TCC
Todos los tumores fueron completamente resecados de acuerdo con la técnica siguiente. Se usó un abordaje transcervical, con extensión post aural en 1 de los casos. Después de la elevación del colgajo, se realizó el control proximal y distal de los vasos en la vaina carotídea, mediante una exposición adecuada, colocando lazadas. La arteria faríngea ascendente, que es el vaso nutricio más común, y otros vasos nutricios fueron ligados. Los tumores fueron luego circunscriptos y cuidadosamente disecados por un plano periadventicial, usando cauterio bipolar y un bisturí de radiofrecuencia, evitando lesionar la pared vascular (Fig. 1). Luego se liberó a los tumores de sus fijaciones a los tejidos circundantes. La carótida fue recubierta con fascia temporal en todos los casos.
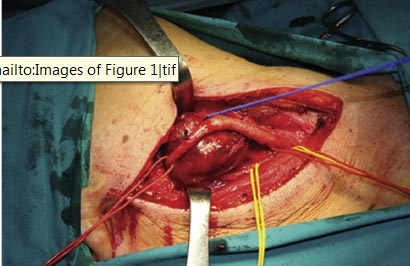
FIGURA 1: Caso de un TCC Shamblin II: el tumor rodea parcialmente a las arterias carótida interna y externa. Se requirió una cuidadosa disección por el plano periadventicial.
Los autores de este trabajo efectuaron una revisión de los registros médicos enfocados en la evaluación preoperatoria, incluyendo una historia completa y examen físico, con revisación de los nervios craneales y una investigación intra y postoperatoria, enfocada sobre los sangrados arteriales y déficit de nervios craneales. Los datos sobre los resultados fueron recolectados al mes y al año del postoperatorio.
Una revisión de los partes quirúrgicos se enfocó sobre el sacrificio de los nervios craneales y el compromiso carotídeo, definido por su sacrificio o puenteo. Los reportes anatomopatológicos fueron analizados en búsqueda de la presencia de enfermedad metastásica y características de infiltración local, definidas por el compromiso del hueso circundante, tejido conectivo, vasos sanguíneos o nervios.
El objetivo final primario fue el resultado funcional, definido por la incidencia de accidentes vasculares cerebrales. Los objetivos finales secundarios incluyeron la incidencia de neuropatías craneanas postoperatorias, hallazgos patológicos tales como potenciales factores pronósticos para la morbilidad y el impacto a largo plazo de las neuropatías craneanas preoperatorias sobre el resultado funcional.
La evaluación neurológica y el resultado funcional fueron efectuados utilizando la National Institutes of Health Stroke Scale [26], para todos los pacientes, en la primera semana del período postoperatorio, aún si no presentaban un déficit neurológico detectable. En este estudio, la calidad de vida relacionada con la salud, fue determinada empleando el Sickness Impact Profile (SIP) [27]. Las estadísticas descriptivas son reportadas como números y porcentajes.
Resultados
Doce tumores (35%) estaban localizados sobre el lado derecho y 21 (64%) sobre el izquierdo. Un paraganglioma multicéntrico, no de la cabeza y cuello, fue descubierto en 2 pacientes (7%) que tenían un paraganglioma torácico y paravesical. Ningún paciente tuvo antecedentes familiares de paragangliomas. El síntoma más común fue una masa pulsátil en el cuello sin déficit de nervios craneales. Ningún paciente tuvo un TCC funcionante, que se presentara con palpitaciones, taquicardia e hipertensión, acompañando un nivel elevado de catecolaminas. La disfunción preoperatoria del nervio craneano X fue observada en 1 paciente (3%).
La tomografía computada (TC) y la resonancia magnética nuclear (RMN) mostraron una masa aumentada estirando la ACI y la arteria carótida externa (ACE) de la bifurcación carotídea y un tamaño medio en los 34 tumores de 3,8 cm (rango: 2,2 a 6,8). Diez tumores (29%) fueron Shamblin clase I, 13 (38%) fueron clase II, y 9 (26%) fueron clase III. La arteria faríngea ascendente fue la mayor arteria nutricia en todos los tumores.
Asumiendo que las clases I y II de Shamblin representan las categorías de menor complejidad, fueron comparadas como una única categoría (sólo en esa comparación hubo un valor de P significativo). De acuerdo con la clasificación de Shamblin, la mediana del tamaño del tumor fue de 2,4 cm (rango: 2,2 a 3,4) en los tumores Shamblin I y II, y de 4,7 cm (rango: 3,2 a 6,8) en los tumores Shamblin III (P = 0,005).
La mediana de la pérdida de sangre intraoperatoria fue 140 mL (rango: 80 a 250) en los tumores Shamblin I y II y de 450 mL (rango: 300 a 750) en los tumores Shamblin III (P = 0,003); la mediana de la duración operatoria, incluyendo el tiempo de reconstrucción de la ACI, fue de 180 minutos (rango: 150 a 320) y de 250 minutos (rango: 220 a 440), respectivamente (P = 0,019). La duración de la estadía hospitalaria fue de 7 días en todos los grupos (Tabla 2).
• TABLA 2: Registros operatorios de los tumores de acuerdo con la clase Shamblin
Hubo 1 solo caso de hemorragia en donde una masa de 34 x 65 mm en la bifurcación de la arteria carótida, vista en la RMN, estaba fijada a la ACI con áreas múltiples de hemorragia y degeneración quística. El nervio laríngeo superior y sus ramas (el nervio laríngeo externo, que es la más pequeña y externa, y el nervio laríngeo interno, que es la rama más grande e interna), el vago, la cadena simpática y los nervios hipoglosos, fueron preservados en todos los casos excepto 1, en donde el tumor estaba adherido al nervio hipogloso y, en consecuencia, tuvo que ser sacrificado. En 1 caso de un tumor Shamblin III, en el que el tumor invadía las paredes internas de la ACE, la arteria fue ligada y resecada con el tumor. Se halló un tumor Shamblin III grande que se extendía hacia arriba dentro de la fosa infratemporal; fue abordado utilizando un acceso transmandibular a la fosa infratemporal.
La ACE fue ligada en 4 pacientes (4:31; 12%) durante la operación: 1 paciente pertenecía al grupo Shamblin II y 3 al grupo Shamblin III. Después de la resección tumoral, se repararon primariamente pequeños desgarros en la ACI en 2 pacientes (2:31; 6%), que pertenecían al grupo Shamblin II y III, respectivamente. Una porción de la ACI tuvo que ser resecada en 1 paciente perteneciente al grupo Shamblin III (1:9; 11%). En el caso con resección de la ACI se efectuó una interposición con un injerto de politetrafluoroetileno (PTFE) (Tabla 3).
• TABLA 3: Complicaciones neurovasculares de acuerdo con la clase Shamblin
Dos pacientes (2:31; 6%) (1 con reparación directa de la ACI y 1 con reparación con injerto de la ACI) tuvieron isquemia cerebral transitoria inmediatamente después de la operación, la que probablemente estuvo asociada con la manipulación de la ACI durante la reconstrucción vascular. En efecto, en esos 2 casos fue necesario el uso de una derivación vascular con resección y reconstrucción de la ACI, a causa de un tamaño muy grande del tumor y el estrecho espacio operatorio, generando dificultad para la resección tumoral. De hecho, mediante el uso de la derivación, se aclaró la dirección de la ACI y las estructuras nerviosas craneanas fueron más evidentes.
En esos 2 pacientes, la isquemia cerebral transitoria se manifestó en ambos con parálisis contralateral y disartria, que se resolvió en 24 horas. No se notaron alteraciones adicionales en la evaluación neurológica ni en las escalas del SIP durante el seguimiento alejado. Un paciente adicional (1:31; 3%) falleció por isquemia cerebral postoperatoria, después de ser sometido a cirugía por trombosis de la ACI. En ese caso, se efectuó una plicatura transversa posterior durante la reconstrucción de la ACI. Todas esas complicaciones fueron observadas en el grupo Shamblin III.
Se desarrollaron déficits postoperatorios de los nervios craneales en 8 pacientes (8:31; 26%) inmediatamente después de la cirugía, que pertenecían a los grupos Shamblin II (3:12; 25%) y Shamblin III (5:9; 55%) (P = 0,03). Incluyeron déficit en 6 nervios craneales X, 1 nervio craneal XI y 1 nervio laríngeo superior. Tres de ellos, que habían tenido déficit del nervio craneal X, se recuperaron dentro de los 12 meses y el déficit postoperatorio del nervio craneal X permanente ocurrió en 3 pacientes (9%). Un paciente (3%), que presentaba disfunción preoperatoria del nervio craneal X, mostró parálisis permanente de la cuerda vocal y fue sometido a una laringoplastia de medialización.
Los exámenes anatomopatológicos de todos los tumores revelaron histología benigna en los paragangliomas sin casos de TCC malignos. Los TCC descritos en esta serie tuvieron una apariencia histopatológica similar.
Bajo el microscopio, se observaron los 2 tipos de células mostrando los patrones arquitectónicos en nido o alveolar típicos. Las células Tipo I, o células principales, son células epitelioides, frecuentemente con núcleos hipercromáticos agrandados y dispuestas en grupos sólidos denominados “Zellballen”. Esos grupos de células principales estaban rodeados por una capa aplanada de células Tipo II o células de sostén, que fueron visualizadas mediante tinción inmunohistoquímica para proteína S-100 de células tipo I y II, ubicadas característicamente dentro de una red densa de capilares [28]. Las células principales eran bastante uniformes o presentaron un pleomorfismo nuclear pronunciado, tal como extrañas y enormes células multinucleadas. Las mismas fueron inmunohistoquímicamente positivas para cromograninas. No hubo recidivas o complicaciones tardías durante el seguimiento con una mediana de 44 meses.
Comentarios
Los TCC son usualmente clasificados utilizando los criterios descritos por Shamblin (Tabla 4) [29]. Los TCC clase I de Shamblin son tumores localizados con estiramiento de la bifurcación carotídea pero con poca fijación a los vasos carotídeos. La resección quirúrgica completa es generalmente posible, con un riesgo mínimo de complicaciones vasculares o de los nervios craneales [23]. Los TCC clase II rodean parcialmente a los vasos carotídeos y su extracción completa es más desafiante.
Los TCC clase III de Shamblin rodean íntimamente a la carótida. La resección completa es muy desafiante y a menudo requiere interrupción temporaria de la circulación cerebral para la reconstrucción vascular. El riesgo de déficits vasculares o neurales permanentes es significativamente más alto que para los tumores de clases I y II [30].
• TABLA 4: Clasificación de Shamblin de los tumores del cuerpo carotídeo
La ecografía en modo B y la dúplex color, son herramientas de diagnóstico económicas y no invasivas, usadas frecuentemente como el primer método por imágenes para los TCC cervicales [23,31]. Los paragangliomas carotídeos son detectados fácilmente utilizando TC y RMN. La angiografía por TC muestra la anatomía con más exactitud que la RMN, debido a su mejor resolución espacial. No obstante, la RMN con contraste es más adecuada para la investigación y detección de lesiones múltiples.
Ambos métodos de imágenes transversales pueden ser utilizados para la navegación operatoria. Además, la RMN puede identificar tumores del glomus cuando están presentes las ausencias de flujo características [31-33]. En efecto, los paragangliomas son observados en la RMN en secuencias T1 ponderadas con baja intensidad de señal y en las T2 con señal hiperintensa. Después de la administración intravenosa del material de contraste, esos tumores exhiben un patrón de realce intenso y homogéneo, similar a la imagen de la TC. El uso de material de contraste intravenoso no es esencial en la RMN.
La apariencia clásica de “sal y pimienta” de los parangangliomas mayores de 1 cm de diámetro, corresponde a múltiples áreas con ausencia de señal (a causa del flujo lento de los vasos o hemorragia) entremezcladas con focos hiperintensos [34]. Puede usarse la evaluación con medicina nuclear. Los TCC muestran típicamente una avidez de captación con diferentes técnicas funcionales de imágenes, como ser tomografía de emisión de positrones/tomografía computada con 18-fluorodihidroxifenilalanina, tomografía computada de emisión de positrones/tomografía computada con 18-fluorodopamina y centellografía con 123I-metaiodobencilguanidina; esta última es específica para el paraganglioma.
Asimismo, la imagen del receptor de somatostatina tiene una sensibilidad mayor al 90% para los paraglangliomas de cabeza y cuello (PCC) [22], utilizando centellografía con 111In-octeotride. La imagen del receptor de somatostatina con agentes emisores de positrones, tales como los péptidos 68Ga-1,4,7,10-tetraazacyclododecane-1,4,7,10-ácido tetraacético (DOTA), ha mostrado sensibilidades promisorias en series pequeñas [35].
Los exámenes angiográficos no brindan información diagnóstica adicional, comparados con la TC y la RMN, pero pueden permitir una posible embolización preoperatoria o colocación de un stent en la ACI, en los TCC clase III de Shamblin [25,33,36,37]. La mayoría de los casos de TCC debe someterse a resección quirúrgica completa, porque esa opción terapéutica ofrece potencialmente una cura para el paciente [23,24,38]. Histológicamente, los paragangliomas del cuerpo carotídeo asemejan la arquitectura normal del cuerpo carotídeo.
Desafortunadamente, el pleomorfismo nuclear, actividad mitótica, necrosis o invasión vascular o perineural, no predicen la conducta biológica, porque todas esas características pueden encontrarse también en los TCC benignos. Por lo tanto, los TCC son considerados principalmente como lesiones benignas; no obstante, frecuentemente se encuentra una conducta maligna. Ese diagnóstico se reserva para los tumores con metástasis local, regional o a distancia. Se reporta una tasa de malignidad del 6% al 12,5% para todos los casos [2-4,10,11,12-18] y el 7% al 9% de los casos son hereditarios [1,4,5-9,19].
El tamaño del tumor es importante, no sólo por sus manifestaciones clínicas, sino también por el tratamiento. En 1971, Shamblin introdujo un sistema de clasificación basado sobre el tamaño tumoral. Se clasificó a los tumores pequeños, que podían ser fácilmente disecados de los vasos, como grupo I. El grupo II (10 de los casos de la presente serie) incluye a los paragangliomas de tamaño medio, que están íntimamente asociados y comprimen los vasos carotídeos, pero que pueden ser separados mediante cuidadosa disección subadventicial. El grupo III (9 de los presentes casos) consiste en tumores grandes que típicamente encajonan a la arteria carótida, requiriendo resección vascular parcial o completa y reemplazo. En la casuística presentada en este trabajo, 3 tumores comprometían a la ACE y 6 a la ACI.
La resección de los paragangliomas del cuerpo carotídeo conlleva riesgos inherentes de lesión de los nervios craneales, arterias carótidas y pérdida excesiva de sangre. La resección quirúrgica con disección subadventicial cuidadosa es el tratamiento de elección para la mayoría de los paragangliomas del cuerpo carotídeo (Shamblin I y II) [1-4,39-41]. Los paragangliomas del cuerpo carotídeo Shamblin III requieren resección de la ACE y/o de la ACI. Si la carótida interna está comprometida por el tumor o es dañada durante la disección, deber realizarse inmediatamente la reparación/reemplazo. El segundo problema durante la resección del tumor es el sangrado, que en ocasiones puede ser masivo. En tales casos, el pinzamiento de todas las arterias carótidas es útil, junto con la colocación de una derivación carotídea interna [42].
Una derivación intraoperatoria también puede ser usada en las siguientes circunstancias, para ayudar en la resección de los TCC y acortar el tiempo operatorio [43]:
- Para evitar la lesión de los nervios craneales: cuando el tamaño grande del tumor y el estrecho espacio operatorio hacen difícil su resección y fácil lesionar los nervios craneales, bajo la guía de una derivación, la dirección de la ACI es más evidente y los nervios craneales son más claros, lo que ayuda en la disección del tumor [43].
- Para disminuir el tamaño del tumor: con el uso de una derivación, disminuye el riesgo sanguíneo del tumor y, por lo tanto, disminuye su tamaño [43].
Los autores de este trabajo, considerando su experiencia y su casuística, recomiendan una derivación carotídea interna oclusiva con doble balón Pruitt-Inahara (Le Maitre Vascular, Milán, Italia) [38]. La colocación de esa derivación, a través de una incisión en la arteria carótida común, contribuye al control adecuado del sangrado de la carótida común y de la ACI y protege al cerebro. Ese procedimiento brinda un campo quirúrgico limpio y seco durante la remoción del tumor [2,41].
Algunos otros artículos recomiendan la embolización angiográfica preoperatoria [2,41]. La embolización preoperatoria de un paraganglioma del cuerpo carotídeo puede ser realizada utilizando etanol o alcohol polivinílico. El resultado final es una desvascularización completa. En el pasado, los paragangliomas del cuerpo carotídeo fueron considerados radio resistentes [17]. No obstante, estudios más recientes indican buenas respuestas a la terapia radiante [11,13]. La mayoría de los autores recomienda radioterapia para los paragangliomas del cuerpo carotídeo gigantes o recidivados y para los malignos con metástasis en los ganglios linfáticos regionales [16-19].
Las técnicas quirúrgicas modernas y propuestas recientemente para la embolización preoperatoria y refuerzo de la pared posterior de la ACI con un stent, pueden ayudar en el manejo quirúrgico de la bifurcación carotídea, reduciendo las complicaciones de laceraciones, espasmos y trombosis. Los stents cubiertos han sido usados como una alternativa a la embolización, cuando se consideró reducir el riesgo de embolización distal. Esa técnica resultó también en reducción de la pérdida de sangre intraoperatoria y, teóricamente, las pequeñas ramas nutricias, que pueden no ser aparentes en los angiogramas, tienen mayor probabilidad de ser excluidas con un stent cubierto [44].
Conclusiones
A pesar de la naturaleza benigna de los TCC, desde un punto de vista histopatológico y de los reportes documentando su baja tasa de crecimiento, la resección quirúrgica sigue siendo el tratamiento de elección para esas afecciones. Las complicaciones neurovasculares operatorias y postoperatorias descritas, están relacionadas directamente con sus dimensiones, de acuerdo con la clasificación de Shamblin. Para los TCC tipos I y II de Shamblin, que representan la mayoría de la enfermedad (con una tasa reportada mayor al 70% [45]), el riesgo peri y postoperatorio de complicaciones neurovasculares es bajo. La tasa de complicación aumenta fuertemente para los TCC tipo III de Shamblin (responsables por alrededor del 30% de los casos [45]).
♦ Comentario y resumen objetivo: Dr. Rodolfo D. Altrudi