Introducción
El SARS-CoV-2 causa un síndrome clínico, enfermedad por coronavirus 2019 (COVID-19), y sus manifestaciones pulmonares han sido bien descritas. Hay una creciente evidencia de complicaciones neurológicas y enfermedades en pacientes con COVID-19.
Dos coronavirus humanos (CoV) similares, el síndrome respiratorio del Medio Oriente (MERS-CoV) y el síndrome respiratorio agudo severo (SARS-CoV-1), también se han asociado con enfermedades neurológicas en casos raros.
Esto plantea la pregunta de si el SARS-CoV-2 es neurotrópico y si contribuye a complicaciones neurológicas postinfecciosas. Algunos informes de casos han descrito complicaciones neurológicas en pacientes con COVID-19. Sin embargo, aún se desconoce en qué medida el SARS-CoV-2 daña el sistema nervioso central (SNC) o si los síntomas neurológicos son atribuibles a mecanismos secundarios.
Estrategia de búsqueda y criterios de selección
Las referencias para esta revisión se identificaron mediante búsquedas en PubMed de abril a mayo de 2020 para artículos publicados entre 1969 y abril de 2020, así como referencias de artículos relevantes. Se utilizaron los términos de búsqueda COVID-19, SARS-CoV-2, SARS-CoV, MERS-CoV, HCoV-OC43, neurotropismo, neuroinvasión y coronavirus. No hubo restricciones de idioma. La lista final de artículos incluidos se generó en función de la relevancia de los temas tratados en esta revisión.
Coronavirus neurotrópicos
Los coronavirus (CoV) son virus de ARN de sentido positivo, grandes y envueltos, divididos en 3 géneros: alfacoronavirus, betacoronavirus y gammacoronavirus. Estos virus infectan a los humanos y a numerosas especies animales, generalmente causando enfermedades del tracto respiratorio superior o inferior, gastrointestinal, neurológica o hepática.
Actualmente, hay 7 CoV que pueden infectar a los humanos, incluido el coronavirus humano (HCoV). Los betacoronavirus SARS-CoV-2, SARS-CoV-1 y MERS-CoV están asociados con enfermedades graves en humanos. Aunque el HCoV se asocia típicamente con la enfermedad del tracto respiratorio, se ha demostrado que el HCoV infecta neuronas: HCoV-229E, HCoV-OC43 y SARS-CoV-1.
> HCoV-OC43
El potencial neuroinvasivo de HCoV-OC43 ha sido particularmente bien estudiado. Los oligodendrocitos, los astrocitos, la microglía y las neuronas son susceptibles a la infección aguda con HCoV-OC43, y todos, excepto la microglia, son compatibles con la infección persistente.
En los modelos murinos, HCoV-OC43 puede invadir el SNC por vía intranasal, seguido de una rápida diseminación por todo el SNC. El daño neuronal parece ser causado por lesiones directas, mediadas por virus y no inmunomediadas. El daño del SNC provoca una variedad de trastornos neurológicos en ratones, incluida la encefalitis y la parálisis flácida transitoria.
En humanos, el historial de infección con HCoV-OC43 se asocia con esclerosis múltiple (EM), según la presencia de ARN viral en el tejido cerebral de autopsia de donantes que murieron con EM. En un estudio, también se detectó ARN de HCoV-OC43 en el líquido cefalorraquídeo (LCR) en 10 de 20 pacientes vivos con EM.
Aunque se desconoce el mecanismo de desmielinización potencial durante la infección por HCoV-OC43, esto puede deberse a una respuesta inmune adaptativa contra los antígenos de HCoV-OC43 que reaccionan de forma cruzada con los antígenos de mielina.
De hecho, se ha demostrado que los clones de células T periféricas en pacientes con EM reaccionan de forma cruzada a los antígenos de HCoV-OC43 y mielina. Además de la enfermedad desmielinizante, también ha habido informes de casos pediátricos de niños con inmunosupresión severa que desarrollan encefalitis asociada con la infección por HCoV-OC43, con biopsias cerebrales que tienen resultados positivos para el ARN de HCoV-OC43 en la secuenciación genómica.
> SARS-CoV-1
Durante la pandemia de SARS de 2002-2003, se informaron complicaciones neurológicas en un subconjunto de pacientes. Un grupo de Taiwán informó 3 casos de síndrome de Guillain-Barré con variantes axonales y 5 casos de accidente cerebrovascular isquémico. Un informe describió a un paciente con SARS que presentaba una convulsión con un resultado positivo de PCR de LCR para SARS-CoV-1, aunque era posible la contaminación de la muestra.
Además, el SARS-CoV-1 se ha detectado de manera confiable en muestras de tejido cerebral de autopsias con SARS, específicamente en el citoplasma de las neuronas en la corteza y el hipotálamo, a veces asociado con edema neuronal y degeneración nuclear. El examen del tejido de la autopsia de un paciente con encefalitis reveló necrosis neuronal, hiperplasia de células gliales e infiltración de monocitos y células T.
Además, los viriones se visualizaron en las neuronas en microscopía electrónica, y el ARN del SARS-CoV-1 se aisló de la muestra. En modelos murinos, el SARS-CoV-1 ingresa al SNC a través del bulbo olfatorio y exhibe una rápida diseminación transináptica. La infección causa daño neuronal significativo y muerte sin infiltración inflamatoria significativa.
> MERS-CoV
El síndrome respiratorio del Medio Oriente CoV (MERS-CoV) surgió por primera vez en 2012, y desde entonces, se han reportado aproximadamente 2494 casos, con una tasa de mortalidad de 34,4%.
A diferencia del SARS-CoV-1 y el SARS-CoV-2, MERS-CoV se une al receptor de dipeptidil peptidasa 4 en las células para entrar. La dipeptidil peptidasa 4 se expresa ampliamente en todo el cuerpo en epitelios, endotelios vasculares y el cerebro. Ha habido varios informes de casos clínicos que sugieren que MERS-CoV puede conducir a complicaciones neurológicas en humanos.
En un estudio de 70 pacientes, 6 (9%) desarrollaron convulsiones, 9 (13%) informaron dolor de cabeza y 18 (26%) experimentaron confusión. Una serie de casos destacó 3 casos graves de enfermedad neurológica en MERS-CoV, incluida la sospecha de encefalomielitis diseminada aguda, encefalitis e infartos isquémicos generalizados.
Otra serie de casos destacó la enfermedad neuromuscular en MERS-CoV, incluidos 3 casos de síndrome de Guillain-Barré y un caso de encefalitis de Bickerstaff. Sin embargo, este virus nunca se ha detectado en el SNC de los humanos.
> SARS-CoV-2
El virus SARS-CoV-2 comparte una homología de secuencia cercana con el SARS-CoV-1. Ambos virus usan proteínas de espiga en la superficie viral para unirse al receptor de la enzima convertidora de angiotensina 2 (ACE2) en células huésped de mamífero.
La presencia del receptor ACE2 en los tejidos determina el tropismo celular viral en humanos. En humanos, ACE2 se expresa en epitelios de las vías respiratorias, células renales, intestino delgado, parénquima pulmonar y endotelios vasculares en todo el cuerpo y ampliamente en todo el SNC.
Está surgiendo información sobre la localización celular y espacial específica dentro del cerebro humano. Un informe reciente encontró que ACE2 se expresa en neuronas, astrocitos y oligodendrocitos. La expresión de ACE2 también estaba altamente concentrada en la sustancia negra, los ventrículos, la circunvolución temporal media, la corteza cingulada posterior y el bulbo olfatorio.
En cultivos de células neuronales, ACE2 se expresa tanto en la membrana superficial como en el citoplasma. La expresión generalizada de ACE2 en el cerebro plantea la preocupación de que el SARS-CoV-2, de manera similar al SARS-CoV-1, tenga el potencial de infectar neuronas y células gliales en todo el SNC.
Posibles mecanismos de neuroinvasión
Aunque hay informes de complicaciones neurológicas en pacientes con COVID-19, no está claro si el SARS-CoV-2 es neurotrópico en humanos. La neuroinvasión viral podría lograrse de varias maneras, incluida la transferencia transináptica a través de las neuronas infectadas, la entrada a través del nervio olfativo, la infección del endotelio vascular o la migración de leucocitos a través de la barrera hematoencefálica (BHE).
> Propagación transináptica
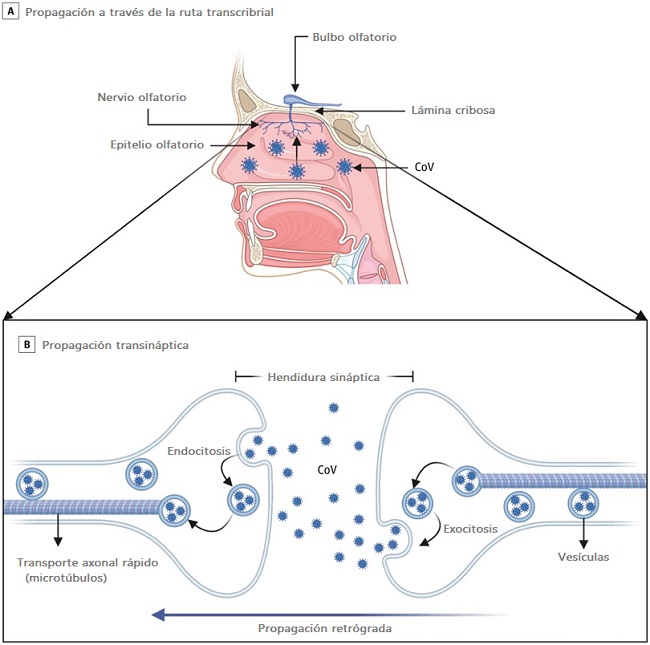
Cada vez hay más pruebas de que el CoV humano y no humano invaden las terminales nerviosas periféricas, se propagan de forma retrógrada a lo largo de las sinapsis nerviosas y accede al SNC. Se ha demostrado la transferencia transináptica del virus para varios CoV.
Por ejemplo, HEV67 ingresa a la cavidad nasal e infecta su mucosa, el epitelio pulmonar y el intestino delgado de lechones y ratas lactantes. Luego infecta los nervios periféricos y se propaga vía retrógrada al ganglio de la raíz dorsal, terminando en las neuronas medulares.
Una vía endocítica o exocítica facilita la transferencia de HEV67 entre las neuronas de la corteza motora. Una vía secretoria similar mediada por vesículas permite que HEV67 se propague entre las neuronas y las células satélite.
Para la diseminación intracelular dentro de una neurona, el transporte axonal rápido utiliza microtúbulos axonales para mover moléculas por vía retrógrada o anterógrada. Se ha demostrado que el virus del herpes simple, el VIH y el HCoV-OC43 usan transporte axonal retrógrado rápido para infectar el cuerpo celular de las neuronas.
Durante el brote de COVID-19, se ha informado la pérdida aislada del sentido del olfato (anosmia) y la pérdida del sentido del gusto (ageusia) con o sin síntomas respiratorios. La entrada directa a lo largo del nervio olfativo es otro mecanismo potencial para la entrada de SARS-CoV-2 al SNC.
En un modelo de ratón transgénico que expresa ACE2, los ratones inoculados con SARS-CoV-1 intranasalmente mostraron que el virus invadió el SNC a través de una ruta transcribrial. Lo mismo se ha demostrado en los modelos MERS-CoV y HCoV-OCR43 murinos después de la inoculación intranasal.
No está claro si el SARS-CoV-2 puede propagarse de manera similar al SNC por vía transcripcional. Los informes emergentes sugieren que las células sustentaculares y madre en el epitelio olfativo expresan ACE2 y son vulnerables a la infección por SARS-CoV-2, mientras que las neuronas sensoriales olfativas no expresan ACE2, lo que sugiere que el SARS-CoV-2 no puede ganar acceso a las células nerviosas.
Estos hallazgos preliminares sugieren que el daño al epitelio olfativo subyace a la anosmia clínica, en lugar de la lesión neuronal.
> Extensión de la barrera hematoencefálica
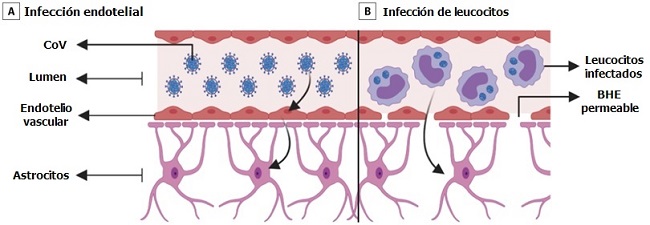
Hay 2 mecanismos posibles para la diseminación del SARS-CoV-2 a través de la BHE. La BHE está compuesta por endotelio vascular, astrocitos, pericitos y matriz extracelular. Las células endoteliales están unidas por uniones estrechas y regulan la permeabilidad de la BHE.
El primer mecanismo es a través de la infección y el transporte a través de las células endoteliales vasculares. Los endotelios en todo el cuerpo expresan ACE2 y corren el riesgo de infección por SARS-CoV-2. Un estudio de un caso de autopsia demostró la presencia de partículas virales de SARS-CoV-2 en endotelios capilares y neuronas de una muestra de lóbulo frontal.
Se encontró que las neuronas tenían partículas virales empaquetadas en vesículas dilatadas. Las imágenes microscópicas electrónicas incluso demostraron endocitosis o exocitosis de partículas virales a través de las células endoteliales.
Los arbovirus usan un mecanismo de transporte activo similar sin replicación para ingresar a las células endoteliales y cruzar la BHE hacia el SNC. Una vez que el virus obtiene acceso al tejido vascular y neuronal, podría comenzar un ciclo de gemación viral y dañar aún más el tejido vascular y neuronal a medida que el virus entra en contacto con ACE2 en las neuronas, glía y vasos.
El segundo mecanismo es a través de la infección de leucocitos que pasan a través de la BHE, denominado mecanismo de caballo de Troya. Este mecanismo está bien descrito en el VIH, en el cual las células inmunes infectadas pasan de la sangre a través del BHE para infectar el SNC. Se ha demostrado que el virus SARS-CoV-1 infecta a linfocitos, granulocitos, derivados de monocitos y monocitos, los cuales expresan ACE2.
Es probable que el SARS-CoV-2 infecte tipos celulares similares. Se ha demostrado que los linfocitos T permiten la infección por SARS-CoV-2 pero no admiten la replicación viral. La inflamación sistémica que caracteriza a COVID-19 probablemente aumenta la permeabilidad de la BHE, permitiendo así que las células inmunes infectadas, las citoquinas y posiblemente el virus pasen al SNC.
Manifestaciones Neurológicas
La información sobre las manifestaciones neurológicas en pacientes con COVID-19 es escasa. Un estudio sistémico en Wuhan, China, informó hallazgos neurológicos en 214 pacientes hospitalizados con COVID-19.
Otro estudio sistemático en Francia observó síntomas neurológicos en 49 de 58 pacientes, incluyendo confusión, encefalopatía y signos piramidales en el examen, así como realce leptomeníngeo y anormalidades de perfusión en la resonancia magnética. Los síntomas neurológicos más comunes en COVID-19 son:
> Cefalea
El dolor de cabeza es una de las quejas iniciales más comunes en pacientes con COVID-19. En una serie de casos reciente, el dolor de cabeza era una queja predominante, junto con fiebre, tos, dolor de garganta y disnea. La prevalencia varía en diferentes informes, pero puede afectar hasta un tercio de los pacientes diagnosticados.
Se han invocado mecanismos neuroinflamatorios en algunos síndromes a través de citoquinas y quimiocinas que desencadenan neuronas sensoriales nociceptivas. La liberación de citoquinas y quimiocinas por los macrófagos durante las diversas etapas de la infección por COVID-19 puede conducir a mecanismos similares para el dolor.
> Anosmia y ageusia
La prevalencia de anosmia y ageusia varía ampliamente en la literatura. En un estudio de pacientes hospitalizados en Wuhan, la prevalencia de hipogeusia e hiposmia fue de 5,6% y 5,1%, respectivamente, mientras que el 19,4% de los pacientes en Italia tenían alguna forma de disfunción quimiosensorial. Aproximadamente el 88,5% y el 88% de los pacientes en Alemania informaron disfunción olfativa y gustativa, respectivamente.
De los pacientes sin congestión nasal, el 79,7% eran hipósmicos. La anosmia también se ha observado en otras infecciones respiratorias, como la gripe. En COVID-19, la anosmia generalmente no se acompaña de inflamación nasal o rinitis. Dados los informes de anosmia que se presentan como un síntoma temprano de COVID-19, las pruebas dedicadas para la anosmia pueden ofrecer el potencial para la detección temprana de la infección por COVID-19.
> Conciencia deteriorada
Se informó el deterioro de la conciencia en el 37% de los pacientes hospitalizados con COVID-19 en el estudio de Mao et al en Wuhan. Existen varios mecanismos posibles de alteración de la conciencia en pacientes con COVID-19, que incluyen infección directa y daño del parénquima, encefalopatía metabólica tóxica, convulsiones o enfermedad desmielinizante.
> Encefalopatía tóxica-metabólica
El sello distintivo de la encefalopatía es la alteración de la atención y la excitación, que se presenta con confusión, letargo, delirio o coma. Los factores de riesgo comunes que predisponen a los pacientes al delirio son la edad avanzada, la demencia subyacente o el deterioro cognitivo, múltiples comorbilidades, desnutrición, entre otros.
Muchos trastornos metabólicos y endócrinos ponen a los pacientes en mayor riesgo de encefalopatía, incluida la hipo o hipernatremia, hipo o hipercalcemia, disfunción renal, disfunción hepática e hipo o hiperglucemia, entre otros. La sepsis y la posterior tormenta inflamatoria y de citoquinas también pueden contribuir a la encefalopatía con IL-6, IL-8, IL-10 y el TNF-α que está implicado en estados de confusión.
Los pacientes hospitalizados con COVID-19 pueden exhibir numerosos trastornos metabólicos tóxicos, incluyendo tormenta de citoquinas, inflamación severa, sepsis y disfunción renal.
La enfermedad grave de COVID-19 se caracteriza por un aumento de IL-2, IL-6, IL-7, factor estimulante de colonias de granulocitos, IP-10, MPC1, proteína inflamatoria de macrófagos 1-α y TNF-α. La tormenta de citoquinas probablemente contribuye significativamente a la encefalopatía metabólica tóxica en casos severos, junto con los factores de riesgo y los trastornos metabólicos detallados.
> Encefalitis
Como se discutió, MERS-CoV, SARS-CoV-1 y potencialmente SARS-CoV-2 pueden invadir el SNC y una posible encefalitis es una preocupación. Sin embargo, actualmente no hay evidencia directa de encefalitis secundaria a SARS-CoV-2. Un caso sospechoso de meningoencefalitis en un paciente con COVID-19 se informó en Japón.
También se ha informado un caso sospechoso de encefalopatía necrotizante aguda, que generalmente es un síndrome inmune peri-infeccioso, en lugar de encefalitis viral directa. Los altos niveles de citoquinas proinflamatorias en el LCR pueden causar degradación y una mayor permeabilidad de la BHE, lo que a su vez puede conducir a una invasión viral.
> Convulsiones
Las convulsiones también pueden conducir a un deterioro de la conciencia y se han informado en otras infecciones por CoV. Además, se informan convulsiones subclínicas en aproximadamente el 10% de los pacientes con enfermedad crítica, y los pacientes con trastorno convulsivo primario tienen un mayor riesgo de convulsiones y estado epiléptico en el contexto de una infección grave.
Un informe reciente de 304 pacientes diagnosticados con COVID-19 solo documentó 2 "eventos similares a convulsiones" sin casos confirmados de convulsiones de nuevo comienzo.
Un informe de caso de un paciente sin antecedentes de epilepsia que tuvo múltiples ataques tónico-clónicos aparentes en el contexto de COVID-19 puede representar un trastorno convulsivo desenmascarado o el efecto directo de COVID-19 en el SNC, pero se necesitan estudios adicionales en estos casos.
> Accidente cerebrovascular y eventos vasculares
El estudio de Mao et al informó que el 5% de una cohorte hospitalizada en Wuhan tenía accidentes cerebrovasculares agudos. Un informe más detallado de los eventos de enfermedad cerebrovascular en esta cohorte reveló que 11 pacientes desarrollaron accidentes cerebrovasculares isquémicos agudos, 1 tenía trombosis del seno venoso cerebral y 1 tenía una hemorragia intracerebral.
Los pacientes que desarrollaron enfermedad cerebrovascular eran significativamente mayores; eran más propensos a tener manifestaciones graves de la enfermedad COVID-19; tenía más factores de riesgo cardiovascular; y tenía niveles significativamente más altos de proteína C reactiva y dímero D, lo que sugiere un estado hipercoagulable.
Un estudio en Nueva York demostró que los pacientes jóvenes (menores de 50 años) desarrollaron accidentes cerebrovasculares de grandes vasos en el contexto de COVID-19, lo que sugiere que todas las edades son vulnerables.
La fisiopatología del aumento del riesgo de enfermedad cerebrovascular durante la infección por COVID-19 es probablemente multifactorial. Los resultados anormales comunes de pruebas de laboratorio en pacientes incluyen recuento elevado de leucocitos, nivel de proteína C reactiva, nivel de dímero D, nivel de ferritina y nivel de lactato deshidrogenasa.
Los casos graves se caracterizan por marcadores inflamatorios elevados e hipercoagulabilidad en comparación con los casos moderados y con una mayor probabilidad de accidente cerebrovascular.
Mecanismos virales específicos también pueden aumentar el riesgo de ACV. La infección de las células endoteliales vasculares y el daño posterior a la vasculatura pueden aumentar el riesgo de infartos isquémicos y hemorrágicos. Muchas infecciones pueden aumentar el riesgo de accidente cerebrovascular, a menudo a través de inflamación sistémica, trombosis o vasculitis.
> Síndrome de Guillain-Barré y trastornos de los nervios periféricos
El síndrome de Guillain-Barré, también conocido como polineuropatía desmielinizante inflamatoria aguda (PDIA), puede desarrollarse después de una enfermedad gastrointestinal o respiratoria, en el que los virus infecciosos probablemente estimulan las células T o B autorreactivas.
Los anticuerpos producidos por el sistema inmunitario para combatir el virus reaccionan de forma cruzada y se unen a los componentes del sistema nervioso periférico, causando disfunción neuronal. Tanto la PDIA como las variantes de neuropatía axonal motora aguda (AMAN) se han documentado después de infecciones por SARS-CoV-1. Se han notificado casos de encefalitis del tronco encefálico PDIA, AMAN y Bickerstaff en el contexto de MERS-CoV.
Están surgiendo informes de síndrome de Guillain-Barré en pacientes con COVID-19. Una serie de casos reportó 5 casos en Italia después de la infección por COVID-19. En 4 casos, los pacientes presentaron debilidad y parestesias en las extremidades inferiores. Los pacientes desarrollaron síntomas una media de 5 a 10 días después del inicio de los síntomas virales. Los estudios de electromiografía mostraron que 2 pacientes tenían PDIA y 3 tenían AMAN.
Informes de casos adicionales describen un paciente en Irán con AMAN y un paciente de Italia con síndrome de Miller-Fisher. Wuhan informó un caso clínico de mielitis transversa aguda, pero los hallazgos de RM y LCR no estaban disponibles. El paciente desarrolló parálisis flácida de las extremidades inferiores con pérdida de la sensación de pinchazos y parestesias por debajo del nivel de T10 y fue tratado con éxito con esteroides e inmunoglobulina intravenosa.
Posibles efectos sobre el SNC de las terapias actualmente en uso para COVID-19
Actualmente, hay numerosos medicamentos diferentes que se utilizan para tratar a pacientes con COVID-19. Aquí discutimos sus posibles efectos neurológicos y / o relevancia para las enfermedades neurológicas.
Cloroquina e Hidroxicloroquina
La cloroquina y la hidroxicloroquina, desarrolladas inicialmente como medicamentos antipalúdicos, funcionan al prevenir la acidificación de los endosomas, lo que interrumpe las funciones celulares y puede prevenir la entrada viral a través de la unión de ACE2. La hidroxicloroquina inhibe el SARS-CoV-2 in vitro, pero faltan estudios in vivo, y la FDA actualmente recomienda tener precaución al usar estos medicamentos debido a la posible cardiotoxicidad.
Los efectos adversos neurológicos incluyen irritabilidad, psicosis, neuropatía periférica y neuromiopatía. Se sabe que la hidroxicloroquina exacerba los síntomas en la miastenia gravis y ha estado contraindicada durante mucho tiempo en pacientes con esta enfermedad. También reduce el umbral de convulsiones e interactúa con varios medicamentos antiepilépticos, incluidos lacosamida y lamotrigina.
Tocilizumab
Tocilizumab es un anticuerpo monoclonal para el receptor de IL-6 que puede atenuar la liberación de citoquinas en pacientes con enfermedad inflamatoria grave. Hay datos retrospectivos limitados que sugieren un posible beneficio. Tiene poca penetración en el SNC. Los efectos adversos neurológicos incluyen dolor de cabeza y mareos, y ha habido informes poco frecuentes de microangiopatía trombótica cerebral multifocal.
Remdesivir
Remdesivir es un inhibidor viral de la ARN polimerasa dependiente de ARN. Los datos in vitro han demostrado que es un potente inhibidor de SAR-CoV-2, y los primeros datos clínicos han mostrado algún beneficio. Se observa poco sobre los posibles efectos adversos neurológicos, y los ensayos clínicos están en curso, lo que proporcionará datos valiosos.
Consideraciones especiales para pacientes bajo cuidado neurológico
Muchos pacientes bajo cuidado neurológico tienen condiciones complejas y comorbilidades que pueden colocarlos en mayor riesgo de desarrollar enfermedad grave por COVID-19.
Pacientes mayores de 65 años; viviendo en un centro de enfermería especializada; o con enfermedad pulmonar concomitante, enfermedad cardíaca, enfermedad hepática, obesidad (índice de masa corporal > 40), diabetes, enfermedad renal que requiere diálisis o inmunosupresión tienen un mayor riesgo de enfermedad grave en COVID-19.
Esclerosis múltiple
Los pacientes con EM que toman terapias modificadoras de la enfermedad que tienen efectos inmunosupresores pueden tener un mayor riesgo de desarrollar enfermedad grave por COVID-19. La recomendación para todos los pacientes con EM, en general, es continuar las terapias de modificación de la enfermedad.
Los esteroides serían seguros para tratar las recaídas agudas de EM en pacientes sin COVID-19. Si un paciente tiene un alto riesgo de exposición al SARS-CoV-2 y debe recibir terapia inmunosupresora adicional, se recomienda que los médicos evalúen los riesgos y beneficios de cambiar al paciente a interferones, acetato de glatiramer o natalizumab.
Trastornos Neuromusculares
Los pacientes con trastornos neuromusculares tienen un riesgo particular de deterioro con COVID-19. Muchos trastornos neuromusculares se tratan con medicamentos inmunosupresores, que pueden aumentar el riesgo de desarrollar enfermedad grave por COVID-19.
Además, los pacientes con miastenia gravis o síndrome miasténico de Lambert Eaton pueden tener debilidad muscular respiratoria, lo que puede aumentar el riesgo de complicaciones graves en COVID-19. Se recomienda continuar los tratamientos actuales.
Para aquellos que reciben terapia inmunosupresora, el grupo recomienda distanciamiento social y telemedicina. La hidroxicloroquina exacerba los síntomas de la miastenia gravis y está contraindicada. Para los pacientes con neuropatías disinmunes crónicas, los riesgos y beneficios de las infusiones en el hospital deben sopesarse con el riesgo de exposición al SARS-CoV-2 y el desarrollo de la enfermedad grave por COVID-19.
Epilepsia
La epilepsia no aumenta el riesgo de un paciente de contraer SARS-CoV-2 ni pone a los pacientes en mayor riesgo de enfermedad grave. Casi todos los medicamentos antiepilépticos no son inmunosupresores y son seguros para los pacientes con COVID-19.
Las infecciones virales y la fiebre pueden desencadenar convulsiones en pacientes con epilepsia. Los médicos deben anticipar las crisis, recetar medicamentos para el tratamiento a corto plazo y proporcionar a los pacientes un plan detallado.
|
Conclusiones
|