La insuficiencia suprarrenal (IS)—la manifestación clínica de la producción o acción deficiente de los glucocorticoides—es un trastorno que pone en riesgo la vida y puede derivar de la IS primaria o secundaria debida a la alteración del eje hipotálamo-hipofisario. ¿Cuándo y durante qué situaciones el clínico debe sospechar la IS? ¿Cuáles son los trastornos genéticos, infecciones y medicaciones que deben tenerse en cuenta? ¿Cuáles son los conceptos actuales acerca de los mecanismos subyacentes?
Los síntomas más importantes de la insuficiencia adrenocortical, descritos por primera vez por Addison en 1855, son la debilidad, la fatiga, la anorexia y el dolor abdominal, con hipotensión ortostática, deseo de sal y, en la IS primaria, la hiperpigmentación característica de la piel. El síndrome agudo constituye una emergencia médica dado que ya puede presentarse con una crisis hipotensiva grave y embotamiento sensorial, junto con mialgias, artralgias o dolor abdominal y, fiebre. Durante los procedimientos diagnósticos, se analizará la capacidad de la corteza suprarrenal para responder a la corticotrofina mediante la prueba estándar, la cual mide el cortisol sérico antes y después de 30 minutos y 60 minutos de haber recibido una inyección intravenosa de 250 µg de corticotrofina. Un aumento en el nivel de cortisol sérico hasta una concentración pico de 500 nmol/litro (18 µg/dL) indica una respuesta normal. La capacidad de respuesta suprarrenal a la inyección de corticotrofina exógena está alterada en la mayoría de los casos de enfermedad suprarrenal secundaria. Sin embargo, en la IS secundaria leve, el eje hipotálamo-hipófisis-suprarrenal puede estar intacto con una respuesta a dicho estímulo normal. La evidencia más reciente indica que la prueba de estimulación con 1 µg de corticotrofina es más sensible que la prueba con 250 µg de corticotrofina.
Una vez diagnosticada la IS, se inicia el tratamiento de reemplazo con glucocorticoides, en 2-3 dosis diarias; la mitad o la tercera parte de la dosis diaria debe administrase a la mañana (15-25 mg de hidrocortisona), coincidiendo con el patrón fisiológico de secreción de cortisol. El reemplazo de mineralocorticoides (0.5-0.2 mg de fludrocortisona/día a la mañana) solo es necesario en la IS primaria mientras que la administración de dehidroepiandrosterona (25-50 mg) es un tratamiento opcional. El manejo de la crisis suprarrenal aguda consiste en la administración inmediata de 100 mg de hidrocortisona intravenosa, seguida de 100-200 mg de hidrocortisona cada 24 horas y una infusión continua de grandes volúmenes de solución salina fisiológica (inicialmente 1 litro/hora), con monitoreo cardíaco continuo. El diagnóstico y el manejo clínico oportunos de la IS son muy importantes, lo que implica que los médicos de todas las especialidades conozcan sus causas, signos y síntomas.
Trastornos hereditarios
Asociados con la insuficiencia suprarrenal
Cada vez se conocen más los factores hereditarios que intervienen en la regulación del eje hipotálamo-hipófiso-suprarrenal. Los genes identificados que tienen relación con la IS son los que codifican los receptores, los factores de transcripción y las enzimas involucradas en la síntesis hormonal o en la regulación de las glándulas hipófisis o suprarrenal o, la función de las células blanco. Por otra parte, ciertas formas de adrenalitis autoinmune tienen componentes hereditarios, con carácter autonómico recesivo (síndrome poliglandular autoinmune) o autonómico dominante, con penetrancia incompleta (síndrome poliglandular autoinmune 2).
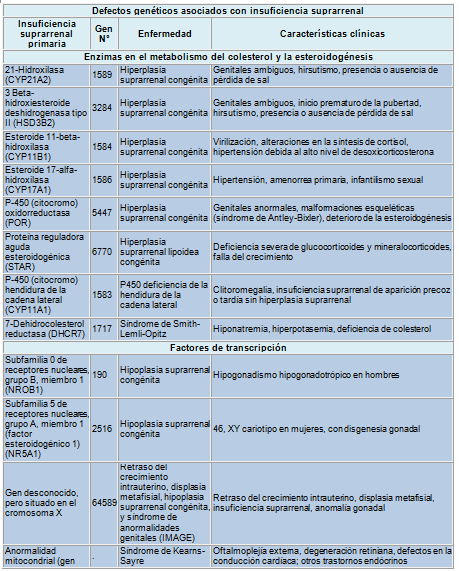
La hiperplasia suprarrenal congénita (HSC) por deficiencia de la 21-hidroxilasa es una de las causas más comunes de trastornos suprarrenales hereditarios, teniendo su forma más común una incidencia general de 1 caso en 15.000 nacidos vivos. La frecuencia de portadores de la HSC es de 1 en 60 personas. Los pacientes con HSC clásica suelen presentar síntomas en la primera infancia con una forma moderada conocida como HSC virilizante simple o con una forma severa que causa depleción de sal y virilización. La forma de HSC no clásica ocurre en mujeres adolescentes y adultas, quienes presentan hirsutismo e infertilidad.
Aunque la HSC es un trastorno común, no es considerado con frecuencia en la práctica clínica y no siempre se la relaciona con situaciones de estrés ni los médicos tienen presente que deben prevenir la crisis suprarrenal en esos casos. Por otra parte, no se da la suficiente importancia a la educación de los padres sobre el manejo del trastorno. Los médicos deben tomarse tiempo para explicar a los niños y sus familiares que el régimen diario de glucocorticoides no debe ser interrumpido por enfermedad. Las dosis que se pierden durante una enfermedad menor como una infección viral, particularmente las que causan vómitos o diarrea, pueden provocar shock y muerte. Para su prevención, los pacientes deben saber aumentar las dosis de glucocorticoides durante la enfermedad, la cirugía u otras formas de estrés grave.
La mayoría de los trastornos genéticos asociados con IS tienen cuadros clínicos característicos que ya son evidentes a edad temprana.
Tabla: Defectos genéticos asociados con insuficiencia suprarrenal
Sin embargo, las personas con ciertos trastornos genéticos pueden presentar una IS de comienzo tardío. A menudo, la hipoplasia suprarrenal congénita se manifiesta en la primera infancia pero puede tardar en hacerse aparente hasta la adolescencia o la juventud.
La adrenoleucodistrofia y la adrenomieloneuropatía son dos fenotipos de un trastorno recesivo ligado a X que afecta a 1 de cada 20.000 varones. Este trastorno se caracteriza por parálisis espástica e IS. La adrenoleucodistrofia comienza en la lactancia o la infancia mientras que la adrenomieloneuropatía suele comenzar en la adolescencia o la juventud y tiene una progresión más leve y lenta. Sin embargo, es importante comprender que la IS puede ser solo un signo del trastorno; el diagnóstico puede confirmarse determinando los ácidos grasos de cadena muy larga. Este trastorno alcanza al 10% de todos los casos de IS.
Como los trastornos hereditarios de la glándula suprarrenal, la mayoría de los defectos hipofisarios causan síntomas en una época temprana de la vida. Sin embargo, los clínicos deben tener en cuenta que los signos y síntomas de algunos de esos trastornos comienzan tardíamente. Por otra parte, la IS secundaria aparece en el 60% de los pacientes con síndrome de Prader-Willi, la causa más común de obesidad relacionada con un síndrome (prevalencia: 1 caso cada 10.000 a 20.000 personas obesas) y se asocia con una tasa muy elevada de muerte súbita (3%). El tratamiento con hidrocortisona durante la fase aguda de la enfermedad puede obviarse a menos que la IS no pueda ser controlada.
Se ha postulado que en los modelos animales, otros genes tienen gran importancia en el desarrollo de la función de las glándulas suprarrenal e hipofisaria. Entre esos genes se hallarían genes morfogénicos, factores de crecimiento, receptores tipo Toll y molécula basureras o carroñeras involucradas en el transporte del colesterol y el estrés oxidativo. La respuesta suprarrenal al estrés esta alterada por la deficiencia de los receptores símil Toll 2 o 4. En los seres humanos se halla un 10% de polimorfismo en el mismo receptor. Todavía no ha quedado establecido si las mutaciones y polimorfismos genéticos que comprenden esos factores predisponen a la IS.
Los fármacos como factores predisponentes de la deficiencia glucocorticoide
Los fármacos pueden causar deficiencia glucocorticoide en el hipotálamo, la hipófisis, las glándulas suprarrenales y también en otros sitios con receptores glucocorticoides y su vía de señalización y metabolismo glucocorticoide periférico
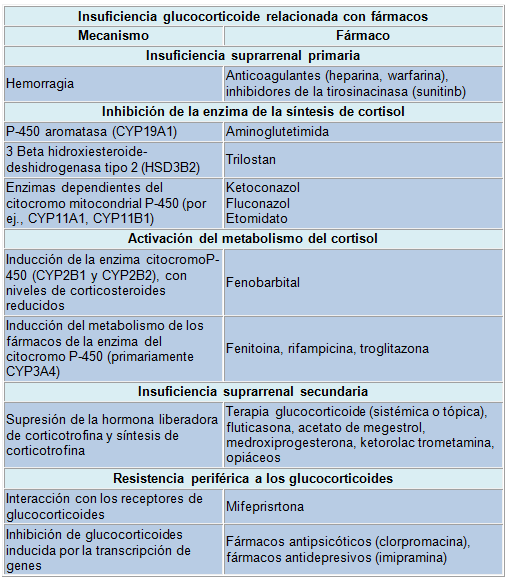
La causa más común de deficiencia de la respuesta suprarrenal es la supresión del eje hipotálamo-hipófiso-suprarrenal secundario al tratamiento con glucocorticoides exógenos. En la actualidad, se calcula que el 1% de las personas de la población general (2,5% en >70 años) está bajo tratamiento prolongado con glucocorticoides por enfermedades crónicas inflamatorias. Dada que la proporción de ancianos va en aumento en la población es posible que estas cifras aumenten. Para evitar una crisis suprarrenal inesperada en ersonas hospitalizadas por una emergencia, los médicos debe saber si el paciente está recibiendo glucocorticoides por razones médicas o en situaciones poco claras. Es posible que los pacientes no relaten espontáneamente su exposición a estos fármacos (atletas, pacientes oncológicos, con afecciones ortopédicas o automedicados con extractos suprarrenales siguiendo consejos aparecidos en Internet con respecto al “síndrome de fatiga suprarrenal”. Otro problema es la falta de control sobre los medicamentos con glucocorticoides de uso tópico que pueden suprimir la función suprarrenal. El uso concomitante de glucocorticoides con inhibidores de CYP3A4, (itraconazol, diltiazem mibefradil y aun el jugo de pomelo), la enzima del citocromo P450 más abundante que interviene en el metabolismo de los fármacos, prolonga la vida media biológica de los glucocorticoides, lo que favorece la supresión de la función suprarrenal. Además de los glucocorticoides, el eje hipotálamo-hipófiso-suprarrenal es inhibido por otros compuestos como el acetato de megestrol y la medroxiprogesterona. Cuando se comiencen a utilizar los activadores de los receptores de glucocorticoides también habrá que tener en cuenta la integridad de dicho eje.
La incidencia de la disfunción suprarrenal ha aumentado, en particular en pacientes tratados con antifúngicos. Estos tratamientos con ketoconazol interfieren con la síntesis de glucocorticoides y por lo tanto, también pueden usarse para el hipercortisolismo en dosis de 400 a 800 mg diarios. Aunque algunos de los antifúngicos nuevos tienen menos efectos adrenostáticos, como el itraconazol y el fluconazol, se han publicado casos de IS después de su administración terapéutica. Por lo tanto, estos compuestos pueden predisponer a la IS durante los estados de mayor requerimiento glucocorticoide, como el estrés severo y cualquier enfermedad grave.
El etomidato, un agente hipnótico potente de uso común, también puede generar niveles bajos de cortisol, aun después de una sola inyección. Por lo tanto, en el caso de una enfermedad grave, el médico debe interrogar acerca del uso de ese fármaco; en caso afirmativo es conveniente considerar el agregado del tratamiento glucocorticoide. Durante el estrés grave del paciente que está recibiendo fármacos que actúan sobre la tirosincinasa es prudente monitorear la función suprarrenal, dado que algunos de esos compuestos (por ej., el sumitinib) han causado disfunción y hemorragia suprarrenal en estudios animales. El mecanismo puede estar relacionado con el hecho de que los antagonistas de los receptores del factor de crecimiento pueden menoscabar la integridad del endotelio, provocando hemorragia en la glándula suprarrenal, altamente vascularizada durante el estrés. Por último, dado que el número de pacientes con enfermedades crónicas es creciente, los médicos deben considerar el efecto aditivo de los fármacos a los efectos de los glucocorticoides. Un ensayo toxicológico in vitro reciente ha mostrado que un número cada vez mayor de compuestos ambientales tienen la capacidad de alterar la esteroideogénesis suprarrenal. Estos compuestos incluyen desde disruptores endógenos (flavonoides fitoestrogénicos) hasta insecticidas (por ej., el lindano). Sin embargo, todavía no ha quedado establecido el efecto sobre la función suprarrenal en seres humanos.
Enfermedades que el clínico debe considerar
Enfermedades que causan IS total
Estas enfermedades son raras. Además de los defectos genéticos mencionados, las causas más comunes de IS son los tumores, hemorragias, infecciones y enfermedad autoinmunes de la hipófisis. Existe evidencia de que el síndrome de Waterhouse–Friderichsen por hemorragia de ambas suprarrenales no solo está provocado por la sepsis meningocócica sino por otras infecciones, como la estafilocócica y otras. Es necesario tener en cuenta al creciente número de infecciones por Staphylococcus aureus resistente a la meticilina y otras infecciones oportunistas. En otra época, la adrenalitis tuberculosa fue la causa más frecuente de la IS primaria, y sigue siendo así en muchos países en vías de desarrollo. En años recientes, hubo un resurgimiento de la adrenalitis tuberculosa como resultado del mayor número de pacientes con síndrome de inmunodeficiencia adquirida. La adrenalitis por citomegalovirus es especialmente común en pacientes con infección por el virus de la inmunodeficiencia humana, y aparte de numerosos patógenos oportunistas, el tratamiento antifúngico puede comprometer aun más la función suprarrenal en estas personas. En el mundo occidental, la deficiencia de glucocorticoides por enfermedad autoinmune da cuenta del 80% de los casos de IS primaria. A menudo, los pacientes con enfermedades autoinmunes, como así algunos de sus familiares, tienen trastornos endocrinos múltiples como parte de un síndrome poliglandular autoinmune. La enfermedad tiroidea autoinmune es la manifestación orgánica más comúnmente observada mientras que el vitiligo, la insuficiencia gonadal primaria, la gastritis atrófica y la diabetes tipo 1 son menos comunes. Las formas subclínicas o latentes puede ser más frecuentes que lo supuesto hasta el momento. En consecuencia, en todos los pacientes con enfermedades endocrinas autoinmunes o trastornos metabólicos hay que pensar en la posibilidad de una desregulación suprarrenal.
El diagnóstico de IS también suele pasar desapercibido en pacientes internados con hiponatremia. Más del 20% de los pacientes con hiponatremia normovolémica tienen IS secundaria, la mayoría de los casos ocasionada por el síndrome de la silla vacía, síndrome de Sheehan o tumores hipofisarios. En estos pacientes, el nivel de hormona antidiurética plasmática está elevado, en general debido a la insuficiencia de glucocorticoides endógenos para suprimir la hormona. El tratamiento de reemplazo con hidrocortisona consigue normalizar rápidamente los niveles séricos de sodio.
Otro problema clínico subdiagnosticado es el hipopituitarismo debido a lesiones cerebrales. La disfunción hipofisaria ocurre en más el 30% de los pacientes con trauma del cerebro y puede no manifestarse hasta pasados meses o años del incidente traumático.
Insuficiencia glucocorticoide relacionada con enfermedades graves
En la actualidad se acepta más la existencia de un proceso que predispone a la IS durante los períodos de mayor estrés de la enfermedad. Para caracterizar estas afecciones se han usado términos tales como “insuficiencia suprarrenal relativa” y, más precisamente, “insuficiencia corticosteroide relacionada con enfermedad grave”. Últimamente, los paneles de expertos y conferencias de consenso, con la intervención de terapistas intensivos, neumonólogos y endocrinólogos, han examinado la importancia clínica de la IS y han brindado recomendaciones para el diagnóstico y el tratamiento. El síndrome ha sido definido como la actividad inadecuada de glucocorticoiides en relación con la gravedad de la enfermedad del paciente y ha sido mucho más investigada en casos de sepsis y shock séptico. La mejor prueba actualmente disponible para establecer el diagnóstico es la prueba de estimulación con 1 µg de corticotrofina, en la cual el cortisol medido a los 30 minutos de la estimulación es <25 µg/dL o hay un incremento por encima de la línea de base <9 µg/dL, lo que representa una respuesta suprarrenal inadecuada. Esta respuesta inadecuada está presente en el 60% de los pacientes con sepsis. Sin embargo, la disminución del nivel de globulina ligada al cortisol en pacientes con sepsis puede moderar el deterioro de la producción activa del cortisol libre. Para definir mejor este síndrome se requiere una prueba endocrina para la IS en pacientes con sepsis u otra enfermedad grave perfeccionada. Es necesario considerar que puede haber factores de error como puede ser variaciones en la obtención de la muestra y los análisis del cortisol, incluyendo la interferencia con anticuerpos. Las determinaciones del cortisol libre o la implementación tan difundida de la espectrometría de masa podría ayudar a compensar estas limitaciones analíticas.
Los mecanismos de la supresión suprarrenal en la sepsis siguen siendo poco claros pero se consideran importantes las citocinas como el factor de necrosis tumoral a u otros pépticos derivados de las células sanguíneas —conocidas como corticostatinas— que pueden competir con la corticotrofina en su receptor, influir la regulación suprarrenal durante la inflamación, inducir la resistencia tisular a los glucocorticoides o poseer ambos efectos. Para que las células de la corteza suprarrenal respondan adecuadamente al estrés grave de la inflamación, la comunicación celular dentro de la glándula suprarrenal debe estar intacta. Esto comprende un estrecho intercambio entre las células corticosuprarrenales y las células intraadrenales inmunológicas. Se sostiene que los neuropéptidos, los neurotransmisores, el estrés oxidativo, el flujo sanguíneo suprarrenal alterado y la deficiencia del sustrato debida a los niveles bajos del colesterol LDL y las interacciones farmacológicas afectan la integridad suprarrenal. La septicemia misma y los medicamentos usados durante el tratamiento pueden interferir con la señalización del receptor asociado con los microdominios de la membrana, con el mecanismo del transporte y almacenamiento del colesterol, las enzimas involucradas en la esteroideogénesis y la función mitocondrial tan importante en la esteroideogénesis. Por otra parte, durante el shock séptico, la irrigación sanguínea alterada de la parte distal puede inducir a la isquemia o necrosis hipofisaria, o ambas produciéndose una acumulación de óxido nítrico, superóxido o, neuropéptidos centrales o prostaglandinas que contribuyen a disminuir las hormonas hipotálamo-hipofisaria en pacientes con sepsis.
Las consecuencias clínicas de la función suprarrenal alterada en pacientes con sepsis no se conocen bien. Un estudio importante reciente comprobó que si bien la hidrocortisona ayuda a revertir el shock séptico no mejora la supervivencia. Por lo tanto, el uso general de glucocorticoides en pacientes con sepsis no parece estar justificado. Otros factores que pueden que pueden ser responsables de los resultados conflictivos son la gravedad de la sepsis, la duración del tratamiento y el uso o no uso de fludrocortisona para el tratamiento del hipoaldosteronismo. Es muy importante llegar a una mejor comprensión del verdadero patrón de secreción de cortisol durante la enfermedad grave y la farmacocinética de las terapias de reemplazo con hidrocortisona. Por último, los efectos adversos del reemplazo de glucocorticoides sobre la resistencia a la insulina, el catabolismo proteico y la inmunosupresión pueden estar agravados por la nutrición parenteral con alto contenido graso ya que recientemente se ha comprobado que los lípidos aumentan la acción de los glucocorticoides. De acuerdo con la evidencia disponible, se recomienda dosis moderadas de hidrocortisona (200-300 mg/día), independientemente de los resultados de las pruebas suprarrenales, tan pronto como se diagnostica el shock séptico en pacientes que siguen hipotensos a pesar de una administración apropiada de líquidos y agentes vasopresores. La evidencia actual es insuficiente para recomendar el reemplazo de otros esteroides que están suprimidos en pacientes con sepsis, como los mineralocorticoides y los andrógenos suprarrenales.
Además del deterioro de la regulación glucocorticoide suprarrenal, en los pacientes gravemente enfermos frecuentemente coexiste el hipoaldosteronismo. Esta condición probablemente no proviene de un efecto selectivo sobre la zona glomerular o a síntesis de aldosterona; es más, es posible que ciertos mecanismos que llevan a la insuficiencia glucocorticoide sean los responsables del hipoaldosteronismo. El papel de la suplementación mineralocorticoide en el tratamiento de pacientes gravemente enfermos todavía está en la etapa de investigación. Varios estudios aleatorizados han evaluado el papel de la lesión pulmonar aguda o del síndrome de distrés respiratorio agudo. Un hallazgo constante de estos estudios fue que dicho tratamiento logró una resolución acelerada de los trastornos. Por otra parte, datos preliminares indican que los glucocorticoides tienen un efecto beneficioso en pacientes con pancreatitis grave y aquellos que han sufrido un trauma con shock hemorrágico, como así los pacientes sometidos a cirugía cardíaca y quienes están conectados a la ventilación mecánica.
Se ha comprobado que los pacientes con enfermedad hepática tienen alteraciones suprarrenales. Los signos de la IS están presentes en el 33% de los pacientes con insuficiencia hepática aguda, el 65% de los pacientes con enfermedad crónica del hígado y sepsis y el 92% de os pacientes que se han sometido a un trasplante hepático. Por lo tanto, se ha acuñado el término “síndrome hepatorrenal.” Se ha sugerido que la inmunosupresión con glucocorticoides en los receptores de trasplante hepático ha enmascarado el síndrome. Los pacientes con enfermedades hepáticas tienen niveles muy bajos de lipoproteínas, por lo que el poco sustrato puede inducir el síndrome de agotamiento suprarrenal. Sin embargo, una reducción del cortisol total puede reflejar un descenso de la globulina ligada al cortisol más que un descenso del cortisol libre. No obstante, en los pacientes con enfermedades hepáticas se debe estar muy atento a la aparición de síntomas y signos de IS y pueden beneficiarse con el tratamiento de reemplazo glucocorticoide.
♦ Traducción y resumen objetivo: Dra. Marta Papponetti. Especialista en Medicina Interna