La neuropatía periférica diabética (NPD), también conocida como polineuropatía simétrica distal (PSD), es una complicación de la diabetes y se caracteriza por síntomas y/o signos de disfunción nerviosa periférica, después de haber descartado otras causas. La diabetes mellitus es una causa importante de neuropatía periférica y representa casi la mitad de todos los casos. La incidencia de NPD es elevada en los diabéticos, como lo demuestra un estudio poblacional llevado a cabo en la Clínica Mayo que comprobó que el 47% de los diabéticos tenían PSD. Otro estudio, que definió a la neuropatía como la ausencia bilateral del reflejo aquileano y/o la pérdida de la sensibilidad vibratoria, informó una prevalencia del 70% en los pacientes con diabetes tipo 2 durante 25 años o más. Teniendo en cuenta que la prevalencia de diabetes en los Estados Unidos es de aproximadamente 24 millones de personas, estos estudios sugieren que al menos 15 millones de estadounidenses desarrollarán NPD en su vida. Si se incluyen las personas con prediabetes, este número puede superar los 20 millones. Estudios recientes han estimado que la prevalencia de la NPD dolorosa en los diabéticos es del 20% de lo que se deduce que casi 5 millones de personas en los Estados Unidos sufren NPD sintomática.
Muchos de estos pacientes, como así la mayoría de los que sufren NPD indolora no son concientes de su neuropatía. El dolor neuropático es particularmente peligroso porque los pacientes pueden no ser capaces de detectar una lesión en el pie (por ej., se queman en un baño caliente o se lastiman con un objeto punzante, o desarrollan una ampolla por un zapato apretado). Si la NPD no es reconocida y se trata de manera agresiva y rápida, estas heridas se transforman en úlceras del pie, infecciones e incluso, pueden motivar la indicación de una amputación. Por esta razón, a menudo se la conoce como la "complicación olvidada" de la diabetes. Los médicos deben estar atentos durante el examen del paciente diabético ara evitar pasar por alto esta complicación microvascular importante.
Factores de riesgo
Los factores de riesgo no modificables de complicaciones microvasculares diabéticas, incluyendo la NPD, son la mayor edad, el perfil genético (por ej., el polimorfismo del gen de la aldosa reductasa), la mayor antigüedad de la diabetes, y la talla. Las personas más altas son más susceptibles de arrollar NPD porque sus nervios periféricos son más largos. Dado que los hombres tienden a ser más altos que las mujeres, no es de sorprender que los hombres sean más afectados por la NPD que las mujeres. Los factores de riesgo modificables de NPD son la hiperglucemia, la hipertensión, la dislipidemia, el tabaquismo y el consumo excesivo de alcohol. El European Diabetes Prospective Complications, un estudio prospectivo y multicéntrico halló que la NPD tenía una estrecha relación tanto con la duración de la diabetes como con el nivel de hemoglobina A1c. Otros factores de riesgo potencialmente modificables con significación estadística son los niveles de colesterol total, de las lipoproteínas de baja densidad y de los triglicéridos, el índice de masa corporal, el antecedente de tabaquismo, la hipertensión arterial, la microalbuminuria y, las enfermedades cardiovasculares. Aunque muchos médicos saben que un control correcto de la glucemia puede prevenir o mejorar la NPD, la mayoría no tiene en cuenta que se puede lograr lo mismo con el control de la lipidemia y la cesación de fumar.
Patogénesis
Como ocurre con otras complicaciones diabéticas microvasculares, como la retinopatía y la nefropatía, se cree que la NPD es el resultado de múltiples factores. Los mecanismos posibles para el desarrollo de la NPD son la glucosilación de las proteínas neuronales, la microangiopatía, el desarrollo de autoanticuerpos neuronales y la isquemia por engrosamiento de la membrana basal de los capilares del nervio (vasa nervorum). Las anomalías de la vía de los polioles y del metabolismo del mioinositol como así la proteincinasa C3 que conduce a la desmielinización neuronal también han sido descritos en la NPD.
Mecanismos propuestos de la neuropatía pèriférica diabética
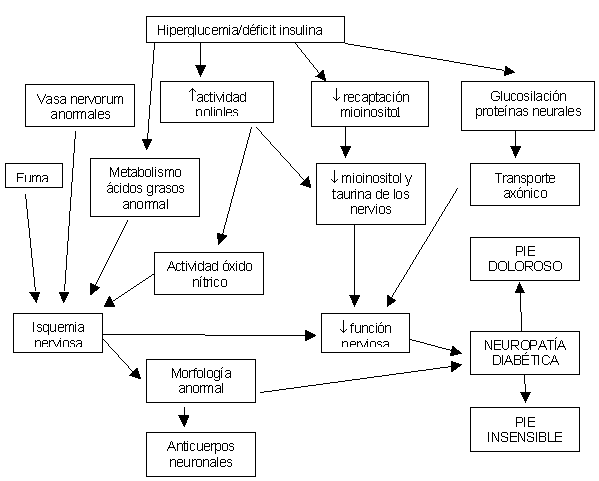
No se comprende la razón por la cual es trastorno provoca dolor en los pies en la minoría de los pacientes y porqué la mayoría de los casos tiene una neuropatía indolora.
Evaluación y diagnóstico
Síntomas e historia clínica
La neuropatía diabética puede presentarse difusa o focal. Las neuropatías focales, incluyendo la neuropatía por atrapamiento (por ej., el síndrome del túnel carpiano), la mononeuropatía múltiple, las neuropatías craneanas, las plexopatías y, rara vez, la polirradiculopatía, no se abordan en esta revisión. La neuropatía difusa o polineuropatía generalizada se caracteriza por el tipo de fibras afectadas predominante: fibras sensitivas pequeñas, fibras sensitivas grandes y, fibras sensitivas grandes y pequeñas o polineuropatía sensitivo-motora. A menudo, la NPD se presenta con dolor neuropático, pero también puede presentarse con alteraciones del equilibrio o de la marcha.
La Asociación Internacional para el Estudio del Dolor ha descrito al dolor neuropático como el "dolor iniciado o causado por una lesión primaria o disfunción del sistema nervioso." Sin embargo, una revisión reciente propuso redefinir el dolor neuropático como “el "dolor que se origina como consecuencia directa de una lesión o enfermedad del sistema nervioso sensitivo-motor." El dolor neuropático es diferente en calidad y forma de aparición del dolor nociceptivo, al que los pacientes suelen relacionar con una lesión específica de los tejidos blandos o musculoesqueléticos. En general, el dolor neuropático de la NPD tiene un comienzo gradual e insidioso. En los pacientes con NPD se han descrito 3 tipos diferentes de dolor. El dolor disestésico, caracterizado por una sensación anormal desagradable, ya sea espontánea o evocada; a menudo se presenta como ardor o picazón intensos. El dolor parestésico, que se presenta como pinchazos de "alfileres y agujas" o el pasaje de electricidad o el corte por un cuchillo. Al dolor muscular se lo describe como un dolor profundo, pesadez, calambres o como "calambres nocturnos." Cada uno de estos tipos de dolor puede tener diferente patogenia y distribución anatómica. Aunque la mayoría de los pacientes tiene una neuropatía mixta o pansensitiva, algunas veces presentan un compromiso selectivo. El dolor con participación de las fibras sensitivas pequeñas suele ser descrito como el dolor de una quemadura superficial, mientras que la participación de las fibras sensitivas grandes se asocia más frecuentemente con parestesias, pérdida del reflejo aquileano y disminución del equilibrio.
En general, el dolor de la NPD es peor en reposo y por la noche, posiblemente porque el sistema nervioso no se "distrae" en horas nocturnas con la multiplicidad de otras demandas (por ej. visuales, de locomoción o del pensamiento) como lo hace en forma constante durante el día. Los pacientes diabéticos, cuyo dolor es peor al caminar o estar de pie, deben ser evaluados para detectar anomalías, las que por lo general son simétricas y distales. Dado que la NPD representa la “muerte” de los nervios y afecta en primer lugar a la porción distal de las extremidades, se presenta con una distribución en “media " y en "guante”. Los pacientes con NPD pueden experimentar alodinia, es decir, dolor por un estímulo que normalmente no provoca dolor (por ej., dolor fuerte causado por el contacto de la sábana con los pies desnudos), o hiperalgesia, que es una respuesta mayor a un estímulo que normalmente no provoca dolor (por ej., dolor que se produce por un roce suave). Los pacientes también pueden presentar otras sensaciones anormales: “siento los zapatos demasiado apretados" , "tengo la sensación de caminar sobre piedras" o, "siento que los pies están en agua helada."
Signos y examen neurológico
El examen físico de un paciente con sospecha de NPD comienza con la inspección de las extremidades inferiores. La observación puede revelar piel seca y agrietada y/o piel fría (a pesar de tener buenos pulsos). Estas anomalías resultan del componente autonómico de la NPD, incluyendo la pérdida de las glándulas sudoríparas y la desviación de la sangre de la piel. Una de las características hallada en el examen neurológico es la pérdida de los reflejos tendinosos profundos. El reflejo aquileano primero disminuye y luego desaparece. El reflejo patelar puede estar conservado hasta las etapas más avanzadas de la enfermedad, cuando las manos comienzan a afectarse. El diapasón de 128 Hz es el instrumento de elección para verificar la presencia o ausencia de la sensibilidad vibratoria en los pies. Inicialmente, los pacientes presentan déficit de la percepción de la vibración en los dedos gordos, pero cuando el déficit progresa en sentido proximal, también hay hipoestesia en el dorso del pie, el tobillo y la región tibial media.
El uso del monofilamento de Semmes-Weinstein ayudó a definir los grados de pérdida de la sensibilidad en los pies y las manos de los pacientes con NPD. Para utilizar el dispositivo correctamente, el examinador debe colocar la punta del monofilamento perpendicular a la superficie plantar del dedo gordo, tratando que el filamento no se deslice por la piel o tenga un contacto repetitivo en el sitio. Para un examen preciso se deben evitar las áreas con callosidades. Los pacientes deben ser capaces de sentir el monofilamento con los ojos cerrados. Cuanto más grueso es el monofilamento (número mayor), más fuerza hay que ejercer para pasarlo. Los pacientes sin neuropatía deberían ser capaces de sentir un monofilamento de 3,61 (equivalente a 0,4 g de presión lineal). La incapacidad para percibir los monofilamentos de 4,17 (equivalente a 1 g de presión lineal) o superior se considera compatible con neuropatía (de fibras grandes). La incapacidad para percibir un monofilamento de 5,07 (equivalente a 10 g de la fuerza lineal) es coherente con una neuropatía grave y la pérdida de la sensibilidad propioceptiva.
Lamentablemente, la mayoría de los médicos solo conocen o tienen acceso a los monofilamentos de 5,07 y existe la idea generalizada de que si el paciente puede sentir este tamaño de dispositivo entonces no se trata de una NPD. La pérdida de fibras nerviosas pequeñas puede ser detectada mediante pinchazos, aunque la pérdida del gradiente de percepción del frío (utilizando tubos de ensayo con agua caliente y fría o la parte plana de un diapasón) puede ser más fácil de definir que la pérdida de la percepción de un pinchazo. La última modalidad sensorial que se altera en esta neuropatía es la pérdida del gradiente distal de la sensibilidad al sentido de la posición. Sin embargo, éste es un hallazgo muy común en muchos pacientes con NPD de larga data, como también lo son las deformidades de los pies. Aunque se trata principalmente un trastorno sensitivo, la NPD se acompaña muchas veces de alteraciones motoras causantes de los dedos "en martillo" o el "pie en garra". La pérdida de la fuerza de los músculos flexores del pie permite que los extensores del pie no tengan oposición, lo que hace que los dedos se retraigan hasta adoptar la posición en martillo o pezuña. Esta deformidad redistribuye el peso sobre la cabeza insensible del metatarso, lo que en gran medida predispone al individuo a la ulceración neuropática. Otros hallazgos son la artropatía de Charcot, que limita la movilidad articular, provoca una posición anormal de los pies, callos y amputaciones parciales del pie.
La alteración de las manos por la NPD se produce, en general, varios años después de haberse afectado las extremidades inferiores. Cuando los pacientes se han vuelto completamente insensibles en su zona medio tibial comienzan a perder la sensibilidad en sus manos. Inicialmente, la mayoría de los pacientes se queja de parestesias en las manos. Más tarde, como las manos se vuelven más débiles, los pacientes pueden quejarse de que los objetos se les caen y su escritura manual se altera. Se hace evidente la pérdida de la masa muscular de las manos (desgaste de de los músculos intrínsecos de la mano).
Pruebas de laboratorio
La definición por consenso de la NPD dice que es necesario hacer el diagnóstico diferencial con otros trastornos causantes de neuropatía periférica antes de atribuirla a la diabetes.
| Causas de neuropatía periférica |
| Diabetes Alcoholismo Hepatopatía no alcohólica Enfermedad crítica Neuropatía atoimmune (pore j.l, polirradiculoneuropatía desmielinizante inflamatoria crónica) SIDA Fármacos (porej., isoniazida, cisplatino) Toxinas (por ej., arsénico) HIpotiroidismo Deficiencia de B12 Uremia Linfoma Mieloma múltiple Malabsorción (por ej., enfermedad celíaca) Hereditaria Enfermedad de Lyme Amiloidosis Trastornos del tejido conectivo (por ej., artritis reumatoidea) |
La evaluación del paciente debe incluir exámenes básicos de laboratorio, como la concentración sérica de la hormona estimulante del tiroides, la electroforesis de las proteínas séricas, y la concentración de la vitamina B12, para buscar otras causas de polineuropatía. Los pacientes con diabetes mellitus también desarrollan otras enfermedades como el hipotiroidismo, la deficiencia de vitamina B12, la enfermedad celíaca, y la uremia, las que pueden causar o contribuir al desarrollo de la neuropatía periférica. También se destaca que la prediabetes (anteriormente denominada intolerancia a la glucosa o deterioro de la glucemia en ayunas) también puede coexistir con la NPD. De hecho, es común que los neurólogos ordenen una prueba de tolerancia a la glucosa ante un paciente con diagnóstico de neuropatía periférica idiopática.
Pruebas de Diagnóstico
Son necesarias una anamnesis y una exploración física correctas para confirmar la pérdida de la sensibilidad y detectar alteraciones motoras coexistentes. Sin embargo, dado que la NPD es un diagnóstico de exclusión, se deben tener en cuenta otros trastornos no neuropáticos como causa de neuropatía periférica. Si los signos neurológicos predominan en las extremidades superiores y son de carácter más motor que sensitivo, o el predominio es unilateral, entonces el diagnóstico de NPD no es el primer diagnóstico presuntivo. En estos casos, la derivación al neurólogo para efectuar un electromiograma y estudios de conducción nerviosa permitirá descartar atropamientos nerviosos focales, radiculopatía lumbar, polirradiculoneuropatía inflamatoria desmielinizante crónica y otras enfermedades. Sin embargo, aún estos estudios tienen limitaciones, dado que solo evalúan las fibras nerviosas grandes. Un paciente puede tener dolor neutopático y estudios normales, o tener estudios anormales sin dolor. En estos casos, para establecer el diagnóstico y el tratamiento adecuado es necesario recurrir a estudios sofisticados.
Tratamiento
El dolor es conducido principalmente por las fibras C sin mielina dentro de los nervios periféricos sensitivos, los cuales entran en el asta dorsal de la médula espinal. La lesión del nervio periférico provoca la liberación de varios neurotransmisores en la región del asta dorsal, lo que a su vez provoca un aumento de la entrada de calcio en las células, en un proceso conocido como centro de sensibilización. Por último, la médula espinal se convierte en hipersensible a las fibras aferentes. El mecanismo del dolor neuropático periférico ayuda a explicar porqué pueden ser beneficiosas diferentes clases de fármacos para el tratamiento de dolor neuropático.
Tratamiento farmacológico
El tratamiento farmacológico de la NPD dolorosa es limitado ya que los fármacos no eliminan por completo el dolor neuropático. Se considera que un medicamento tiene una respuesta satisfactoria si reduce un 50% el puntaje del dolor en la escala de dolor (por ej., si disminuye de 8 a 4). Algunos pacientes no responden a ciertos fármacos y otros experimentan efectos adversos aún con las dosis más bajas. El objetivo de la farmacoterapia en la NPD no es erradicar el dolor sino lograr que el paciente pueda dormir y permanecer dormido durante la noche. El próximo objetivo sería mejorar su funcionamiento diurno y la calidad de vida. Idealmente, antes de iniciar el tratamiento, el médico debe analizar estos objetivos con el paciente.
| Fármacos principales para el tratamiento de la neuropatía periférica diabética | ||||
| Categoría | Compuesto | Dosis (inicio/Mx./mg) | Efectos adversos | Comentarios |
| ATC | Amitriptilina y otro TCA | 10/150 | Anticolinérgicos, sedación, aumento de peso | Precaución a mayor edad |
| Opiáceos débiles | Tramadol | 50/400 | Sedación, estreñimiento, mareos | Forma genérica, se puede tomar c/6 hs. |
| ISRSN | Duloxetina | 30/120* | Xerostomía, somnolencia, GI | Aprobado por FDA |
| Anti-convulsivantes | Gabapentina | 300/3.600* | Somnolencia, ataxia, mareos | Forma genérica, 3 veces/día, la dosificación |
| Pregabalina | 150/600* | Ataxia somnolencia, mareos, edema, aumento de peso | Aprobado por FDA | |
GI: gastrointestinal. ISRSN: inhibidores de la recaptación de serotonina-noradrenalina
*Disminuir la dosis si el índice de filtrado glomerular <60 ml / min.
En Estados Unidos, solo la pregabalina y la duloxetina han sido específicamente aprobados para el tratamiento de la NPD dolorosa.
Antiinflamatorios no esteroides (AINE) y tramadol. Los AINE pueden ser útiles para algunos pacientes con dolor leve de la NPD y función renal normal. Un estudio pequeño (n=18), con control ciego simple, demostró que los AINE ibuprofeno y sulindac fueron mejores que el placebo para la NPD dolorosa (aproximadamente la mitad de los pacientes tuvo buena respuesta). El único fármaco más eficaz que los AINE es el tramadol. Este compuesto es tanto un agonista opioide como un activador de la inhibición monoaminérgica antálgica medular. Estudios multicéntricos, aleatorizados, doble ciego, controlados con placebo, han hallado que los pacientes tratados con tramadol, en una dosis promedio diaria de 210 mg/día, tuvieron alivio del dolor y mejoraron el funcionamiento físico y social en forma estadísticamente significativa que duró hasta 6 meses.
Antidepresivos. Los antidepresivos tricíclicos (ATC), han sido, desde hace muchos años, fundamentales para el tratamiento de la NPD, pero hoy en día se utilizan con menos frecuencia debido a sus importantes efectos secundarios anticolinérgicos, especialmente en los ancianos. Los estudios han demostrado que los ATC amitriptilina y desipramina proporcionan un alivio entre moderado y bueno en casi al 70% de los pacientes con dolor. Estos medicamentos alivian el dolor independientemente de sus efectos antidepresivos. Al tratar pacientes delgados o de edad avanzada es mejor comenzar con una dosis de 10 mg al acostarse, e ir aumentando poco a poco. El alivio del dolor no se produce hasta varias semanas después de iniciado el tratamiento. La hipotensión ortostática, la xerostomía, la somnolencia y el aumento de peso son efectos secundarios comunes que limitan el uso de esta clase de medicamentos. Existe una nueva clase de antidepresivos como la duloxetina y los inhibidores selectivos de la recaptación de serotonina-noradrenalina. La duloxetina fue el primer fármaco aprobado por la Food and Drug Administration (FDA) para ser utilizado en el tratamiento del dolor por NPD. El fármaco tiene una vida media de 12 horas y puede ser administrado 1 vez por día. Ensayos clínicos controlados y aleatorizados de duloxetina han demostrado una reducción excelente del puntaje del dolor mientras que menos del 20% de los pacientes abandona el medicamento por efectos adversos. A diferencia de los ATC, la duloxetina no provoca aumento de peso. Los efectos colaterales más frecuentes son las náuseas, el estreñimiento, la boca seca y la somnolencia. La dosis de 30 mg/día dividida en 2 tomas durante la primera semana disminuye estos efectos colaterales.
Anticonvulsivantes. Los anticonvulsivantes de primera generación como la fenitoína y la carbamazepina ya no se utilizan para la NPD dolorosa porque son menos eficaces y tienen más efectos secundarios que los anticonvulsivantes de segunda generación. La gabapentina y su derivado más reciente, la pregabalina, se unen a la subunidad α2-δ de los canales de calcio de voltaje activado. La pregabalina tiene 6 veces mayor afinidad de unión que la gabapentina, con una biodisponibilidad superior al 90%, lo que significa que logra un alivio máximo del dolor dentro de las 48 horas. La gabapentina tiene una biodisponibilidad muy baja y la cantidad de fármaco que se absorbe es dosis dependiente, es decir, a mayor dosis del fármaco menor es la fracción absorbida). Debe administrarse 3 veces por día, mientras que la pregabalina se puede utilizar 2 o 3 veces por día. La FDA aprobó el tratamiento de la NPD dolorosa con pregabalina, en una dosis máxima de 300 mg/día mientras que para la fibromialgia aprobó 450 mg/día y para la neuralgia postherpética, 600 mg/día. Los efectos secundarios principales de la gabapentina son los mareos y la somnolencia, efectos éstos que también se observan con la pregabalina y son muy dosis dependiente. La pregabalina también puede causar edema (especialmente en pacientes que toman una tiazolidinadiona) y/o aumento de peso. Los especialistas han demostrado que los pacientes que no pueden controlar su dolor con gabapentina han respondido a dosis equivalentes de pregabalina. El factor de conversión entre estos 2 fármacos es 6:1, de modo que para que el efecto sea comparable, por ejemplo, para un paciente que toma 1.800 mg de gabapentina se requieren 300 mg de pregabalina. Aunque la gabapentina está disponible como forma genérica, el hecho de requerir dosis mayores tiende a minimizar el ahorro de costo cuando se la compara con la pregabalina. La pregabalina pasa a la circulación sistémica y se elimina por excreción renal en forma inalterada, con una vida media de unas 6,3 horas. Para los pacientes con un índice de filtrado glomerular < 60 mL/min, ambos medicamentos deben administrarse en dosis mucho menores. Debido a que la pregabalina se puede eliminar mediante la hemodiálisis, después de cada de 4 horas se debe administrar una dosis suplementaria de 25 mg.
Tratamiento combinado. Si el paciente no responde a las dosis máximas de cualquiera de los medicamentos de primera o segunda línea, se aconseja combinar 2 o 3 fármacos diferentes entre sí (por ej., pregabalina y duloxetina, o más bien, amitriptilina o tramadol). Si la combinación no brinda resultados satisfactorios, se aconseja derivar al paciente a una clínica del dolor antes de recetar narcóticos, como la oxicodona de liberación controlada.
Ácido alfa-lipoico. Cabe señalar que ninguno de los fármacos descritos afecta al proceso neuropático subyacente, sino que proporcionan un alivio sintomático, el cual se detiene tan pronto como se suspende el medicamento. La esperanza es que mientras se hace el tratamiento del dolor se pueda ir controlando mejor la glucemia y se proceda a la cesación de fumar. Varios ensayos clínicos han comprobado que el ácido alfa-lipoico, disponible en los Estados Unidos como un suplemento de venta libre, puede en realidad mejorar el proceso de la enfermedad subyacente como así mejorar el dolor. En un estudio, 600 mg de ácido alfa-lipoico, 3 veces por día, durante 5 semanas, mejoró el dolor, las parestesias y la insensibilidad.
Productos tópicos y tratamiento no farmacológico
Los productos tópicos para el tratamiento de la NPD dolorosa son el parche de lidocaína al 5% y la capsaicina, el principio activo presente en los ajíes picantes. Cuando se aplica en la piel durante un lapso prolongado, la capsaicina reduce la sustancia P, un neuropéptido endógeno necesario ara la propagación del dolor. Lamentablemente, la mayoría de los pacientes encuentra difícil su uso ya que el fármaco debe aplicarse en las zonas dolorosas 4 veces por día.
Asimismo, el parche de lidocaína, efectivo para el tratamiento del dolor posherpético en el tórax, es de difícil aplicación en el pie para tratar el dolor de la NPD. El tratamiento no farmacológico incluye la fisioterapia con estimulación eléctrica nerviosa transcutánea, acupuntura y el apoyo psicológico. Para aliviar el dolor en los pacientes con NPD muy refractaria se han utilizado procedimientos neuroquirúrgicos (estimulación de la médula espinal) y ortopédicos (descompresión del túnel tarsiano).
Tratamiento del paciente con insensibilidad
El Consenso Internacional del Pie Diabético ha identificado 5 elementos clave para el manejo del pie diabético. Estos incluyen:
1. La inspección y el examen sistemático de los pies.
2. La identificación del pie en riesgo.
3. La educación del paciente, su familia, y proveedores de salud.
4. El uso de calzado apropiado.
5. El tratamiento de la patología no ulcerosa.
El uso de un calzado adecuado es fundamental para prevenir las úlceras en los pacientes con pie insensible, deformidades, o antecedentes de una úlcera podal. Para ayudar en este proceso, los médicos deben remitir a los pacientes diabéticos que necesitan un calzado personalizado a cualquier podólogo experimentado u ortopedista certificado. Dicho calzado puede disminuir la tasa de riesgo de ulceración de un 60% a un 20% en más de 3 años.
Resumen
La neuropatía diabética es un importante problema de salud pública. Aunque hoy en día hay mayor conocimiento de la patogénesis, las manifestaciones clínicas y el tratamiento de la NPD, se necesitan más investigaciones para ampliar el conocimiento sobre su etiología y patogénesis y descubrir cuáles son los mejores métodos para prevenir la aparición y progresión de este trastorno, independientemente del control de la glucosa. Los clínicos deben estar atentos, interrogando acerca de los síntomas neurológicos y examinar los pies de los pacientes para detectar signos de NPD. Los pacientes con signos proximales o unilaterales deben ser sometidos a una evaluación neurológica completa. Para los pacientes con NPD, es esencial hacer un mejor control de la glucosa y prestar atención a otros factores de riesgo modificables, para prevenir o mejorar la morbilidad. El dolor neuropático se debe tratar agresivamente con medicamentos aprobados por la FDA para esta afección. Se debe hacer periódicamente el examen de los pies y es obligatorio remitir al podólogo a los pacientes con alto riesgo de tener pie diabético. La NPD es una complicación de la diabetes que nunca debe ser "olvidada".
♦ Traducción: Dra. Marta Papponetti. Esp. Medicina Interna.
Referencias
1. Boulton AJ, Gries FA, Jervell JA. Guidelines for the diagnosis and outpatient management of diabetic peripheral neuropathy. Diabet Med 1998;15:508–14.
2. Dyck PJ, Karnes JL, O’Brien PC, et al. The Rochester Diabetic Neuropathy Study: reassessment of tests and criteria for diagnosis and staged severity. Neurology 1992;42:1164–70.
3. Mohan V, Vijayaprabha R, Rema M. Vascular complications in long-term Southern Indian NIDDM of over 25 years duration. Diabetes Res Clin Pract 1996;31:133–40.
4. Schmader KE. Epidemiology and impact on quality of life of postherpetic neuralgia and painful diabetic neuropathy. Clin J Pain 2002;18:350–4.
5. Tanenberg RJ, Pfeifer MA. Neuropathy: the “forgotten” complication. Diabetes Forecast 2000;53:56–60.
6. Tasfaye S, Chaturvedi N, Eaton S, et al. Vascular risk factors and diabetic neuropathy. N Engl J Med 2005;352:341–50.
7. Vinik AI, Mehrabyan A. Diabetic neuropathies. Med Clin N Am 2004 88:947–99.
8. Tanenberg RJ, Donofrio PD. Neuropathic problems of the lower extremities in diabetic patients. In: Bowker JH, Pfeifer MA, editors. Levin and O’Neal’s the diabetic foot, 7th ed. St. Louis: Mosby; 2008.
9. International Association for the Study of Pain. IASP pain terminology. Available at www.iasp-pain.org/AM/Template.cfm?Section=Pain_Definitions. Accessed 3 Nov 2009.
10. Treede RD, Jensen TS, Campbell JN, et al. Neuropathic pain: redefinition and a grading system for clinical and research purposes. Neurology 2008;70:1630–5.
11. Baron R. Peripheral neuropathic pain: from mechanisms to symptoms. Clin J Pain 2000;16(2 suppl):S12–20.
12. Horowitz SH. The diagnostic workup of patients with neuropathic pain. Med Clin North Am 2007;91:21–30.
13. Obata K, Yamanaka H, Kobayashi K, et al. The effect of site and type of nerve injury on the expression of brain-derived neurotrophic factor in the dorsal root ganglion and on neuropathic pain behavior. Neuroscience 2006;137:961–70.
14. Selvarajah D, Wilkinson ID, Emery CJ, et al. Early involvement of the spinal cord in diabetic peripheral neuropathy. Diabetes Care 2006; 29:2664–9.
15. Cohen KL, Harris S. Efficacy and safety of nonsteroidal anti-inflammatory drugs in the therapy of diabetic neuropathy. Arch Intern Med 1987;147:1442–4.
16. Harati Y, Gooch C, Swenson M, et al. Maintenance of the long-term effectiveness of tramadol in treatment of the pain of diabetic neuropathy. J Diabetes Complications 2000;18:601–13.
17. Max MB, Lynch SA, Muir J, et al. Effects of desipramine, amitriptyline, and fluoxetine on pain in diabetic neuropathy. N Engl J Med 1992;326:1250–6.
18. Goldstein DJ, Lu Y, Detke MJ, et al. Duloxetine vs. placebo in patients with painful diabetic neuropathy. Pain 2005;116:109–18.
19. Goldstein DJ, Lu Y, Detke MJ, et al. Duloxetine vs. placebo in patients with painful diabetic neuropathy. Pain 2005;116:109–18.
20. Guay DR. Pregabalin in neuropathic pain: a more “pharmaceutically elegant” gabapentin? Am J Geriatr Pharmacother 2005;3:274–87.
21. Ziegler D. Painful diabetic neuropathy: treatment and future aspects. Diabetes Metab Res Rev 2008;(Suppl 1):S52–7.
22. Stacey BR, Dworkin RH, Murphy K, et al. Pregabalin in the treatment o refractory neuropathic pain: results of a 15-month open-label trial. Pain Med
2008;9:1202–8.
23. Ziegler D, Ametov A, Barinov A, et al. Oral treatment with alpha-lipoic acid improves symptomatic diabetic polyneuropathy: the SYDNEY 2 trial. Diabetes Care 2006;29:2365–70.
24. Tesfaye S, Watt J, Benbow SJ, et al. Electrical spinal-cord stimulation for painful diabetic peripheral neuropathy. Lancet 1996;348:1698–701.
25. Valdivia JM, Dellon AL, Weinand ME, Maloney CT. Surgical treatment of peripheral neuropathy: outcomes from 100 consecutive decompressions. J Am Podiatr Med Assoc 2005;95:451–4.
26. Apelqvist J, Bakker K, van Houtum WH, Schaper NC; International Working Group on the Diabetic Foot (IWGDF) Editorial Board. Practical guidelines on the management and prevention of the diabetic foot. Diabetes Metab Res Rev 2008;24 Suppl 1:S181–7.
27. Cavanaugh PR, Owings TM. Nonsurgical strategies for healing and preventing recurrence of diabetic foot ulcers. Foot Ankle Clin 2006;11:735–43.
28. Centers for Medicaid and Medicare Services. Diabetes self-management, supplies, and other medical services—provider resources. Available at: www.cms.hhs.gov/DiabetesSelfManagement/02_ProvResources.asp. Accessed 3 Nov 2009.