Introducción
La tiroidectomía para enfermedad benigna es el procedimiento quirúrgico endocrinológico más comúnmente efectuado en todo el mundo [1]. La tiroidectomía subtotal bilateral [TSB) ha sido la operación preferida para la enfermedad tiroidea benigna por muchos años [2]. Por otro lado, un número cada vez mayor de tiroidectomías totales (TT) es realizado en la actualidad, en unidades de cirugía endocrinológica con alto volumen de pacientes, y las indicaciones para ese procedimiento incluyen no sólo al cáncer tiroideo, sino también a la enfermedad de Graves y al bocio multinodular tanto tóxico como no tóxico [3-12].
El razonamiento para efectuar una TT para patología tiroidea benigna, incluye la erradicación completa de la enfermedad y evitar el riesgo sustancial de una reoperación en caso de bocio recidivado [3-8,12]. A pesar del número en aumento de reportes retrospectivos recomendando el uso de la TT para la enfermedad tiroidea bilateral, los cirujanos aún continúan debatiendo si los beneficios potenciales de ese procedimiento sobrepasan las potenciales complicaciones [3-5,9,12-14]. Leigh Delbridge, editor del World Journal of Surgery “Symposium on Evidence-Based Endocrine Surgery (2):Benign Thyroid Disease”, comenta en su editorial enfáticamente que “el manejo quirúrgico de la enfermedad tiroidea benigna es ciertamente la Cenicienta de los desórdenes endócrinos, en relación con la existencia de investigación relevante basada en evidencia” [1].
El objetivo de este estudio retrospectivo de cohorte, de pacientes sometidos a cirugía en una unidad terciaria de derivación, fue comprobar la hipótesis de que la TT para la enfermedad tiroidea benigna es superior a la TSB, en términos de eficacia (una tasa más baja de bocio recidivado y disminución de la necesidad de cirugía de revisión por cáncer de tiroides incidentalmente diagnosticado) y no inferior a la TSB en términos de seguridad (una prevalencia comparable de complicaciones permanentes: hipoparatiroidismo y lesión del nervio laríngeo recurrente (NLR).
Métodos
Diseño del estudio y selección de pacientes
Se estudiaron retrospectivamente los resultados de la cirugía primaria en una gran cohorte de pacientes, derivados entre 01/1999 y 12/2009, con diagnóstico preoperatorio de enfermedad tiroidea benigna bilateral. Se identificó una serie consecutiva de 10.564 pacientes, que fueron sometidos a operaciones tiroideas, en el registro institucional de cirugía tiroidea, mantenido prospectivamente. Los datos de 8.132 pacientes fueron considerados elegibles para ser incluidos en este estudio (Tabla 1). Los pacientes operados entre el 01/99 y 12/2004 recibieron una TSB (n = 5.214), mientras que los operados entre 01/2005 y 12/2009 recibieron una TT (n = 2.918).
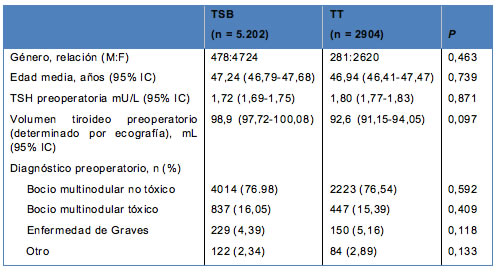
• TABLA 1: Características demográficas de los 8.106 pacientes analizados en este estudio
El criterio de inclusión fue la enfermedad tiroidea benigna bilateral, con la superficie posterior de ambos lóbulos tiroideos de apariencia normal en la ecografía del cuello. Los criterios de exclusión incluyeron: enfermedad tiroidea involucrando la cara posterior del lóbulo(s) tiroideo(s), sospecha preoperatoria de cáncer tiroideo, cirugía tiroidea previa, embarazo o lactancia, edad < 18 años o > 65 años, ASA (American Society of Anesthesiologists) grado 4 y seguimiento alejado a 12 meses incompleto. Además, los pacientes reclutados en un ensayo clínico randomizado concomitante, durante el período de estudio, también fueron excluidos [12,15,16].
Los resultados primarios medidos fueron: la prevalencia del bocio recidivado, el cáncer tiroideo incidental y la necesidad de cirugía tiroidea de revisión. Los resultados secundarios medidos fueron: la tasa de morbilidad postoperatoria, hipoparatiroidismo, lesión del NLR y sangrado. Este proyecto fue aprobado por el Comité Institucional de Revisión (Bioethics Committee of the Jagiellonian University).
Técnica quirúrgica
Las operaciones en ambos grupos fueron realizadas por los mismos cirujanos endocrinológicos experimentados, que siguieron una técnica estandarizada de tiroidectomía, descrita más adelante. El grupo de TSB, la operación consistió en una TSB (dejando muñones tiroideos de aproximadamente 2 gramos de tejido normal remanente a cada lado del cuello). En el grupo de TT, la operación consistió en una TT extracapsular. En cada operación, se hicieron esfuerzos para identificar y remover todo el lóbulo tiroideo piramidal. En cada paciente, el NLR fue expuesto y las ramas de las arterias tiroideas superior e inferior fueron seccionadas cerca de la cápsula tiroidea (ligadura periférica).
El monitoreo electrofisiológico intraoperatorio de la integridad del nervio no fue usado en este estudio. Las glándulas paratiroideas fueron meticulosamente disecadas de la glándula tiroides y se hizo el esfuerzo para identificar las 4 glándulas paratiroideas y para preservarlas in situ tanto como fuera posible. Toda remoción inadvertida de una glándula paratiroides, encontrada durante la inspección, yaciendo sobre la cápsula tiroidea, toda glándula que fue imposible anatómicamente de preservar y toda glándula desvascularizada, fueron reimplantadas electivamente en el músculo esternocleidomastoideo, utilizando la técnica estándar de autotrasplante paratiroideo descrita por Wells y col. [17].
Evaluación preoperatoria y seguimiento postoperatorio
Se realizó rutinariamente una ecografía Doppler de alta resolución del cuello, con un conjunto de transductores lineales de 7.5 y 12 MHz (Logiq 7; GE, Solingen, Alemania) por un radiólogo experimentado del hospital, durante una visita externa antes de la admisión. Los volúmenes de las tiroides fueron calculados de acuerdo con la fórmula elipsoide esférica: volumen = π/6 x diámetro anteroposterior (cm) x ancho (cm) x largo (cm). La aspiración con aguja fina (AAF) fue realizada en todos los pacientes antes de la cirugía. La evaluación preoperatoria incluyó: T3 libre en suero, T4 libre, hormona estimulante de la tiroides (TSH) (respectivamente, mediante equipos comerciales de radioinmunoensayo y con el método ultrasensitivo). Los pacientes con hipertiroidismo fueron operados después de iniciar el tratamiento antitiroideo, cuando se confirmó bioquímicamente el estado eutiroideo.
A todos los pacientes se les efectuó seguimiento alejado ecográfico, citológico y bioquímico, con evaluaciones a los 1, 3, 6, 9 y 12 meses postoperatorios, durante el primer año y después, cada 12 meses, en los años siguientes. La evaluación bioquímica consistió en las concentraciones séricas de TSH. La ecografía tiroidea fue efectuada por el mismo equipo de radiólogos, utilizando el mismo equipamiento que en la evaluación preoperatoria. Todos los pacientes del estudio recibieron postoperatoriamente tratamiento con levotiroxina.
Se utilizaron los siguientes criterios para definir la recidiva de las lesiones nodulares dentro del tejido tiroideo remanente (el mismo reportado previamente en el estudio de Miccoli): presencia de un patrón nodular hipo o hiperecoico de, al menos, 5 mm de diámetro, identificación de un halo hipo o hiperecogénico perinodular y presencia de una lesión anecoica con un refuerzo en la pared posterior [12,18]. La AAF fue realizada selectivamente, durante el período de seguimiento alejado, en todos los casos con lesiones tiroideas mayores de 1 cm de diámetro, identificadas dentro del tejido tiroideo remanente. Se usaron las siguientes indicaciones para la reoperación: presencia de un nódulo de 3 cm o mayor, resultado de la AAF sugestivo de un riesgo de malignidad aumentado y presencia de síntomas compresivos.
La laringoscopía indirecta, por un especialista en garganta, fue obligatoria antes de la cirugía y en el 1º día postoperatorio. La morbilidad del NLR fue calculada en este estudio, por nervios en riesgo y no por pacientes (en total, hubo 16.212 NLR en riesgo en el estudio, incluyendo 10.404 NLR en riesgo en el grupo de TSB y 5.808 en el grupo de TT). En los pacientes con paresia del NLR, se programó un examen adicional a 1, 3, 6 y 12 meses después de la cirugía, o hasta la recuperación de la función de la cuerda vocal. La paresia de la cuerda vocal por más de 12 meses después de la operación, fue considerada como una parálisis permanente.
Los pacientes fueron monitoreados por hipocalcemia bioquímica postoperatoria, durante la hospitalización y después del egreso, en las mañanas de los controles ambulatorios y posteriormente, sobre la base de visitas regulares, estando la hipocalcemia definida como un nivel total de calcio sérico menor a 2 mmol/L. La hipocalcemia persistente por más de 12 meses después de la operación, requiriendo terapia de sustitución con calcio oral, con o sin calcitriol, fue considerada como hipoparatiroidismo permanente.
Análisis estadístico
La significación estadística de las variables categóricas fue evaluada con la prueba de 2, mientras que la prueba de t de Student fue utilizada para la evaluación de las variables continuas. Todos los datos fueron ingresados prospectivamente en el registro institucional computarizado y finalmente analizados por un estadístico (Statistica, Stat-Soft, Katowice). Se consideró una P < 0,05 como significativa.
Resultados
De los 10.564 pacientes derivados para cirugía primaria por distintas enfermedades tiroideas, 8.132 fueron encontrados elegibles para este estudio. Entre los pacientes excluidos hubo: 1.960 pacientes reclutados para uno de los ensayos controlados y randomizados realizados en la institución durante el período del estudio; 288 pacientes con nódulos tiroideos en las caras posteriores de los lóbulos y 204 pacientes que rechazaron el consentimiento informado para un seguimiento postoperatorio alejado. Además, se perdieron 28 pacientes durante el seguimiento a 12 meses; en consecuencia, 8.106 pacientes fueron incluidos en el análisis ulterior.
La media del seguimiento alejado para los pacientes sometidos a TSB versus TT fue de 72,3 ± 12,4 meses versus 36,3 ± 10,6 meses, respectivamente (P < 0,001). Las características demográficas se presentan en la Tabla 1. No hubo diferencias en relación con la edad, género, diagnóstico y volumen tiroideo, entre los pacientes incluidos en el estudio y aquellos que fueron excluidos.
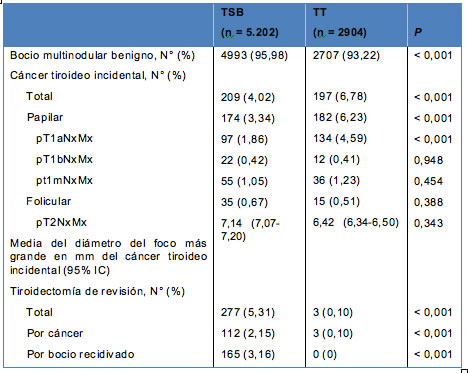
El cáncer tiroideo incidental fue hallado en 406 pacientes (5,0%), incluyendo 209 (4,02%) después de la TSB y 197 (6,78%) después de la TT. El cáncer papilar de tiroides, estadio pT1aNxMx, fue predominante y se lo diagnosticó en 97 pacientes (1,86%) del grupo TSB versus 134 (4,59%) del grupo TT, respectivamente (P < 0,001). No se observaron diferencias significativas en el diámetro medio de los focos de cáncer o en la prevalencia del cáncer tiroideo papilar en estadios pT1bNxMx, pT1mNxMx y en el cáncer folicular de tiroides. La cirugía de revisión por cáncer fue necesaria en 112 pacientes (2,15%) después de la TSB (completitud de la tiroidectomía) versus 3 pacientes (0,1%) después de la TT (limpieza de ganglios linfáticos por recidiva ganglionar); P < 0,001 (Tabla 2).
• TABLA 2: Anatomía patológica final y tiroidectomía de revisión en los 8.106 pacientes analizados en este estudio
El bocio recidivado fue diagnosticado en 364 pacientes (6,99%) del grupo BST versus 2 (0,07%) del grupo TT (P < 0,001). Se encontró un aumento significativo en la prevalencia del bocio recidivado, tan pronto como 48 meses después de la TSB (P < 0,001). En total, 165 pacientes (45,33%) del grupo TSB con bocio recidivado, requirieron reoperación (en 57 individuos, por la presencia de nódulos recidivados por encima de los 3 cm de diámetro, en 48 pacientes por resultados de la AAF sugestivos de un riesgo aumentado de malignidad y en 60 pacientes por la presencia de síntomas compresivos), con un seguimiento alejado medio de 72,3 ± 12,4 meses, versus 0% después de TT, con un seguimiento alejado medio de 36,3 ± 10,6 meses, respectivamente (P < 0,001; Tabla 3). Tres pacientes con hipertiroidismo recidivado después de TSB fueron tratados exitosamente con ablación tiroidea con radio-yodo.
• TABLA 3: Tasa de recidiva, tiempo de recurrencia del bocio, media del seguimiento alejado y datos de sustitución de levotiroxina entre os 8.106 pacientes analizados en este estudio
.jpg)
La prevalencia de hipoparatiroidismo transitorio y permanente fue de 2,70% y 0,15% versus 13,02% y 0,10% (TSB vs TT, respectivamente; P < 0,001 y P = 0,65). No fue significativamente diferente la prevalencia de lesión transitoria o permanente del NLR entre pacientes con TSB y TT (Tablas 4 y 5).
• TABLA 4: Tiempo operatorio y complicaciones después de la tiroidectomía entre los 8.106 pacientes analizados en este estudio.
.jpg)
• TABLA 5: Resultados de este estudio estratificados de acuerdo con el diagnóstico preoperatorio
.jpg)
Discusión
En las últimas 2 décadas, varios centros han manifestado su preferencia por la TT como el procedimiento de elección para el tratamiento de la enfermedad tiroidea benigna [1-7]. El uso de la TT para la enfermedad tiroidea benigna ha aumentado en los últimos 15 años en los Estados Unidos, desde el 17,6% (1993-1997) al 39,6% (2003-2007), comparado con el 82,4% y 60,4% para la tiroidectomía parcial en los mismos períodos (P < 0,001) [19]. En la unidad en donde se desempeñan los autores, la TSB fue el procedimiento principal, para la patología tiroidea benigna, realizado hasta el 12/2004, cuando la TT se convirtió en el procedimiento preferido. Dicha unidad trata en la actualidad hasta el 93% de esos pacientes con TT y a los individuos restantes, con enfermedad tiroidea unilateral, con lobectomía unilateral. Esa transición desde la TSB hasta la TT para la enfermedad tiroidea benigna, refleja la experiencia de la unidad en el tratamiento quirúrgico del cáncer tiroideo con TT y un aceptable riesgo bajo de morbilidad permanente (< 2%).
Este estudio retrospectivo de cohorte se basó en el Registro Institucional de Cirugía Tiroidea, que permitió realizar un estudio a largo plazo con confianza en la validez de los datos recolectados prospectivamente. Los resultados de un estudio con gran número de casos seguidos por un largo período de tiempo refleja un grado mucho más alto del status actual de la cirugía tiroidea en la institución de los autores, en comparación con los datos que surgen de ensayos randomizados y controlados, que usualmente son pequeños en el número de casos.
La prevalencia del bocio recidivado después de la TSB por enfermedad tiroidea benigna, varía considerablemente, dependiendo mayormente de la extensión de la resección tiroidea y del tiempo de seguimiento alejado disponible (1,2%-50%) [20] y aún bajo tratamiento postoperatorio de supresión hormonal con levotiroxina, la tasa de recidiva sigue siendo alta [21-23], particularmente en las áreas de bocio endémico en el mundo [6,12,24]. Todos los pacientes en este estudio recibieron tratamiento postoperatorio con levotiroxina. La dosis de levotiroxina se ajustó a las concentraciones séricas de TSH, para mantenerlas dentro de los dos tercios más bajos del rango de referencia (0,3-2,5 mU/L). Esa estrategia terapéutica se enfocó en evitar el riesgo de un tirotoxicosis leve y limitar la excesiva estimulación TSH de los remanentes tiroideos (en el grupo de TSB). La prevalencia de la recidiva del bocio después de la TSB, fue del 6,99% (seguimiento alejado medio de 72,3 meses), lo que fue significativamente más alto que después de la TT (0,07%; seguimiento alejado medio de 36,3 meses).
La mayoría de las recidivas en este estudio fueron halladas por la vigilancia ecográfica y se presentaron como enfermedad subclínica, mientras que la presentación sintomática se halló en 60 de 364 pacientes (16,48%) del grupo TSB, que fueron sometidos a cirugía de revisión por bocio recidivado, comparado con ningún paciente en el grupo de TT. No obstante, el bocio recidivado puede ocurrir aún después de una TT. Snook y col., reportaron la recurrencia después de TT por bocio multinodular benigno, en el 0,3% de 3.044 pacientes seguidos por un período de 25 años [25]. La mayoría (8/10) de esas recidivas se debieron a una resección inadecuada del tejido tiroideo remanente embriológico a lo largo del ligamento tirotímico o tracto piramidal (2 de esas instancias ocurrieron en el presente estudio, ambas con una recidiva de 1 cm en la línea media del cuello, originada por haber quedado in situ tejido tiroideo remanente del lóbulo piramidal). Snook y col., concluyeron en que la TT con una cuidadosa atención para identificar y remover toda la glándula tiroidea a lo largo de su descenso embriológico, debería abolir efectivamente la recidiva del bocio benigno [25].
Los cánceres incidentales de tiroides son detectados en el 3% al 16,6% de los bocios aparentemente benignos en numerosos estudios (5% en este estudio) [4,5,9,11]. Aunque el 59,86% de los cánceres tiroideos incidentales diagnosticados en este estudio fueron micropapilares, multicéntricos o cánceres papilares grandes, representaron el 30,78% de los casos, seguidos por cánceres foliculares macroscópicamente invasivos en el 12,31%.
Otros investigadores reportaron valores comparables en sus estudios [6,7,13,20,24,26]. Esos pacientes necesitan un tratamiento quirúrgico adicional después de la TSB, mientras que la TT puede ser considerada un procedimiento quirúrgico adecuado. Los datos de este estudio apoyan esa observación, dado que un número significativamente más alto de pacientes requirió una tiroidectomía de revisión después de la TSB versus la TT (2,15% vs 0,10%; P < 0,001). La indicación mayor para la tiroidectomía de completitud en esos pacientes, fue un resultado positivo de la AAF sugestivo de cáncer tiroideo papilar, originado de una lesión de 5 mm o más, revelada por ecografía, dentro del tejido tiroideo remanente, durante los controles en el seguimiento alejado (el cáncer tiroideo papilar multicéntrico fue hallado en 55 pacientes de TSB), seguido por el diagnóstico de un cáncer tiroideo folicular macroscópicamente invasivo en 35 pacientes de TSB y cáncer tiroideo papilar en estadio pT1bNxMx en 22 pacientes del grupo de TSB.
En consecuencia, la tiroidectomía de completitud fue llevada a cabo para brindar la resección completa de la enfermedad multicéntrica y para permitir una terapia de ablación con radio-yodo, de acuerdo con las recomendaciones de las Revised American Thyroid Association Management Guidelines, para los pacientes con nódulos tiroideos y cáncer tiroideo diferenciado [27]. Por otro lado, entre los 197 pacientes con cáncer tiroideo diagnosticado incidentalmente después de la TT, sólo 3 individuos requirieron cirugía de revisión, que consistió en una disección del cuello orientada a compartimiento de nivel IV, a causa de la recidiva ganglionar linfática confirmada por el resultado de la AAF guiada por ecografía.
Se hallaron diferencias significativas en la proporción de pacientes que necesitó cirugía de revisión, por la recidiva de un bocio benigno, después de la TSB en comparación con la TT (3,16% vs 0%, respectivamente), a pesar del uso postoperatorio rutinario de terapia con levotiroxina. De hecho, la incidencia de la recidiva ha sido relacionada directamente con un período de seguimiento alejado muy largo y con cantidades grandes de tejido remanente [22,28,29]. Delbridge y col., documentaron que la tiroidectomía subtotal por bocio multinodular, ha resultado en reoperación por recidiva en el 13% al 20% de los pacientes, alcanzando un pico de incidencia a los 13 años después de la operación primaria [5]. Dado que la enfermedad nodular tiroidea recidivada es frecuentemente asintomática y puede requerir más de 10 años para desarrollarse, la importancia de un seguimiento alejado regular y de por vida, debería ser enfatizada a cada paciente.
La seguridad de la tiroidectomía es una preocupación mayor. La tasa aceptada de morbilidad permanente (hipoparatiroidismo y parálisis de la cuerda vocal) oscila entre el 1% y el 2% para las operaciones tiroideas primarias, realizadas por cirujanos de tiroides con alto volumen de pacientes [3]. Por otro lado, la cirugía de revisión después de TSB involucra un riesgo sustancialmente más alto, cercano al 10% de eventos permanentes [27]. De manera similar al reporte previo de los autores [17] y de otros investigadores [3, 5, 9, 11], no se encontraron diferencias significativas en el número de complicaciones permanentes después de la TSB versus la TT en el presente estudio. No obstante, existe una fuerte evidencia de que las tasas de complicación son más altas, cuando la cirugía es efectuada por cirujanos de tiroides con bajo volumen de pacientes [7,19,30].
Los estudios basados en población sobre resultados/volumen, han sugerido que el riesgo de lesión del NLR y de hipocalcemia es significativamente más grande en los centros con bajo volumen de pacientes [31]. Desafortunadamente, al menos el 50% de todas las operaciones tiroideas en los Estados Unidos y también en Europa, son realizadas por cirujanos con bajo volumen de pacientes (por debajo de 50 operaciones tiroideas por año). Sin embargo, Reeve y col., documentaron que los cirujanos que han completado un programa de entrenamiento bien diseñado y que se habían vuelto diestros en la TT como entrenados, permanecerán diestros en el procedimiento, a pesar de operar en centros con bajo volumen [30]. Alcanzar una baja tasa de morbilidad, demanda una atención meticulosa a la técnica operatoria y a los detalles anatómicos [31]. Esta observación subraya que las habilidades quirúrgicas y la experiencia determinan, en gran medida, la tasa de complicaciones, más que el tipo de resección tiroidea.
Mucho del debate relacionado con la extensión de la cirugía para el cáncer de tiroides ha sido recientemente evaluado en las Revised ATA Management Guidelines for Patients with Thyroid Nodules and Differentiated Thyroid Cancer [27]. Esas guías, de hecho, apoyan los hallazgos de este estudio, de que la TT debería ser el procedimiento de elección, particularmente para pacientes con nódulos indeterminados que tienen enfermedad nodular bilateral, o para aquellos que prefieren ser sometidos a una tiroidectomía bilateral para evitar la posibilidad de requerir una futura cirugía sobre el lóbulo contralateral.
En este estudio, similarmente como en otros reportes [2,7,32,33] se documentó un aumento significativo en el hipoparatiroidismo transitorio en los pacientes sometidos a TT, en comparación con los pacientes que tuvieron una TSB. Ese fenómeno es fácil de explicar, ya que durante la TT se usó mucho más frecuentemente el reimplante de las glándulas paratiroideas, que durante la TSB. Además, la remoción inadvertida de la glándula paratiroidea fue identificada más comúnmente en el examen anatomopatológico después de la TT que después de la TSB. Por lo tanto, la hipocalcemia transitoria después de la tiroidectomía con reimplante de tejido paratiroideo, debería ser considerada una secuela más que una complicación (alcanzando en otras series del 1,8% al 42%) [32,33]. En el ensayo controlado y randomizado publicado por los autores del presente trabajo, sobre 200 pacientes involucrados en cada una de las ramas, la prevalencia de la paresia transitoria del NLR fue significativamente más alta después de la TT que de la TSB (5,49% vs 2,1%) [12]. Es interesante señalar que esos datos no fueron confirmados por los resultados del presente gran estudio, dado que el riesgo de lesión temporaria del NLR no fue significativamente diferente entre los pacientes con TT y TSB (detalles en la Tabla 4). El riesgo de lesión permanente del NLR no dependió tampoco, en este estudio, de la extensión de la resección tiroidea.
La identificación rutinaria del NLR es, en la actualidad, parte de las recomendaciones de tratamiento [27,34] y es considerada como el gold standard de los cuidados en la cirugía tiroidea [35]. Además de esa técnica, recientes avances en la cirugía tiroidea incluyen el monitoreo electrofisiológico intraoperatorio de la integridad del nervio (no empleado en este estudio), que ayuda en la identificación visual y disección del NLR, particularmente en casos de nervios bifurcados, que están especialmente predispuestos a la lesión [36-38], y permite el pronóstico seguro de la función del nervio, haciendo posible realizar una tiroidectomía en un tiempo, para prevenir cualquier riesgo de lesión bilateral del NLR [39].
Una desventaja mayor de este estudio, es el período de seguimiento alejado dos veces más breve de la TT versus el grupo de TSB, lo que debe ser tomado en cuenta en relación con las diferencias observadas a largo plazo. El segundo punto débil es que la experiencia mejorada de los cirujanos involucrados en este estudio, basada en su práctica con gran volumen de pacientes de cirugía tiroidea, podría resultar – en algún grado – en los mejores resultados alcanzados en el grupo de TT que siguió a la TSB. Además, a pesar de que no se usó en este estudio el monitoreo del NLR, debería mencionarse que esa técnica ha sido empleada en algunas operaciones realizadas en la institución de los autores desde el año 2004, fuera de este estudio, por los mismos cirujanos, lo que también podría mejorar los resultados alcanzados en el grupo de TT sin monitoreo del nervio.
En conclusión, existe una evidencia en aumento de que la TT resulta en una tasa significativamente más baja de tiroidectomía de completitud por cáncer tiroideo diagnosticado incidentalmente y de necesidad de nueva cirugía por bocio recidivado, cuando se la compara con la TSB. La extensión de la resección quirúrgica, no tiene un impacto significativo sobre la prevalencia de complicaciones permanentes. Por lo tanto, la TT puede ser recomendada como un procedimiento de elección, en centros de derivación terciarios, para el tratamiento de la enfermedad tiroidea benigna bilateral. No obstante, la diseminación de esta estrategia de “cirugía tiroidea radical” a unidades con bajo volumen de cirugía tiroidea, debería ser precedida por programas extensos y bien diseñados de entrenamiento, seguidos por la garantía de un estricto control de calidad.
♦ Comentario y resumen objetivo: Dr. Rodolfo D. Altrudi
Bibliografía
1. Delbridge L. Symposium on evidence-based endocrine surgery (2): benign thyroid disease. World J Surg. 2008;32:1235–1236.
2. Thomusch O, Sekulla C, Dralle H. Is primary total thyroidectomy justified in benign multinodular goiter? Results of a prospective quality assurance study of 45 hospitals offering different levels of care. Chirurg. 2003;74:437–443.
3. Clark OH. Total thyroidectomy: the preferred option for multinodular goiter. Ann Surg. 1988;208:244–245.
4. Wheeler MH. Total thyroidectomy for benign thyroid disease. Lancet. 1998;351:1526–1527.
5. Delbridge L, Guinea AI, Reeve TS. Total thyroidectomy for bilateral benign multinodular goiter: effect of changing practice. Arch Surg. 1999;134:1389–1393.
6. Mishra A, Agarwal A, Agarwal G, et al. Total thyroidectomy in benign thyroid disorders in an endemic region. World J Surg. 2001;25:307–310
7. Bellantone R, Lombardi CP, Bossola M, et al. Total thyroidectomy for management of benign thyroid disease: review of 526 cases. World J Surg. 2002;26;1468–1471.
8. Giles Y, Boztepe H, Terzioglu T, et al. The advantage of total thyroidectomy to avoid reoperation for incidental thyroid cancer in multinodular goiter. Arch Surg. 2004;139:179–182.
9. Agarwal G, Aggarwal V. Is total thyroidectomy the surgical procedure of choice for benign multinodular goiter? An evidence-based review. World J Surg. 2008;32:1313–1324.
10. Moalem J, Suh I, Duh QY. Treatment and prevention of recurrence of multinodular goiter: an evidence-based review of the literature. World J Surg. 2008;32:1301–1312.
11. Tezelman S, Borucu I, Senyurek (Giles) Y, et al.. The change in surgical practice from subtotal to near-total or total thyroidectomy in the treatment of patients with benign multinodular goiter. World J Surg. 2009;33:400–405.
12. Barczynski M, Konturek A, Hubalewska-Dydejczyk A, et al. Five-year follow-up of a randomized clinical trial of total thyroidectomy versus Dunhill operation versus bilateral subtotal thyroidectomy for multinodular nontoxic goiter. World J Surg. 2010;34:1203–1213.
13. Ozbas S, Kocak S, Aydintug S, et al. Comparison of the complications of subtotal, near total and total thyroidectomy in the surgical management of multinodular goitre. Endocr J. 2005;52:199–205.
14. Thomusch O, Machens A, Sekulla C, et al. Multivariate analysis of risk factors for postoperative complications in benign goiter surgery: prospective multicenter study in Germany. World J Surg. 2000;24:1335–1341.
15. Barczynski M, Cichon S, Konturek A, et al. Applicability of intraoperative parathyroid hormone assay during total thyroidectomy as a guide for the surgeon to selective parathyroid tissue autotransplantation. World J Surg. 2008;32:822–828.
16. Barczynski M, Konturek A, Cichon S. Randomized clinical trial of visualization versus neuromonitoring of recurrent laryngeal nerves during thyroidectomy. Br J Surg. 2009;96:240–246.
17. Wells Jr SA, Gunnells JC, Shelburne JD, et al. Transplantation of the parathyroid glands in man: Clinical indications and results. Surgery. 1975;78:34–44.
18. Miccoli P, Antonelli A, Iacconi P, et al. Prospective, randomized, double-blind study about effectiveness of levothyroxine suppressive therapy in prevention of recurrence after operation: results at the third year of follow up. Surgery. 1993;114:1097–1101.
19. Ho TWT, Shahenn AA, Dixon E, et al. Utilization of thyroidectomy for benign disease in the United States: a 15-year population-based study. Am J Surg. 2011;201:569–573.
20. Ríos A, Rodríguez JM, Canteras M, et al. Surgical management of multinodular goiter with compression symptoms. Arch Surg 2005;140:49–53.
21. Bistrup C, Nielsen JD, Gregersen G, et al. Preventive effect of levothyroxine in patients operated for nontoxic goitre: a randomized trial of one hundred patients with nine years follow-up. Clin Endocrinol (Oxf). 1994;40:323–327.
22. Anderson PE, Hurley PR, Rosswick P. Conservative treatment and long term prophylactic thyroxine in the prevention of recurrence of multinodular goiter. Surg Gynecol Obstet. 1990;171:309–314.
23. Torre G, Barreca A, Borgonovo G, et al. Goiter recurrence in patients submitted to thyroid-stimulating hormone suppression: possible role of insulin-like growth factors and insulin-like growth factor-binding proteins. Surgery. 2000;127:99–103.
24. Erbil Y, Bozbora A, Yanik BT, et al. Predictive factors for recurrent non-toxic goiter in an endemic region. J Laryngol Otol 2007;121:231–236.
25. Snook KL, Stalberg PL, Sidhu SB, et al. Recurrence after total thyroidectomy for benign multinodular goiter. World J Surg. 2008;31:593–599.
26. Marchesi M, Biffoni M, Tartaglia F, et al. Total versus subtotal thyroidectomy in the management of multinodular goiter. Int Surg. 1998;83:202–204.
27. Cooper DS, Doherty GM, Haugen BR, et al. Revised American Thyroid Association Management Guidelines for Patients with Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2009;19:1167–1214.
28. Reeve TS, Delbridge L, Brady P, et al. Secondary thyroidectomy: a twenty-year experience. World J Surg. 1998;12:449–453.
29. Rojdmark J, Jarhult J. High long term recurrence rate after subtotal thyroidectomy for nodular goitre. Eur J Surg. 1995;161:725–727
30. Reeve TS, Curtin A, Fingleton L, et al. Can total thyroidectomy be performed as safely by general surgeons in provincial centers as by surgeons in specialized endocrine surgical units? Making the case for surgical training. Arch Surg. 1994;129:834–836.
31. Sosa JA, Bowman HM, Tielsch JM, et al. The importance of surgeon experience for the clinical and economic outcomes from thyroidectomy. Ann Surg. 1998;228:320–330.
32. Bergenfelz A, Jansson S, Kristofferson A, et al. Complications to thyroid surgery: results as reported in a database from a multicenter audit comprising 3660 patients. Langenbecks Arch Surg. 2008;393:667–673.
33. Sitges-Serra A, Ruiz S, Girvent M, et al. Outcome of protracted hypoparathyroidism after total thyroidectomy. Br J Surg. 2010;97:1687–1695.
34. British Thyroid Association. BTA Guidelines for the management of Thyroid Cancer in Adults. Available at: http://www.british-thyroid-association.org/news/Docs/Thyroid_cancer_guidelines_2007.pdf. Accessed October 5, 2011.
35. Hermann M, Alk G, Roka R, et al. Laryngeal recurrent nerve injury in surgery for benign thyroid disease: effect of the nerve dissection and impact of individual surgeon in more than 27,000 nerves at risk. Ann Surg. 2002;235:261–268.
36. Sancho JJ, Pascual-Damieta M, Pereira JA, et al. Risk factors for transient vocal cord palsy after thyroidectomy. Br J Surg. 2008;95:961–967.
37. Serpell JW, Yeung MJ, Grodski S. The motor fibers of the recurrent laryngeal nerve are located in the anterior extralaryngeal branch. Ann Surg. 2009;249: 648–652.
38. Barczynski M, Nowak W, Sancho JJ, et al. The motor fibers of the recurrent laryngeal nerves are located in the anterior extralaryngeal branch. Ann Surg. 2010;251:773–774
39. Randolph GW, Dralle H with the International Intraoperative Monitoring Study Group. Electrophysiologic recurrent laryngeal nerve monitoring during thyroid and parathyroid surgery—International standards guideline statement. Laryngoscope. 2011;121(S1):S1–S16