La patogénesis del glaucoma sigue sin esclarecerse totalmente, pero existen pruebas de que en dicha patología hay un suministro sanguíneo insuficiente en la cabeza del nervio óptico, al menos en algunos tipos de glaucoma. Dado que la vasculopatía es una característica distintiva de la diabetes y que el flujo sanguíneo insuficiente en la retina y el nervio óptico es característica del glaucoma, se podría afirmar que la diabetes puede exacerbar el glaucoma. Sin embargo, después de décadas de investigaciones, hay pruebas contradictorias con respecto a la asociación de ambas enfermedades. En los ensayos clínicos de gran escala no se encontró asociación. Existen algunas asociaciones menores, pero la más importante está documentada en el estudio ocular Blue Mountains. Es extraña esta falta de una asociación sólida.
Existen, por otro lado cada vez más pruebas de que la hiperglucemia causa entrecruzamientos y está asociada con aumento del espesor de la córnea central, lo que tiene como consecuencia un endurecimiento de la cornea. Esto significa que la medición de la PIO mediante métodos como la tonometría de aplanación Goldmann, que dependen de esta variable, sobreestiman la verdadera PIO.
La glucosa es esencial para los tejidos del sistema nervioso, incluso para la retina y nervio óptico, pero es un dogma en la clínica que la hiperglucemia es perjudicial para las neuronas, en condiciones de baja energía. Contrariamente, hemos demostrado anteriormente que el aporte de glucosa a las neuronas retinianas in vivo, durante períodos de isquemia aguda y sostenida proporciona un fuerte efecto neuroprotector. Estudios recientes determinaron que la glucosa y no el lactato es responsable de dicho efecto protector. En la presente investigación encontramos evidencia de que los axones de las células ganglionares retinianas se ven parcialmente protegidos por la hiperglucemia.
Pacientes y métodos:
Se indujo hipertensión ocular en dos grupos (26 cada uno) de ratas Sprague-Dawley. Un grupo se mantuvo con glucemia normal y en el otro se provocó hiperglucemia mediante una inyección intraperitoneal de estreptozocina. Después de dos semanas de presión intraocular elevada, se compararon los perfiles del daño retiniano y axonal utilizando diversas técnicas histológicas. También se evaluaron cambios inmuno-histo-químicos en la retina y nervio óptico.
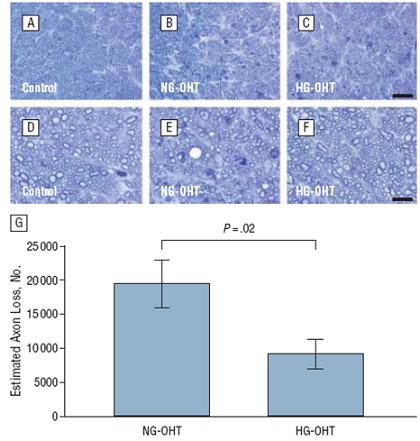
Cuantificación del daño axonal en secciones cruzadas del nervio óptico. Imágenes representativas de nervios ópticos de control (A y D) y ejemplos con glucemia normal (B y E) y con hiperglucemia (C y F) con distintas magnificaciones, A y C magnificación original x 10, D y F por 40. El gráfico G ilustra la pérdida promedio de axones calculada sobre la base de conteo de axones (test Mann- Whitney).
La hiperglucemia exacerba el daño isquémico cerebral. El caso de la retina que tiene características únicas de metabolismo de la glucosa, es distinto. El objetivo de esta investigación fue evaluar el efecto de hiperglucemia a corto plazo sobre el daño axonal y supervivencia de células ganglionares retinianas en un modelo experimental de glaucoma en ratas, separando el efecto benéfico potencial del aporte adicional de energía (es decir niveles elevados de glucosa) de los cambios crónicos perjudiciales que se producen en la retinopatía diabética.
Como principal resultado, hallamos pruebas convincentes de que la hiperglucemia atenuó la degeneración de las células ganglionares retinianas después de hipertensión ocular inducida. Los resultados secundarios, que proporcionan información sobre el estado del citoesqueleto axonal y la respuesta de las células micro y macrogliales del nervio óptico y la retina, arrojaron resultados mixtos.
Hallamos un efecto neuroprotector de la hiperglucemia sobre el nervio óptico y las células ganglionares retinianas en el presente modelo experimental de glaucoma. A la luz de este experimento, los resultados del Estudio sobre tratamiento de hipertensión ocular, que sugirió que la progresión del glaucoma se retardaba en pacientes con diabetes, pareciera factible. Allí se señalaron distintos mecanismos por los que la diabetes podría proteger a la retina de los ataques relacionados con el glaucoma. Entre dichos mecanismos mencionan invasión intracelular de factores troficos a través de vasos permeables, episodios localizados de hipoperfusión que provocan isquemia localizada o aumento de la glicación en elementos estructurales como el colágeno, terminando en aumento de la rigidez del tejido conectivo y prevención del daño estructural relacionado con la presión. Finalmente, no propiciamos cambios en el tratamiento de pacientes con glaucoma y diabetes. Sin embargo, debería investigarse en profundidad un enfoque bioenergético para retardar la neurodegeneración.
Conclusiones:
En este modelo experimental de glaucoma en ratas, el nervio óptico y las células ganglionares retinianas estuvieron parcialmente protegidos por hiperglucemia de corto plazo. La disponibilidad de un sustrato de energía podría por lo tanto tener un rol en la neuropatía óptica isquémica.
♦ Síntesis y traducción: Dr. Martín Mocorrea, editor responsable de Intramed en la especialidad de oftalmología.
Bibliografía:
1. Burgoyne CF, Morrison JC. The anatomy and pathophysiology of the optic nerve head in glaucoma. J Glaucoma. 2001;10(5)(suppl 1):S16-S18.
2. Flammer J, Orgu¨l S, Costa VP, et al. The impact of ocular blood flow in glaucoma.Prog Retin Eye Res. 2002;21(4):359-393.
3. Osborne NN, Chidlow G, Layton CJ, Wood JP, Casson RJ, Melena J. Optic nerve and neuroprotection strategies. Eye (Lond). 2004;18(11):1075-1084.
4. Kahn HA, Leibowitz HM, Ganley JP, et al. The Framingham Eye Study, II: association of ophthalmic pathology with single variables previously measured in the Framingham Heart Study. Am J Epidemiol. 1977;106(1):33-41.
5. Leske MC, Connell AM, Wu SY, Hyman LG, Schachat AP. Risk factors for openangle glaucoma: the Barbados Eye Study. Arch Ophthalmol. 1995;113(7):918-924.
6. Tielsch JM, Katz J, Quigley HA, Javitt JC, Sommer A. Diabetes, intraocular pressure, and primary open-angle glaucoma in the Baltimore Eye Survey. Ophthalmology. 1995;102(1):48-53.