Viñeta clínica:
Un hombre de 55 años con antecedentes de insuficiencia mitral consulta luego de un episodio de debilidad transitoria de su brazo derecho y dificultad para hablar. Un mes antes se había sometido a un procedimiento odontológico (desincrustación). El paciente ha notado fiebre intermitente y pérdida de peso. A la auscultación cardíaca no muestra variaciones de su soplo de regurgitación mitral. El ecocardiograma transtorácico muestra una vegetación en la válvula mitral, móvil, de 12 mm, y regurgitación de grado 2 (leve). La imagen por resonancia magnética cerebral reveló una lesión isquémica reciente.
¿Cómo se debe estudiar y tratar a este paciente?
Problema clínico
En los países industrializados, la endocarditis infecciosa tiene una incidencia anual estimada de 3 a 9 casos/100.000 personas. La relación hombre:mujer es superior a 2:1. Las tasas más elevadas se observan en los pacientes con válvulas protésicas, dispositivos intracardíacos, cardiopatías congénitas cianóticas no corregidas o, antecedente de endocarditis infecciosa, aunque el 50% de los casos se desarrolla en los pacientes sin historia conocida de enfermedad valvular.
Otros factores de riesgo son la cardiopatía reumática crónica (la que en los países industrializados actualmente es responsable de menos del 10% de los casos), lesiones valvulares degenerativas relacionadas con la edad, hemodiálisis y, condiciones coexistentes como la diabetes, la infección por el VIH y el uso de drogas intravenosas. En EE. UU, más de un tercio de los casos de endocarditis infecciosa de los últimos años estaba asociado a la atención de la salud (nosocomial o no nosocomial). La mayor incidencia de endocarditis infecciosa en las personas ≥65 probablemente quede explicada por la relación de varios de esos factores predisponentes con la edad
Microbiología
Los estreptococos y estafilococos son los causantes del 80% de los casos de endocarditis infecciosa, con proporciones que varían según la válvula (nativa o protésica), el origen de la infección, la edad del paciente y las condiciones coexistentes. En la actualidad, los microorganismos identificados con más frecuencia en varios tipos de endocarditis infecciosas son los estafilococos, como resultado de una mayor proporción de casos asociados a la atención de la salud. Al mismo tiempo, la incidencia de casos atribuibles a los estreptococos de alojados en la cavidad bucal ha disminuido en los países industrializados.
Los casos de endocarditis infecciosa con hemocultivos negativos (10%) pueden reflejar una de las dos siguientes situaciones:
- Endocarditis infecciosa en pacientes expuestos a la acción de antibióticos antes del diagnóstico.
- Endocarditis infecciosa causada por microorgamnismos oportunistas.
En este último caso, el uso de técnicas microbiológicas altamente especializadas, análisis serológicos y reacción en cadena de la polimerasa permite la identificación del 60% de los patógenos, siendo los microorganismos más frecuentes los de las familia bartonella, brucella, Coxiella burnetii (el agente causal de la fiebre Q), bacterias del grupo HACEK (especies haemophilus, Aggregatibacter [antes denominada Actinobacillus] actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens y, Kingella kingae) y, Tropheryma whipplei.
Patogénesis
El endotelio valvular normal es naturalmente resistente a la colonización bacteriana. En el modelo convencional de endocarditis infecciosa de válvula nativa, la infección resulta de la colonización del endotelio valvular dañado por bacterias circulantes con propiedades adherentes específicas.
El daño endotelial puede ser el resultado de lesiones jet (chorro) debidas al flujo de sangre turbulento, o puede estar provocado por electrodos o catéteres o, inyecciones intravenosas repetidas de partículas sólidas, como en los drogadictos intravenosos.
La inflamación crónica, como en la cardiopatía reumática crónica, y las lesiones valvulares degenerativas también pueden promover la endocarditis infecciosa.
Sin embargo, es posible que el modelo convencional no pueda explicar por completo la patogénesis de la endocarditis infecciosa debida a microorganismos intracelulares como C. burnetii, especies bartonella o T. whippelii, donde la exposición y la respuesta inmune del huésped pueden representar un papel importante.
Clasificación
Con anterioridad, la endocarditis infecciosa se clasificaba de acuerdo a su modo de presentación (aguda, subaguda o crónica) pero ahora según las condiciones cardíacas subyacentes, la presencia de dispositivos intracardíacos o el modo de adquisición. Estas clasificaciones se superponen, de modo que hay algunos casos de endocarditis infecciosa que pertenecen a más de un grupo.
Resultados
En los estudios de población actuales realizados en países industrializados, la mortalidad hospitalaria oscila entre el 15% y el 22% y la mortalidad a los 5 años es de aproximadamente 40%. Sin embargo, las tasas varían mucho entre los subgrupos de pacientes. Por ejemplo, en los pacientes con lesiones de las cavidades derechas o por estreptococos orales, lesiones del lado izquierdo o lesiones en válvulas nativas, la mortalidad intrahospitalaria es inferior al 10%, mientras que en los pacientes con endocarditis infecciosa por Staphylococcus aureus de válvula protésica es ≥40%.
En un análisis de múltiples variables, la evaluación de los factores de riesgo de muerte entre los pacientes con endocarditis infecciosa, los predictores independientes incluyeron la edad más avanzada, la infección por S. aureus, la insuficiencia cardíaca, los eventos cerebrovasculares y embólicos, y la endocarditis infecciosa asociada a la atención de la salud.
Estrategias y evidencia
Presentación y diagnóstico
El diagnóstico de endocarditis infecciosa generalmente se basa en signos clínicos, microbiológicos y ecocardiográficos.
Los criterios de Duke tienen una sensibilidad y especificidad superior al 80% y son los criterios de referencia para el diagnóstico. Sin embargo, para hacer el diagnóstico de endocarditis bacteriana en forma individual, esos criterios no deben reemplazar al criterio clínico, en especial durante el primer estadio de la atención.
Un signo común es la fiebre, presente en el 80% de los casos. En general, en las series de casos actuales se reconoce un soplo nuevo o el empeoramiento de un soplo cardíaco ya detectado (48% y 20% de los casos, respectivamente).
Otros signos son menos comunes: hematuria (25%de los casos), esplenomegalia (11%), hemorragias en astilla (8%), lesiones de Janeway (5%), manchas de Roth (5%) y, hemorragia conjuntival (5%).
También se pueden presentar otras manifestaciones: sepsis, meningitis, insuficiencia cardíaca no explicada, embolia pulmonar séptica, accidente cerebrovascular, oclusión arterial periférica aguda e, insuficiencia renal.
En dos tercios de los pacientes se observa la elevación de los marcadores inflamatorios (velocidad de eritrosedimentación y nivel de proteína C reactiva); en la mitad de los casos se observa leucocitosis y anemia.
Las complicaciones extracardíacas de la endocarditis infecciosa más graves y frecuentes son las cerebrales: accidente cerebrovascular isquémico y hemorrágico (en el 60% de los pacientes es anterior al diagnóstico de endocarditis infecciosa), accidente cerebrovascular isquémico transitorio, embolismo cerebral silente, aneurisma micótico transitorio, abscesos cerebrales y, meningitis.
Las características específicas de las vegetaciones (aquellas que son grandes, móviles y localizadas en la válvula mitral) y la infección por S. aureus han sido asociadas con un riesgo mayor de eventos embólicos sintomáticos.
Las imágenes cerebrales por resonancia magnética pueden revelar anormalidades hasta en el 80% de los pacientes, incluyendo el 50% de las embolias (principalmente asintomáticas).
Los aneurismas micóticos resultan de embolias arteriales sépticas del espacio intraluminal o de los vasa vasorum y la propagación de la infección a través de la pared de los vasos. En las series de casos más antiguas, el porcentaje de aneurismas informado era del 5%, pero ahora se detectan con más frecuencia debido al uso más difundido de las imágenes. La mejor prueba para su confirmación es la angiografía por resonancia magnética.
Diagnóstico microbiológico
Para hacer el diagnóstico de endocarditis infecciosa y determinar su tratamiento antibiótico es fundamental identificar al microorganismo causal. Antes de la administración de los antibióticos se deben realizar hemocultivos en forma sistemática. Después de la realización de 3 hemocultivos, la identificación del patógeno alcanza al 90%.
En los pacientes con hemocultivos negativos y factores de riesgo para infección por bartonella, C. burnetii y brucella, se deben realizar pruebas serológicas específicas.
Si el agente causal no ha sido identificado mediante el hemocultivo y el paciente requiere la cirugía de la válvula, se puede recurrir a la amplificación génica en muestras de la válvula cardíaca, como así a técnicas de inmunotinción, que pueden ayudar al diagnóstico microbiológico.
Diagnóstico de las lesiones valvulares
En primer lugar se hace el ecocardiograma transtorácico, el cual es mejor que el transesofágico para detectar abscesos en la valva anterior aórtica en un paciente con válvula protésica, y para evaluar las consecuencias hemodinámicas de la disfunción valvular.
El ecocardiograma transesofágico tiene mayor sensibilidad y especificidad general y está indicado cuando los resultados del transtorácico son negativos y existe un índice de sospecha clínica elevado, mala calidad de las imágenes y presencia de válvula protésica o un dispositivo intracardíaco, como así en los casos en los cuales los hallazgos del ecocardiograma transtorácico son sugestivos de endocarditis infecciosa que no son definitivos.
La combinación de ambos ecocardiogramas pone en evidencia las vegetaciones en el 90% de los casos, la regurgitación valvular en el 60%, los abscesos paravalvulares en el 20% y, con menos frecuencia, la dehiscencia de la prótesis, seudoaneurismas y fístulas. Cuando en el ecocardiograma no muestra signos pero la sospecha de endocarditis infecciosa continúa, se debe repetir el examen, y también cuando se sospecha una nueva complicación o el tratamiento ha finalizado.
Tratamiento
El tratamiento de los pacientes con endocarditis infecciosa presuntiva o confirmada debe ser planificado por un equipo interdisciplinario con experiencia en cardiología, cirugía cardíaca e infectología. El buen resultado del tratamiento depende de la erradicación del agente causal, lo que requiere un tratamiento prolongado con antibióticos bactericidas. La cirugía puede ayudar mediante la eliminación del material infectado y el drenaje de los abscesos.
Tratamiento antibiótico
Hay guías de sociedades médicas publicadas para ayudar al tratamiento antibiótico apropiado de la endocarditis infecciosa, que son actualizadas en forma regular.
Para la endocarditis infecciosa de válvula nativa provocada por microorganismos comunes, la duración del tratamiento antibiótico oscila desde las 2 semanas (para los cuadros no complicados debidos a estreptococos completamente sensibles a la penicilina, tratados con un antibiótico ß lactámico combinado con un aminoglucósido) hasta las 6 semanas (para la endocarditis infecciosa por enterococos).
Para la endocarditis infecciosa de válvula protésica, la duración del tratamiento suele ser de 6 semanas, y los regímenes son básicamente los mismos que los que se utilizan para la enfermedad de válvula nativa, con excepción de la endocarditis infecciosa de válvula nativa por estafilococo, para la cual el régimen debe incluir tanto rifampicina (siempre que la cepa sea sensible a este antibiótico) como gentamicina.
Cuando se ha realizado el reemplazo valvular durante el tratamiento antibiótico de la endocarditis infecciosa de válvula nativa, este tratamiento debe tener la misma duración que la recomendada para la endocarditis infecciosa de válvula nativa, y no cambiarse al régimen indicado para la endocarditis infecciosa de válvula protésica.
En ambos tipos de endocarditis, la duración del tratamiento debe calcularse desde el primer día del tratamiento antibiótico apropiado y no desde el día de la cirugía. Solamente se comenzará luego de la operación un nuevo curso terapéutico completo cuando el cultivo de la válvula sea positivo.
Entre los aminoglucósidos, solo la gentamicina ha sido evaluada por completo para el tratamiento de la endocarditis infecciosa y está indicada cuando la enfermedad está causada por cocos gram positivos. Los ensayos clínicos han mostrado que un curso de gentamicina de 14 días, administrada 1 vez por día en vez de 2 veces por día, combinada con ceftriaxona, es efectivo para el tratamiento de los casos no complicados de endocarditis infecciosa de válvula nativa.
En la endocarditis infecciosa de válvula protésica está indicado el tratamiento combinado de un antibiótico ß lactámico con un aminoglucósido.
En los casos de endocarditis infecciosa enterocócica, la gentamicina debe utilizarse combinada con un agente antibiótico activo contra la pared de la célula bacteriana, siempre que la cepa no tenga un resistencia elevada a ese antibiótico. En general, la gentamicina se administra durante 6 semanas pero un estudio de observación mostró que con la administración de aminoglucósidos durante una media de 15 días, la tasa de curación de la endocarditis infecciosa enterocócica alcanzó el 81%. Esto indica, dicen los autores, que los cursos más cortos de aminoglucósidos (2-3 semanas), utilizados para minimizar el riesgo de toxicidad renal, también pueden ser efectivos.
Todavía sigue en debate si la gentamicina debe ser administrada o no en dosis divididas, 2 veces por día; faltan datos clínicos al respecto y los datos provenientes de la experimentación son dispares. La combinación de ampicilina (en dosis de 12 g/24 horas) con ceftriaxona (en dosis de 2 g, dos veces/día) puede ser efectiva para la endocarditis infecciosa por Enterococcus faecalis, independientemente de si la cepa es altamente resistente a la gentamicina o no.
Ya no se recomienda la gentamicina para la endocarditis infecciosa estafilocócica de válvula nativa, porque no se ha documentado ningún beneficio clínico y entraña el riesgo de nefrotoxicidad. Sin embargo, está indicada en los casos de endocarditis infecciosa de válvula protésica, durante las 2 primeras semanas, en especial en los casos de infección por S. aureus resistente a la meticilina (SARM), con el fin de disminuir el riesgo de selección de mutantes de escape resistentes a la rifampicina.
La Food and Drug Administration aprobó el uso de 6 mg/kg de peso corporal de Daptomicina, 1 vez/día, para los adultos con bacteriemia por S. aureus y endocarditis infecciosa del lado derecho, siguiendo los resultados de un estudio aleatorizado que mostró su no inferioridad respecto del tratamiento estándar (vancomicina o una penicilina antiestafilocócica). Los estudios de observación también demostraron la eficacia de la daptomicina en los pacientes con endocarditis infecciosa del lado izquierdo y en los pacientes con endocarditis infecciosa de un dispositivo intracardíaco implantado (en dosis de 8-10 mg/kg/día). La daptomicina ha sido recomendada como una alternativa a la vancomicina para el tratamiento de los adultos con endocarditis infecciosa por SARM.
Tratamiento quirúrgico
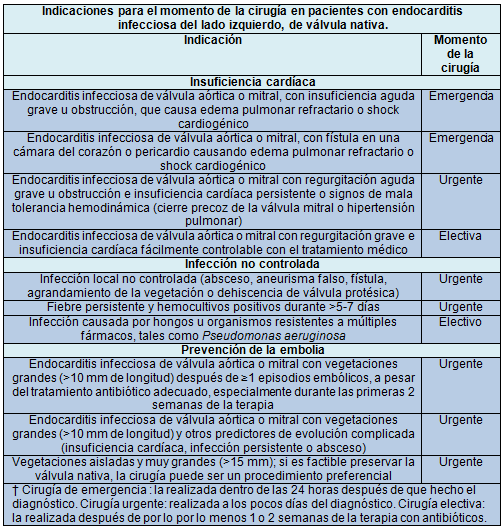
En las últimas 3 décadas, la tasa de reemplazo o reparación valvular precoz (por ej., cirugía realizada durante el tratamiento antibiótico de la endocarditis infecciosa) ha aumentado casi un 50%. Las principales indicaciones de la cirugía valvular precoz son la insuficiencia cardíaca, la infección no controlada y la prevención de eventos embólicos. Los estudios de observación que evaluaron las asociaciones entre el momento de la cirugía y los resultados obtuvieron datos dispares.
En un estudio aleatorizado reciente de 76 pacientes con endocarditis infecciosa grave del lado izquierdo y una gran vegetación, pero sin indicación de cirugía de emergencia en el momento de la aleatorización, la incidencia de un punto final compuesto, de muerte intrahospitalaria o de eventos embólicos dentro de las 6 primeras semanas posteriores a la aleatorización, fue significativamente más baja en el grupo operado dentro de las 8 horas posteriores a la aleatorización que en el grupo bajo tratamiento habitual (3% vs. 23%); el beneficio fue el resultado de la reducción de los eventos embólicos. Sin embargo, no está claro si esos resultados podrían generalizarse para avalar el uso sistemático de la cirugía valvular precoz, porque los pacientes que participaron en el estudio eran jóvenes (edad media, 47 años), con una frecuencia de condiciones coexistentes baja y muy baja mortalidad (<5%).
Luego de un evento embólico cerebral, la mayoría de los pacientes sigue requiriendo la cirugía valvular. Al momento de decidir la cirugía se debe tener en cuenta el riesgo de que se produzcan más episodios embólicos y los riesgos asociados a la cirugía. La incidencia de accidente cerebrovascular en los pacientes tratados con los antibióticos apropiados descendió de 4,8 casos/1.000 pacientes-día en la primera semana de tratamiento a 1,7/1.000 pacientes-día en la segunda semana, manteniéndose luego esa tendencia descendente. El antecedente de accidente cerebrovascular embólico o de accidente cerebrovascular isquémico transitorio no es por sí mismo una contraindicación de cirugía. El deterioro neurológico posoperatorio es infrecuente después de una embolia cerebral silente o un accidente cerebrovascular isquémico transitorio. Luego de un accidente cerebrovascular isquémico, el riesgo asociado a la cirugía depende de la condición neurológica del paciente; en general, la cirugía se realiza cuando el paciente no tiene un daño cerebral importante y una vez descartada la hemorragia cerebral mediante imágenes cerebrales.
Tratamiento anticoagulante y antiplaquetario
En los pacientes con endocarditis infecciosa de válvula protésica por S. aureus bajo tratamiento con agentes anticoagulantes orales, los datos de observación indican un aumento del riesgo de muerte por hemorragia cerebral sin reducción del riesgo de eventos embólicos.
La guía de la European Society of Cardiology recomienda que en los pacientes que están recibiendo anticoagulantes orales y desarrollan una endocarditis infecciosa complicada con un accidente cerebrovascular isquémico y no hemorrágico, el agente anticoagulante oral sea reemplazado por heparina durante 2 semanas; sin embargo, la guía reconoce el escaso nivel de evidencia que hay para avalar esta recomendación.
Los agentes antiplaquetarios no están recomendados para los pacientes con endocarditis infecciosa. En un estudio controlado con placebo, no ciego, los pacientes con endocarditis infecciosa asignados al azar para recibir 325 mg de aspirina diarios durante 4 semanas no mostraron un descenso significativo de la incidencia de eventos embólicos y sí, un aumento no significativo de la tasa de episodios de sangrado cerebral. Los estudios de observación han obtenido resultados conflictivos con respecto a las asociaciones de la aspirina antes de la endocarditis infecciosa con los riesgos de muerte y eventos embólicos. En ausencia de sangrado, se puede seguir tomando la aspirina administrada por otras indicaciones.
Profilaxis
En la década pasada, la indicación de profilaxis antibiótica contra la endocarditis infecciosa, basada en opiniones especializadas, estaba estrictamente reservada para los pacientes con prótesis valvular, historia de endocarditis infecciosa o, cardiopatía congénita cianótica no reparada y, para pacientes que están por ser sometidos a un procedimiento odontológico invasivo.
En el Reino Unido ya no se recomienda la profilaxis antibiótica contra la endocarditis infecciosa en cualquier circunstancia. Hasta la fecha y desde que las guías fueron revisadas y aconsejan el uso restringido de la profilaxis antibiótica, no se ha observado un aumento apreciable de la incidencia de endocarditis infecciosa por estreptococos del grupo viridans. Para reducir los riesgos se recomienda una buena higiene oral, dental y cutánea.
Áreas de incertidumbre
Todavía no se ha establecido cuál es la duración apropiada del tratamiento antibiótico, especialmente de los aminoglucósidos. Aunque un estudio de drogadictos intravenosos mostró que la combinación de ciprofloxacina oral con rifampicina es eficaz para la endocarditis infecciosa por S. aureus, en la actualidad no se puede recomendar el tratamiento oral para la endocarditis infecciosa.
A pesar de que un ensayo aleatorizado reciente sugiere un beneficio de la cirugía precoz, todavía sigue en estado de debate cuál es el momento adecuado de la cirugía. Cuando la misma se lleva a cabo dentro de la primera semana del tratamiento antibiótico, el riesgo de recaída y disfunción de la prótesis valvular puede aumentar.
También es incierta la utilidad de la realización sistemática de imágenes cerebrales y del tratamiento preferencial de los pacientes con aneurismas micóticos infecciosos y endocarditis cerebral. Debido a que los aneurismas indemnes pueden resolverse con un tratamiento antibiótico solo, los pacientes deben ser tratados con antibióticos y se debe documentar la resolución del aneurisma mediante la angiografía. El tratamiento endovascular debe hacerse solamente si el aneurisma es muy grande (por ej., >10 mm), o si no se resuelve, o su tamaño sigue en aumento a pesar del tratamiento antimicrobiano.
Conclusiones y recomendaciones
El paciente de la viñeta tiene signos de endocarditis infecciosa de la válvula mitral nativa complicada con embolia cerebral.
El inicio del tratamiento debe ser inmediato, después de haberse realizado 2 o 3 hemocultivos. Sobre la base de los resultados de los cultivos se indicará una aminopenicilina con un inhibidor ß lactámico (ampicilina con sulbactam o amoxicilina con clavulanato de potasio) combinados con gentamicina.
El evento embólico cerebral reciente y la presencia de una gran vegetación valvular móvil en el ecocardiograma son indicación de cirugía mitral urgente, en ausencia de contraindicaciones.
Si el hemocultivo es negativo en el momento de la cirugía, se obtendrá una muestra de tejido valvular para ser cultivada y para realizar un análisis de reacción en cadena de la polimerasa de amplio espectro, para identificar el microorganismo causante, adaptando el régimen antibiótico al microorganismo identificado. Se debe aconsejar al paciente la prevención de la endocarditis infecciosa (higiene oral y general y profilaxis antibiótica apropiada, dado que él ahora tiene antecedentes de endocarditis infecciosa y una prótesis valvular).
♦ Traducción y resumen objetivo: Dra. Marta Papponetti
