Introducción
El hábito de fumar ha sido implicado como el factor de riesgo aislado más importante y prevenible para el desarrollo de la enfermedad arterial periférica (EAP) [1-5]. Aunque la prevalencia del consumo de cigarrillos ha declinado en más del 50% entre 1965 y 2011, más de 45 millones de adultos o el 19% de los adultos de los EEUU, continúa fumando en la actualidad [6].
La prevalencia de EAP ajustada por edad entre los adultos estadounidenses es del 12%, afectando aproximadamente de 8 a 12 millones de norteamericanos, primariamente con 40 o más años de edad [5,7,8]. Hasta el 50% al 90% de los pacientes con EAP son fumadores en la actualidad o fueron fumadores en el pasado [1,9,10]. No sólo los fumadores tienen más probabilidad de desarrollar una EAP, también tienen más probabilidad de tener una progresión de la enfermedad [1,2,4,11-13].
Mientras que fumar ha sido identificado desde hace mucho tiempo como un factor de riesgo para el desarrollo y progresión de la enfermedad, un cuerpo creciente de evidencia sugiere que también es un factor de riesgo para malos resultados quirúrgicos [14-18]. Se ha asociado con un riesgo aumentado de complicaciones perioperatorias cardiovasculares, pulmonares y de cicatrización de la herida y ha sido descrito repetidamente en los campos de la cirugía general, plástica, ortopédica y cardíaca [14-18].
Varios estudios en el pasado han intentado discernir los predictores de la falla del injerto después de la cirugía de bypass infrainguinal. Los resultados de un gran meta-análisis, incluyendo una nueva publicación del año 2011, que examinó 187 registros de pacientes, mostró que continuar fumando postoperatoriamente, predijo la ocurrencia de falla del injerto a 1 y 5 años después de la cirugía de bypass infrainguinal [10,19,20].
Mientras que la persistencia postoperatoria en el hábito de fumar ha sido implicada más definitiva y consistentemente en la ocurrencia de falla del injerto a largo plazo, después del bypass infrainguinal, existe concomitantemente una falta de evidencia consistente, que describa los efectos del consumo persistente de tabaco preoperatoriamente, sobre los resultados tempranos después de la cirugía de bypass infrainguinal [19]. Aunque Lancaster y col. [21] identificaron que fumar dentro del año anterior a la cirugía de bypass infrainguinal era un predictor independiente de falla temprana del injerto, esa asociación no apareció después del ajuste del riesgo hecho por Singh y col. [22], en 2008.
El propósito de este estudio fue evaluar el impacto de fumar activamente en el preoperatorio, sobre la ocurrencia de falla del injerto dentro de los 30 días después de la cirugía de bypass infrainguinal, e identificar los factores asociados con el estatus del fumador que puedan explicar la disparidad en las tasas de falla del injerto.
Métodos
Origen de los datos y criterios de inclusión
Este estudio utilizó datos recolectados prospectivamente del sector privado del American College of Surgeons National Surgical Quality Improvement Program (ACS-NSQIP), desde 2005 hasta 2011. La base de datos contiene información clínica seleccionada, desde el período preoperatorio hasta los 30 días postoperatorios, de procedimientos quirúrgicos mayores que son sistemáticamente muestreados de los hospitales participantes. La información minuciosa y actualizada descrita en el NSQIP y la metodología de muestreo e implementación del programa, han sido publicadas en otra parte [23.24].
La población del estudio fue identificada usando los códigos de la Current Procedural Terminology para el bypass infrainguinal en el campo del procedimiento principal (35556, 35566, 35570, 35571, 35583, 35587, 35656, 35666 y 35671). Se excluyeron los procedimientos que estuvieron asociados con los códigos de diagnóstico primario postoperatorio de la International Classification of Diseases, Ninth Revision (ICD-9), yendo desde el 444.0 hasta el 444.9, indicando un evento tromboembólico agudo, procedimientos en la extremidad inferior no infrainguinales realizados bajo la misma anestesia, y procedimientos que fueron codificados como reoperaciones o revisiones (35700, 35879, 35881, 35883 y 35884).
Finalmente, los casos con pérdida de la información para edad, sexo, raza, estatus del fumador, isquemia crítica de miembros (ICM) y falla del injerto (n = 1671), fueron excluidos, resultando en una cohorte final de 16.534 bypasses infrainguinales. Un análisis completo del caso fue realizado después de asegurase que las características de la población, comparando la cohorte final con aquellos excluidos por pérdida de datos, fueran comparables entre sí.
Recolección de datos
Las variables utilizadas en este estudio incluyen factores demográficos, tales como edad, sexo y raza. La raza fue recategorizada en una variable binaria, blanco vs no blanco. Los no blancos comprendieron negros, hispanos, asiáticos, isleños del Pacífico y nativos americanos.
El índice de masa corporal (IMC) fue calculado y los pacientes con un IMC ≥ 30 kg/m2 fueron clasificados como obesos. Los fumadores activos fueron definidos por el ACS-NSQIP como personas que habían fumado cigarrillos en cualquier momento dentro del año previo a la cirugía.
La presencia de comorbilidades predefinidas, así como la necesidad de transfusiones de glóbulos rojos dentro de las 72 horas antes de la cirugía, infección preoperatoria de la herida y estado funcional, estuvieron entre los factores preoperatorios de riesgo que fueron explorados. Además, la trombocitosis fue definida como un recuento de plaquetas por encima de 400 x 103 /mm3. La EAP fue definida por los códigos primarios de diagnóstico de 440.20 a 440.24 y 443.9, o por una definición del NSQIP de “enfermedad vascular periférica”.
La presentación de la enfermedad y los detalles operatorios que fueron recolectados, incluyeron la presencia de ICM (definida como la presencia de ulceración isquémica o pérdida de tejido relacionada con la enfermedad vascular periférica), nivel del bypass (poplíteo vs tibial), tipo de injerto utilizado (vena vs prótesis) cirugía electiva vs de urgencia, clasificación del estado clínico de la ASA (American Society of Anethesiologists), equipo quirúrgico primario, participación del residente, cualquier tipo de cirugía mayor realizado dentro de los últimos 30 días y duración de la operación.
El resultado principal evaluado, fue la ocurrencia de falla del injerto del bypass dentro de los 30 días después de la cirugía. El ACS-NSQIP define la falla del injerto como “una falla mecánica de un injerto o prótesis extracardíaco, incluyendo colgajos miocutáneos e injertos de piel, que requiere el retorno a la sala de operaciones, radiología intervencionista o angioplastia con balón, dentro de los 30 días de la operación”. Para asegurase de que se estaban capturando fallas de injertos relacionadas con cirugía de bypass infrainguinal, se excluyó a los pacientes que habían sido sometidos a procedimientos de bypass no infrainguinal concomitantes o adicionales, que involucraban la inserción de prótesis, colgajos o injertos en otros sitios. El número promedio de días hasta la ocurrencia de la falla del injerto, fue también descrito.
Finalmente, las complicaciones postoperatorias predefinidas, mortalidad, retorno a la sala de operaciones, duración de la estadía postoperatoria y disposición al egreso, fueron analizados. Además, se creó una variable compuesta para definir las complicaciones postoperatorias tempranas, comprendiendo a las de la herida, cardíacas, pulmonares, renales u otras (sangrado, septicemia y tromboembolismo venoso). Eso incluyó todas las complicaciones que ocurrieron antes de la mediana de tiempo para la falla del injerto.
Análisis estadístico
Se realizó un análisis bivariado para describir la distribución de las características demográficas, factores de riesgo preoperatorios y detalles quirúrgicos, comparando a los fumadores activos con los no fumadores. Para las variables categóricas, las cuentas y proporciones fueron presentadas junto a valores de P, de las pruebas de x2 y exacta de Fisher. Para las variables continuas, la distribución de los datos fue evaluada y testeada para su normalidad, por medio de histogramas y gráficos q-q.
Para los datos normalmente distribuidos se presentaron medias y desvíos estándar (DE) y se computó una prueba de t. Dado que la duración de la operación y de la estadía postoperatoria tenían una distribución asimétrica, se presentaron medianas y rangos intercuartilares (RIC) y se efectuó una prueba rank sum de Wilcoxon, para comprobar la igualdad de las medias.
Las cuentas y proporciones para la falla del injerto a 30 días fueron computadas comparando fumadores activos con no fumadores. Se desarrollaron modelos ajustados de regresión logística, usando variables que estaban asociadas tanto con el estatus de fumador actual como con la falla del injerto, en combinación con variables identificadas en estudios previos, para evaluar el impacto del estado de fumador actual sobre la falla temprana del injerto [20-22]. Los términos de interacción para el estatus de fumador e ICM, nivel del bypass y tipo de injerto, y uso de alcohol e ICM, fueron testeados.
Los factores de inflación de la varianza y un índice de condición, fueron calculados para comprobar la multicolinealidad entre las variables controladas para el modelo de regresión final. Los no fumadores fueron usados como una categoría de referencia en el análisis de regresión. La odds ratio (OR) final ajustada, su correspondiente intervalo de confianza (IC) del 95% y el valor de P fueron presentados. Un valor de P < 0,05 fue considerado significativo. Todo el análisis de datos fue realizado con el programa Stata MP 12.0 (College Station, TX).
Resultados
Características demográficas y basales en cada grupo en estudio
Un total de 16.534 procedimientos de bypass infrainguinal, realizados en 6.614 (40,0%) fumadores activos y en 9.920 (60,0%) no fumadores, fueron identificados entre 2005 y 2011. La edad media de los pacientes para el global de la población en estudio fue de 68,0 ± 11,7 años, y 10.558 pacientes (63,9%) fueron hombres. La mayoría de los procedimientos fueron realizados en pacientes de raza blanca (n = 12.543; 75,9%; Tabla 1).
• TABLA 1: Características demográficas y basales de la población en estudio, estratificadas por el estatus de fumador.
Los fumadores activos fueron significativamente más jóvenes, de raza no blanca y menos probablemente obesos (26,1% vs 31,3%) comparado con los no fumadores. Menos fumadores activos tenían una comorbilidad cardiovascular, tal como hipertensión, diabetes, insuficiencia cardíaca congestiva, cirugía cardíaca o intervención coronaria percutánea previas y ataque isquémico transitorio, comparado con los no fumadores. Los fumadores activos tuvieron menos probabilidad de tener una enfermedad renal en estadio terminal requiriendo diálisis, infección preoperatoria de herida o sepsis; tuvieron menor probabilidad de ser funcionalmente dependientes y de tener alguna operación mayor dentro de los 30 días previos a la cirugía de bypass infrainguinal.
Presentación y detalles operatorios
Globalmente, el 53,3% (n = 8.820) de los pacientes sometidos a bypass infrainguinal durante el período en estudio, tenían ICM (Tabla 2). Tanto los fumadores activos como los no fumadores que fueron sometidos a cirugía de bypass infrainguinal tuvieron la misma probabilidad de presentar ICM (53,1% vs 53,5%; P = 0,61). Significativamente más fumadores activos recibieron revascularización proximal a nivel poplíteo, comparado con los no fumadores (66,1% vs 52,2%; P < 0,001). Correspondientemente, más fumadores activos recibieron injertos protésicos, comparado con los no fumadores (33,6% vs 30,9%; P = 0,001).
• TABLA 2: Características de presentación y detalles operatorios de los pacientes sometidos a bypass infrainguinal, estratificados por el estatus de fumador.
La mayoría de los procedimientos fue realizada por un cirujano vascular (95,0% vs 94,7%; P = 0,06) y bajo anestesia general (88,7% vs 90,4%; P = 0,01) tanto para fumadores como no fumadores. Significativamente, más no fumadores, comparado con los fumadores activos, fueron operados por un equipo quirúrgico que incluía a un residente (65,7% vs 63,8%; P = 0,01). La mediana de la duración de la operación entre los no fumadores fue mayor comparada con la de los fumadores activos (212 minutos [RIC, 157-281] vs 198 minutos [RIC, 146-267]; P < 0,001).
Complicaciones postoperatorias dentro de los 30 días
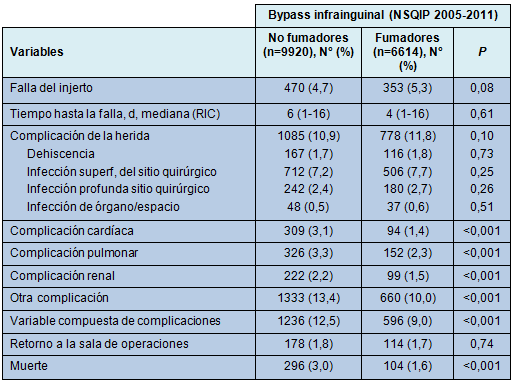
Significativamente, más no fumadores que fumadores activos tuvieron complicaciones cardíacas (3,1% vs 1,4%; P < 0,001), pulmonares (3,3% vs 2,3%; P < 0,001), renales (2,2% vs 1,5%; P = 0,001) u otras (13,4% vs 10,0%; P < 0,001), dentro de los 30 días después de la cirugía (Tabla 3). Sin embargo, no hubo diferencia en las tasas de complicación de la herida por el estatus de fumador (P = 0,10).
La mediana de la duración de la estadía hospitalaria fue significativamente mayor entre los no fumadores, comparado con los fumadores activos (5 días [RIC, 3-8] vs 4 días [RIC, 3-6]; P < 0,001). Comparado con los fumadores activos, los no fumadores tuvieron mayor probabilidad de ser transferidos para atención ulterior aguda o subaguda (18,5% vs 9,8%) o cuidados crónicos (16,3% vs 8,3%; P < 0,001).
• TABLA 3: Distribución de otras complicaciones postoperatorias después de la cirugía de bypass infrainguinal, estratificada por el estatus de fumador
Impacto del estatus de fumador sobre la falla del injerto dentro de los 30 días
Dentro de los 30 días de ser sometidos a un bypass infrainguinal, 82,3 pacientes (5.0%) desarrollaron falla del injerto. La tasa no ajustada de falla del injerto fue bastante similar comparando los fumadores activos (n = 353; 5,3%) con los no fumadores (n = 470; 4,7%) (P = 0,08). La mediana del tiempo hasta la falla del injerto en toda la cohorte fue de 5 días (RIC, 1-16). No hubo diferencia en el momento de la falla del injerto entre fumadores activos y no fumadores (P = 0,61; Tabla 3).
Estratificados por el nivel del bypass, los fumadores activos que fueron sometidos a bypass a nivel poplíteo tuvieron un aumento relativo del 31% en el riesgo para desarrollar falla temprana del injerto, en comparación con los no fumadores y un 24% de aumento relativo después de la revascularización a nivel tibial (P = 0,02, para ambos).
En la regresión multivariada, la probabilidad de falla temprana del injerto entre los fumadores activos fue 21% más alta que en los no fumadores (OR, 1,21; 95% IC, 1,021,43: P = 0,03; Tabla 4). Después de ajustar por edad, sexo femenino, raza no blanca, ICM, revascularización distal, uso de injerto protésico, consumo de alcohol, diabetes, cirugía cardíaca o intervención coronaria percutánea previas, cirugía de emergencia y la presencia de otras complicaciones ocurriendo dentro de los 5 primeros días de la cirugía, permaneció significativamente asociada con la falla temprana del injerto.
• TABLA 4: Regresión logística multivariada de la falla del injerto dentro de los 30 días, comparando fumadores activos con no fumadores, después de cirugía de bypass infrainguinal (N = 16.534).
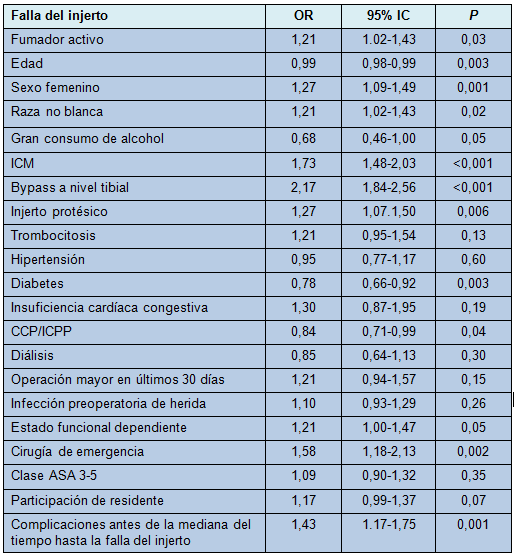
No se encontró que los términos de interacción comprobados fueran significativos y, por lo tanto, no fueron incluidos en el modelo final. El modelo final tuvo una prueba estadística de Hosmer-Lameshow de P > 0,05. Los factores de inflación de la varianza que fueron calculados para comprobar la multicolinealidad, oscilaron entre 1,5 y 2,5, y el índice de condición final estuvo por debajo de 30.
Discusión
La prevalencia de EAP afectando a los adultos estadounidenses ha aumentado sustancialmente durante la década pasada, afectando en la actualidad hasta 12 millones de americanos [7,8]. Fumar cigarrillos ha sido implicado como uno de los factores de riesgo más importantes y prevenibles en el desarrollo y progresión de la EAP [1-3,5,25].
La cirugía de bypass infrainguinal es una modalidad de tratamiento bien establecida para los candidatos adecuados que presentan una EAP sintomática [26,27]. El presente estudio analizó 16.534 pacientes sometidos a cirugía de bypass infrainguinal, 40% de los cuales eran fumadores activos antes de la cirugía. Dentro de los 30 días de la cirugía de bypass, se reportó la falla del injerto en 823 pacientes (5,0%). Esos hallazgos son consistentes con estudios previos, reportando tasas de falla del injerto dentro de los 30 días del 4,5% al 7,4%, después de la cirugía de bypass infrainguinal [10,21,22].
Aunque fumar es un factor de riesgo conocido para el desarrollo y progresión de la EAP, así como para el aumento del riesgo de falla del injerto a largo plazo, ha habido reportes conflictivos sobre el papel de fumar persistentemente en el preoperatorio, en la falla temprana del injerto [21,22,28]. Los dos estudios que han examinado el efecto de fumar preoperatoriamente sobre la falla temprana del injerto, fueron también análisis del NSQIP. Lancaster y col. [21], analizaron el ACS-NSQIP e identificaron el fumar activamente como un predictor independiente de la falla temprana del injerto.
Singh y col. [22], reportaron similarmente que fumar activamente se asoció con falla temprana del injerto, en el análisis univariado en la base de datos de los Veterans Affairs (VA) del NSQIP. Después de ajustar el riesgo, la asociación entre el estatus preoperatorio de fumador y la falla temprana del injerto se perdió. Sin embargo, el VA-NSQIP está compuesto por 99% de hombres y 53% de fumadores activos. No solo que se sabe que las mujeres tienen un riesgo mayor de falla del injerto, sino que el análisis de la base de datos VA-NSQIP, no compara las características de los fumadores activos con las de los no fumadores. Por lo tanto, los patrones de comorbilidad, ICM y tipo de bypass (en relación con el estatus de fumador) no fueron analizados específicamente en el grupo de pacientes de VA-NSQIP.
El presente análisis mostró que los pacientes que habían fumado en el año previo a la cirugía, tuvieron un 19% de aumento del riesgo global de falla temprana del injerto, después del ajuste del riesgo, comparado con los no fumadores. La falla temprana del injerto, si ocurre, es probable que se deba a falla técnica [10]. Si la selección de pacientes, preparación y técnica quirúrgica son optimizadas, la tasa de falla del injerto debería ser hipotéticamente similar, independientemente del estatus del fumador.
El riesgo aumentado de falla temprana del injerto que se observó en esta población de pacientes, sugiere la probabilidad de que la exposición al tabaco, en cualquier momento dentro del año previo a la cirugía, confiere un riesgo diferencial hacia el desarrollo de una oclusión clínicamente detectable, aún dentro de los primeros 30 días después de la cirugía.
Estudios previos han demostrado que los hidrocarburos, monóxido de carbono y nicotina en el cigarrillo, conducen a la formación de placas ateroescleróticas, por lesión del recubrimiento endotelial dentro de las arterias, disminuyendo las lipoproteínas de alta densidad, incrementando los niveles de fibrinógeno y promoviendo la agregación plaquetaria y el estado de hipercoagulabilidad [11,13,26,29,30]. Además, la oxidación de la metionina sobre la trombomedulina puede llevar también a un estado protrombótico visto en los fumadores [31].
Es posible que la exposición preoperatoria persistente al humo del cigarrillo, predisponga al paciente a la falla del injerto, prontamente después de la cirugía. No está en claro cuánto tiempo exactamente permanecen las toxinas del cigarrillo en la circulación. El Report of the Surgeon General de 1990, estableció que mientras que la circulación mejora generalmente 2 a 3 meses después de dejar de fumar, los efecto del tabaco permanecen hasta 2 años después [32].
La presencia de ICM, revascularización distal, uso de injerto protésico, cirugía de emergencia, trombocitosis, insuficiencia o falla renal y estado funcional dependiente, están entre los factores modificables que han sido asociados con tasas aumentadas de falla del injerto [19,19,22,33]. La evaluación de las comorbilidades, características presentes y detalles intraoperatorios, no reveló que los fumadores activos, en la población de pacientes estudiada, tuvieran tasas más altas de muchos de esos predictores conocidos de falla del injerto, excepto el uso de injertos protésicos. También se han descrito en el pasado resultados inferiores a largo plazo, asociados con el uso de injertos protésicos, especialmente en los procedimientos de revascularización distal [27,28,33,34]. Los resultados actuales argumentan a favor de un uso prudente de los injertos protésicos en fumadores activos, independientemente del nivel del bypass.
Aparte de esos factores de riesgo, la edad avanzada, sexo femenino y raza minoritaria, han demostrado ser un factor grande de riesgo para la falla del injerto [10,21,22,35]. En este análisis, la edad más joven – en cambio – se asoció con un riesgo mayor de falla del injerto. Eso fue apoyado por la observación de que los fumadores activos sometidos a una cirugía de bypass infrainguinal, eran significativamente más jóvenes que los no fumadores. La brecha en la edad entre no fumadores y fumadores activos, fue de aproximadamente 9,3 años y es consistente con estudios previos describiendo que los fumadores tendían a ser diagnosticados con EAP, 10 años antes que los no fumadores [1,2,4,11,12].
Además, proporcionalmente más fumadores activos fueron de raza no blanca. Estudios previos han mostrado que los pacientes de raza negra e hispanos, tienen mayor probabilidad de desarrollar una falla del injerto a 1 y 5 años, después de la cirugía de bypass infrainguinal [35,35].
La revascularización distal presenta significativamente más desafíos técnicos al cirujano vascular que los bypasses a nivel proximal. Los pacientes con diabetes y otras comorbilidades cardiovasculares, han demostrado ser más proclives para desarrollar enfermedad ateroesclerótica infrapoplítea, mientras que los fumadores tienen mayor probabilidad de desarrollar placas ateroescleróticas en vasos más grandes y proximales del miembro inferior, especialmente la arteria femoral superficial [2,26].
En el presente estudio de población, hubo aproximadamente 1,5 veces más pacientes con diabetes en el grupo no fumador que en el grupo de los fumadores activos. Eso puede explicar porqué hubo más fumadores activos que tuvieron un bypass a nivel poplíteo, mientras que significativamente más no fumadores tuvieron bypasses a nivel tibial. No obstante, a pesar de tener mayor probabilidad de recibir un bypass proximal, los fumadores activos tuvieron aún un riesgo mayor de desarrollar una falla temprana del injerto.
Luego de estratificados por el sitio del bypass, la falla temprana de injerto continuó ocurriendo más frecuentemente en los fumadores activos que en los no fumadores, pero la diferencia relativa en ese riesgo fue mayor en los pacientes que tuvieron bypasses proximales. Además, más fumadores activos tuvieron injertos protésicos. Eso podría haber estado relacionado con más sitios de bypass proximal o con una vena autógena inadecuada.
Aunque este estudio de población comprende fumadores activos que fueron significativamente más jóvenes y que tuvieron pocas comorbilidades, un mejor estado funcional y más bypasses a nivel poplíteo, su riesgo para una falla temprana del injerto fue 19% más alto que en los no fumadores, una disparidad que fue en gran parte impulsada por una mayor proporción de ellos teniendo bypasses a nivel proximal e injertos protésicos. No obstante, este estudio está limitado por su naturaleza observacional, que permite solamente describir la asociación entre fumar persistentemente en el preoperatorio y la ocurrencia de falla temprana del injerto, después del bypass infrainguinal, sin que implique causalidad.
Asimismo, la base de datos del ACS-NSQIP no contiene identificadores basados en región o centro asistencial. Efectos de agrupamiento por variaciones regionales no pueden ser contabilizados en el análisis de los autores. Además, fuera del reporte de antecedentes de ICM, no había información clínica adicional, que permitiera la identificación de la localización exacta, la longitud de la vasculatura afectada del miembro inferior, o la disponibilidad o calidad del injerto autógeno.
Los fumadores activos definidos en el NSQIP, no incluyen a todas las formas de uso del tabaco, sino solo al cigarrillo. Además, la intensidad y duración del hábito de fumar, están inadecuadamente consignadas en la base de datos. La información de consumo de paquetes de cigarrillos por año en la base de datos, estuvo perdida en el 40% del estudio de población. Los no fumadores comprenden personas que nunca fumaron o que fumaron en el pasado. Asimismo, entre aquellos con pasado de fumador, el momento de cesación de fumar no es conocido.
A pesar de esas limitaciones, la fortaleza principal de este estudio, es el gran número de procedimientos de bypass infrainguinal en el mundo real que estuvo accesible para el análisis. Eso resultó en un poder estadístico del 81% para detectar una diferencia significativa en la ocurrencia de falla temprana del injerto a través del estatus de fumador. Además, es uno de los mayores análisis que examina específicamente el impacto de fumar persistentemente en el preoperatorio, sobre la ocurrencia de falla temprana de injerto, después de la cirugía de bypass infrainguinal.
Conclusiones
Los pacientes que continúan fumando en cualquier momento dentro del año previo a la cirugía de bypass infrainguinal, tienen una probabilidad ajustada de riesgo para desarrollar una falla temprana del injerto. Se requiere investigación adicional para determinar un período óptimo de abstinencia de fumar, entre los fumadores activos que requieren una cirugía de bypass infrainguinal, para minimizar el riesgo de falla temprana de injerto. Para ello, es necesario un profundo conocimiento del rol de la duración e intensidad de fumar en esa población de pacientes, para optimizar el éxito de los planes de cesación preoperatoria de fumar.
♦ Comentario y resumen objetivo: Dr. Rodolfo D. Altrudi