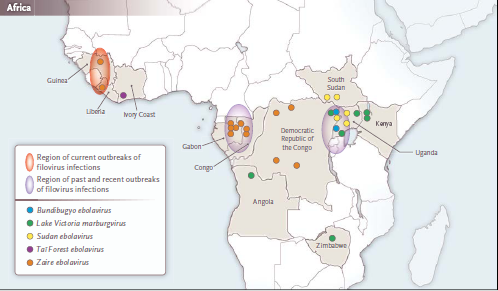
El reciente surgimiento del Ébola virus Zaire en África occidental1 ha llegado como una sorpresa en una región más conocida por su endémica fiebre de Lassa, otra fiebre hemorrágica viral causada por un arenavirus del Viejo Mundo. Sin embargo, en la región se ha registrado actividad del ébolavirus anterior a este momento.
A mediados de la década de 1990, los científicos descubrieron el ébolavirus Côte d'Ivoire (ahora conocido como Tai Bosque ebolavirus) como causa de un solo caso no fatal reportado por un investigador que llevaba a cabo una necropsia en un chimpancé infectado. El episodio inició una investigación importante alrededor de la región de Tai Forest, un esfuerzo que no pudo identificar el depósito de esta nueva especie de Ébola. Desde ese incidente, los países de África Occidental no han reportado ninguna evidencia de la presencia del virus Ébola.
Los ébolavirus pertenecen a la familia Filoviridae, un grupo taxonómico de virus con envoltura, de ARN de cadena negativa no segmentado que incluye a los géneros Marburg virus y cuevavirus, con una sola especie cada uno, y al ébola virus, con cinco especies. Todos los ébolavirus africanos conocidos pueden infectar a los humanos y causar síntomas similares, pero varían en términos de progresión de la enfermedad y de virulencia, con tasas de mortalidad que oscilan entre menos de 40% para el Bundibugyo ébol avirus hasta aproximadamente el 50% para el Sudán ebolavirus, y de 70 a 90% para el Zaire ebolavirus.2 La virulencia de Tai ébola virus forestal es difícil de evaluar porque no ha habido un solo caso registrado, y la especie asiática Reston ébola virus, parece causar una infección asintomática en los seres humanos.
Los seres humanos infectados con ébola virus comúnmente se presentan inicialmente con síntomas inespecíficos como: fiebre, vómitos y diarrea severa, con hemorragia visible que aparece en menos de la mitad de los casos como en el brote actual.1 2
Debido a la deficiente infraestructura, a las preocupaciones de bioseguridad asociadas a los procesos de cuidado, a la autopsia de los pacientes y al foco esencial en la contención de la enfermedad durante los brotes, ha habido poco estudio empírico para entender la patogénesis de la infección o la patología del ébolavirus humano.
Los modelos de enfermedad sustitutos más cercanos son monos, el cynomolgus y el macacos rhesus, que presentan signos clínicos de fiebre hemorrágica viral cuando se infectan con la mayoría de ébolavirus. El Zaire ébolavirus es letal de manera uniforme en estos macacos y los expertos han asumido que su patología y fisiopatología se parecen mucho a los de las infecciones de virus Ébola en los seres humanos: inmunosupresión, aumento de la permeabilidad vascular, y deterioro de la coagulación han sido identificados como los sellos distintivos de la enfermedad.2
En general se encuentra evidencia de hemorragia microscópica pero el grado de sangrado varía de indetectable a agudamente visible. La denominación introducida recientemente de "enfermedad del virus del Ébola" no puede transmitir la gravedad de una fiebre hemorrágica viral con un síndrome clínico que debe dar lugar a pautas de aislamiento que aseguren el manejo de los casos y la aplicación apropiada de medidas de control de infecciones.
Los ébolavirus son patógenos zoonóticos supuestamente transportados por diversas especies de murciélagos de la fruta que están presentes en toda África central y subsahariana. En contraste con el Marburgvirus, cuyo depósito se ha identificado en los murciélagos de la fruta Rousettus aegyptiacus, 3 los ébola virus aún no han sido aislados de murciélagos que tengan evidencia molecular y sero-epidemiológica de la infección.
La introducción más probable a los humanos se produce a través del contacto directo con los murciélagos o con sus excreciones o secreciones o por contacto con otros huéspedes finales, como los grandes simios. Desde que el Reston ébola virus ha sido descubierto en los cerdos de las islas Filipinas, la posibilidad de que puedan ser huéspedes provisionales o amplificadores no debe ser desestimada hasta que sea dilucidada la ecología del ébola virus.
La transmisión de humano a humano conduce a brotes, que a menudo se inician mediante una única introducción procedente desde un reservorio de vida silvestre u otro huésped e involucran variantes de virus con poca diversidad genética, como en el brote actual en África Occidental.1 Por otra parte, algunos brotes registrados han tenido su origen en múltiples introducciones que han resultado en una mayor diversidad genética viral entre los posteriores distintas cadenas de transmisión de humano a humano. Dentro de una misma especie, sin embargo, se ha demostrado que las variantes del virus tienen una baja diversidad genética, a menudo menos de un pequeño tanto por ciento, como se ilustra por la nueva variante aislada de los pacientes en Guinea.1 Tal diversidad limitada por lo general conduce a la neutralización de la reactividad cruzada dentro de la especies.
La caracterización biológica de los diversos ébola virus Zaire, sus tasas de letalidad y su virulencia en modelos animales han fracasado hasta ahora para proporcionar pruebas convincentes de las diferencias obvias en la patogenicidad. Por lo tanto, se debe suponer que la nueva variante de África Occidental no es más virulenta que los ébola virus Zaire anteriores; una tasa de mortalidad de alrededor del 70%, si se confirma, incluso podría indicar menor virulencia.
El hallazgo de que la variante Guinea reside en una posición más basal dentro del clado (grupo de organismos que son clasificados juntos como descendientes de un ancestro común) que el anteriormente conocido ébola virus Zaire 1 argumenta en contra de una introducción desde África central y en su lugar apoya la probabilidad de una evolución distinta en África Occidental. Estos resultados refuerzan la hipótesis de que los ébola virus tienen una distribución geográfica más amplia de lo que se pensaba.
Actualmente no existe una profilaxis con licencia o tratamiento para cualquier infección por ébolavirus o Marburgvirus; por lo tanto, el tratamiento es meramente de soporte.2 Durante la última década, sin embargo, múltiples opciones han demostrado una eficacia prometedora en modelos macacos de filovirus, y algunos de los enfoques han completado o están por lo menos cercanos a la fase 1 de pruebas clínicas en seres humanos.4
El principal candidato para la intervención terapéutica parece ser el tratamiento con anticuerpos, que ha tenido éxito en macacos incluso cuando los anticuerpos se administran más de 72 horas después de la infección. Los enfoques de tratamiento que involucran ARN modulador (es decir, ARN de interferencia pequeños u oligómeros de morfolino fosforodiamidato) se están siguiendo de cerca, junto con una pequeña molécula prometedora como droga sintética, BCX4430.5
Los enfoques de vacunas más prometedores se basan en tecnologías recombinantes, tanto por virus como partículas producidas a través de la transfección del plásmido y vectores virales incompetentes y competentes para la replicación viral.4 Entre los últimos, los vectores del virus de la estomatitis vesicular han demostrado eficacia dentro de 24 a 48 horas después de la infección en macacos rhesus.
En ausencia de estrategias de intervención eficaces, el diagnóstico se convierte en un elemento clave de nuestra respuesta a los ébola virus. La detección de la infección descansa en gran medida en las técnicas moleculares que utilizan múltiples ensayos de reacción en cadena de la transcriptasa inversa de la polimerasa que se pueden utilizar en los sitios remotos de brotes. La detección de antígeno se puede realizar en paralelo o servir como prueba confirmatoria para el diagnóstico inmediato, mientras que los ensayos para la detección de anticuerpos (por ejemplo, IgM e IgG) son pruebas secundarias principalmente importantes en la vigilancia.
La detección molecular depende en gran medida de la conservación de la secuencia, y los ensayos establecidos pueden fallar cuando se aplican a las nuevas variantes o cepas de virus. Por lo tanto, el intercambio en tiempo real de la información, en particular los datos de la secuencia, es absolutamente fundamental para nuestra capacidad de respuesta, ya que cualquier retraso podría tener consecuencias desastrosas para la salud pública. Además, los diagnósticos siguen siendo esenciales para el proceso que consume tiempo de rastreo de contactos durante un brote y para superar los obstáculos a la reintroducción de los sobrevivientes en su comunidad.
El último brote del ébola virus Zaire en África Occidental de nuevo ha demostrado la capacidad limitada de los sistemas de salud pública para responder a las enfermedades transmisibles poco comunes, altamente virulentas. Los sectores médicos y de salud pública necesitan con urgencia mejorar la educación y la vigilancia. Y deben ser implementados en las regiones clave dentro o cerca de las áreas donde estos virus son endémicos los procedimientos de diagnóstico rápido y fiable para que los sistemas locales de salud pública no tengan que depender de los laboratorios de referencia distantes, que deberían desempeñar un papel más confirmatorio en el futuro.
Además, para optimizar las capacidades de diagnóstico y de respuesta, es fundamental que la información sea compartida en tiempo real, como lo fue durante la pandemia del síndrome respiratorio agudo severo y durante los brotes recurrentes de gripe.
A pesar de años de investigación sobre ébola virus y marburgvirus todavía no es posible administrar vacunas o tratamientos para la población en situación de riesgo o a los equipos de ayuda médica. Si vamos a practicar una medicina de vanguardia, en lugar de simplemente el control de brotes, tenemos que avanzar en enfoques que conduzcan hacia la aprobación y concesión de licencias. Esta brecha debería cerrarse en los próximos años si podemos seguir avanzando antes de que el Ébola (o un virus relacionado) golpee otra vez.
Referencias
- Baize S, Pannetier D, Oestereich L, et al. Emergence of Zaire Ebola virus disease in Guinea — preliminary report. N Engl J Med. DOI: 10.1056/NEJMoa1404505.
- Feldmann H, Geisbert TW. Ebola haemorrhagic fever. Lancet 2011;377:849-862
- Towner JS, Amman BR, Sealy TK, et al. Isolation of genetically diverse Marburg viruses from Egyptian fruit bats. PLoS Pathog 2009;5:e1000536-e1000536
- Friedrich BM, Trefry JC, Biggins JE, et al. Potential vaccines and post-exposure treatments for filovirus infections. Viruses 2012;4:1619-1650
- Falzarano D, Feldmann H. Possible leap ahead in filovirus therapeutics. Cell Res 2014 April 15 (Epub ahead of print).