| Introducción |
El hipoparatiroidismo es la mayor complicación post tiroidectomía, que puede llevar a una discapacidad de por vida. Aunque cirujanos experimentados pueden identificar la glándula paratiroides sin dificultad, cirujanos con menos experiencia pueden tener problemas para distinguir claramente la glándula paratiroides de los tejidos circundantes, debido a su pequeño tamaño y color, que es similar al del tejido fibroadiposo adyacente a la glándula tiroides. Por lo tanto, la hipocalcemia temporal o permanente puede ser causada por una resección o desvascularización inadvertidas de la glándula paratiroides, antes de su identificación por el cirujano, durante una tiroidectomía.
La identificación de la glándula paratiroides durante una tiroidectomía depende de la inspección visual del cirujano [1]. Las técnicas por imágenes con azul de metileno [2] y verde de indocianina (VIC) [3] han sido introducidas para permitir a los cirujanos detectar fácilmente la glándula paratiroides, independientemente de su experiencia quirúrgica.
No obstante, la inyección del colorante fluorescente puede llevar a graves complicaciones [4]. En 2014, McWade y col. [5], reportaron una técnica para visualizar la glándula paratiroides usando autofluorescencia cercana al infrarrojo (CIR) sin un colorante exógeno. Sin embargo, las imágenes de la glándula paratiroides únicamente con autofluorescencia no mostraron orientación quirúrgica en relación con los órganos circundantes (esto es, glándula tiroides o tráquea) y el tejido fibroadiposo paratraqueal.
Estudios recientes han empleado dispositivos comerciales de imágenes CIR, tales como el Fluobeam, o un sistema endoscópico modificado CIR/VIC de Karl Storz [6-8], para ver la glándula paratiroides, además de las estructuras circundantes expuestas durante la tiroidectomía. Estos estudios se centraron en presentar imágenes autofluorescentes de las glándulas paratiroides expuestas por el cirujano, después de la disección de tejidos fibroadiposos cubriendo o rodeando a las mismas.
Asimismo, Ladurner y col. [8], sugirieron que el sistema no debería ser usado como una herramienta de detección de las glándulas paratiroides cuando las mismas no eran expuestas por el cirujano, porque el tejido fibroadiposo impedía la autofluorescencia.
El objetivo final de la imagen intraoperatoria de la glándula paratiroides debería ser no sólo detectar la glándula sino también preservar su función después de la cirugía tiroidea. Por lo tanto, la identificación de la glándula paratiroides antes de la disección de los tejidos paratraqueales y de la exposición de la misma, puede minimizar su manipulación, prevenir la lesión inadvertida a sus vasos asociados y, potencialmente, reducir la incidencia de hipocalcemia post tiroidectomía [4].
Los autores de este trabajo, basados en un estudio previo usando una cámara réflex digital de lente única y una fuente de luz CIR, que presentaba imágenes intraoperatorias en tiempo real de las glándulas paratiroides dentro de todo el campo de visión operatorio [9], hipotetizaron que la penetración de algunos milímetros en profundidad de la CIR podía ayudar a la identificación de la glándula paratiroides, antes de la disección de los tejidos fibroadiposos que la recubren. Llamaron a esta técnica mapeo de la glándula paratiroides. En este estudio, apuntan a demostrar la factibilidad del mapeo de la glándula paratiroides con autofluorescencia CIR y a evaluar si puede ayudar a los cirujanos a identificar las localizaciones de las glándulas paratiroides antes de su identificación a simple vista.
| Métodos |
• Equipamiento para las imágenes de autofluorescencia cercana al infrarrojo
Los dispositivos usados para las imágenes fluorescentes en este estudio fueron introducidos en el estudio previo de los autores [9]. Los mismos consisten en 2 fuentes de luz y una cámara réflex digital de lente única (EOS Rebel T3, Canon). La primera fuente de luz era un diodo emisor de luz colimado de 780 nm (LED) (M780L3-C1, THORLABS); la segunda fuente fue un iluminador infrarrojo (IR) (INFRALUX-300, Daekyung Electro Medical Co.).
• Selección de pacientes y guía de 3 etapas para el mapeo de la glándula paratiroides
Este estudio incluyó 70 glándulas paratiroides normales de 38 pacientes (hombre:mujer = 10:28, edades 19 a 73 años), que fueron sometidos a cirugía tiroidea por carcinoma papilar (1 paciente tuvo un carcinoma papilar de tiroides y un adenoma paratiroideo), realizada por un único cirujano experimentado (KD Lee), entre julio de 2015 y enero de 2017. Se realizaron tiroidectomías totales (4 glándulas paratiroides en riesgo) en 17 pacientes, y lobectomías unilaterales (2 glándulas paratiroides en riesgo) en 21 pacientes.
Se efectuó disección profiláctica central ipsilateral del cuello en 31 pacientes; las disecciones terapéuticas bilaterales centrales del cuello fueron realizadas en 7 pacientes con sospecha de metástasis ganglionar linfática en nivel VI. Entre las 110 glándulas paratiroides en riesgo, 40 fueron detectadas por el cirujano sin el sistema de mapeo glandular y fueron excluidas del estudio. Este estudio clínico prospectivo fue aprobado por la Junta de Revisión Institucional del hospital y se obtuvo un consentimiento informado de todos los pacientes incluidos en el estudio.
Las imágenes de autofluorescencia CIR fueron obtenidas en 3 etapas con el dispositivo descrito. Las imágenes en la etapa P1 fueron obtenidas antes de la identificación de las glándulas paratiroides a simple vista, en las áreas donde se predice que estén ubicadas las glándulas superiores e inferiores. Las imágenes fueron tomadas mientras la porción lateral de la glándula tiroides era retraída medialmente y las glándulas paratiroides estaban aún embebidas en tejidos fibroadiposos del surco traqueo-esofágico, sin exposición por parte del cirujano.
La etapa P2 incluyó imágenes tomadas después de la identificación de las glándulas paratiroides a simple vista. Las imágenes de la etapa P2 fueron tomadas cuando las glándulas paratiroides no fueron detectadas durante la etapa P1, pero sí lo fueron después de la disección por un cirujano experimentado en tiroides.
Las imágenes de la etapa P3 fueron tomadas después de remover los especímenes quirúrgicos, cuando las glándulas paratiroides no fueron detectadas en las etapas P1 y P2. Debido a que la evaluación histológica de las glándulas paratiroides combinadas con las imágenes de la etapa 3 podría causar daño a las glándulas y sus vasos sanguíneos, la identificación de la glándula paratiroides se basó en la opinión de un cirujano experimentado.
Los autores definieron como positivos a aquellos casos en los que la autofluorescencia de las glándulas paratiroides fue identificada en cada etapa, y negativos en caso contrario. Cuando la etapa P1 fue positiva, el sitio de autofluorescencia fue cuidadosamente disecado para localizar a la glándula identificada por imágenes. Después de identificar a la glándula paratiroides, los autores no realizaron imágenes adicionales para el mapeo glandular, a los fines de minimizar la duración de la operación.
En las etapas P1 negativas, se avanzó hacia las imágenes P2 y P3. Los pacientes que tuvieron glándulas paratiroides espontáneamente identificables después de la movilización lateral o del lóbulo superior, fueron excluidos del estudio. Por lo tanto, la identificación definitiva de todas las glándulas paratiroides en esta serie fue lograda después de las etapas P1, P2 y P3.
• Análisis de los datos
Para evitar la resección o lesión innecesarias de cualquiera de las glándulas paratiroides, la sensibilidad y especificidad de las imágenes de autofluorescencia usadas para el mapeo glandular fueron validadas por un cirujano altamente especializado, basado en una inspección sin biopsia. Se usó el programa J para medir y comparar las intensidades de la fluorescencia de las paratiroides y de los tejidos circundantes. Específicamente, la relación paratiroides/tejido de fondo (P/T) fue definida como el área promedio de intensidad de fluorescencia de las glándulas paratiroides, dividido por la de los tejidos circundantes de fondo.
| Resultados |
• Identificación de la glándula paratiroides en cada etapa del mapeo
En la etapa P1 no fueron distinguidas visualmente por el cirujano porque estaban embebidas en tejido graso y conectivo (Fig. 1A). La imagen CIR con iluminación IR detectó a las glándulas paratiroides como áreas de mayor fluorescencia que los tejidos circundantes. Todo el campo operatorio, incluyendo la glándula tiroides y los instrumentos quirúrgicos, fue identificado, y el punto de fluorescencia de alta intensidad se presentó como correlacionado con las estructuras circundantes (Figs. 1B, C). El cirujano verificó que las manchas en las imágenes de mapeo se correspondían con las glándulas paratiroides subyacentes, mediante la remoción del tejido fibroadiposo.
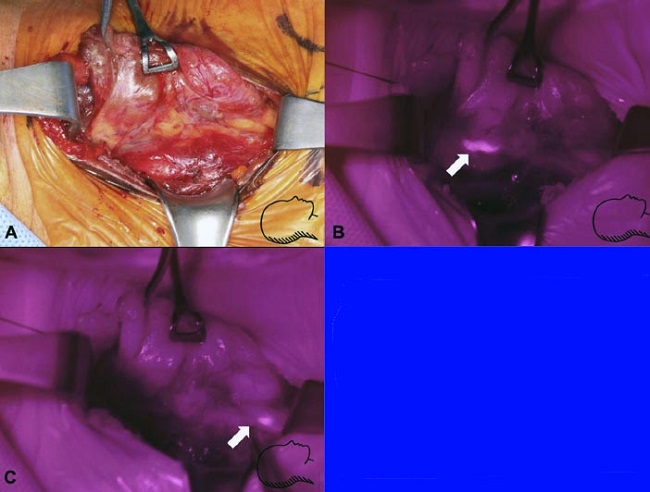
| FIGURA 1: imágenes de autofluorescencia y CIR-IR antes de la identificación de la glándula por visualización directa. (A) Imágenes con luz visible tomadas inmediatamente después de la exposición paratraqueal (sin ligadura de la vena tiroidea media). Las glándulas paratiroides no están expuestas. (B) La glándula paratiroides superior derecha (flecha) fue localizada con imágenes CIR-IR mientras estaba aún cubierta por tejidos grasos y conectivos. (C) La glándula paratiroides inferior derecha (flecha) debajo de los tejidos conectivos grasos fue localizada con imagen CIR-IR. |
La etapa P2 del mapeo glandular paratiroideo fue realizada cuando no se identificó fluorescencia en la etapa P1 (Figs. 2A, B). La imagen CIR fue tomada después de la disección de los tejidos fibroadiposos en el surco traqueo-esofágico y de la detección por el cirujano, para determinar si las glándulas paratiroides identificadas mostraban fluorescencia. Los vasos sanguíneos se presentaron como líneas de baja intensidad, sugiriendo que las estructuras vasculares relacionadas con las glándulas paratiroides podrían ser observadas a través del mapeo glandular (Figs. 2C, D).
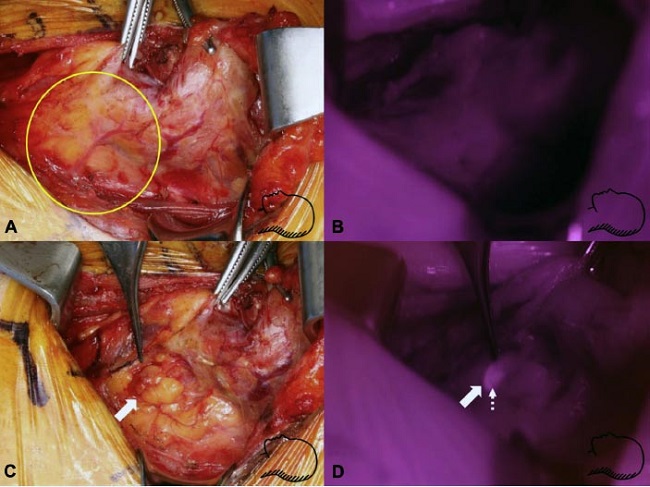
| FIGURA 2: imágenes de autofluorescencia y CIR-IR después de la identificación. (A) Imágenes con luz visible alrededor del polo inferior de la glándula tiroides (círculo). (B) No se detectó autofluorescencia de la paratiroides inferior debido al grosor de los tejidos grasos antes de la identificación de la misma por visualización directa (P1 negativa). (C) Después de la disección del tejido graso superficial, una estructura similar a la glándula paratiroides inferior (flecha) fue identificada. (D) La glándula paratiroides inferior (flecha) pudo ser localizada con imagen CIR-IR después de la identificación (P2 positiva). Se observa un fino vaso (flecha punteada) de la glándula paratiroides. |
Una glándula paratiroides que no fue identificada en la etapa P1 o P2 fue detectada en la etapa P3 en los tejidos resecados durante la disección del compartimiento central (Fig. 3). La glándula paratiroides removida inadvertidamente fue auto-trasplantada en el músculo esternocleidomastoideo. Una glándula paratiroides no fue identificada visualmente por el cirujano ni vista durante las 3 etapas del mapeo glandular.
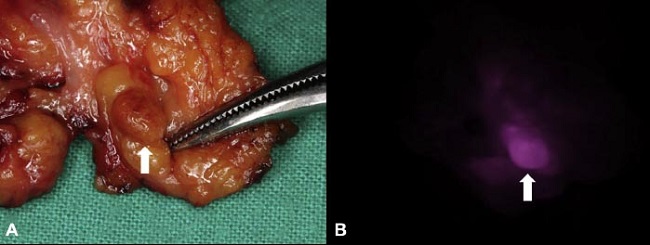
| FIGURA 3: imágenes de autofluorescencia y CIR-IR en un espécimen resecado en una disección central del cuello y espécimen de la tiroidectomía. (A) Una glándula paratiroides inadvertidamente removida en el espécimen de una disección central del cuello (flecha). (B) La glándula pudo ser identificada con la técnica de imagen CIR-IR, lo que hizo posible su auto-trasplante. |
Un paciente enrolado en el estudio tenía un adenoma paratiroideo y un carcinoma papilar de tiroides coexistente. Después de la ligadura de la arteria tiroidea superior, la tiroides fue retraída medialmente mientras se expuso el área paratraqueal, sin identificación de la glándula paratiroides (Fig. 4A). La imagen CIR mostró una fuerte fluorescencia en el área polar superior, que fue confirmada como un adenoma paratiroideo superior (Figs. 4B, C).
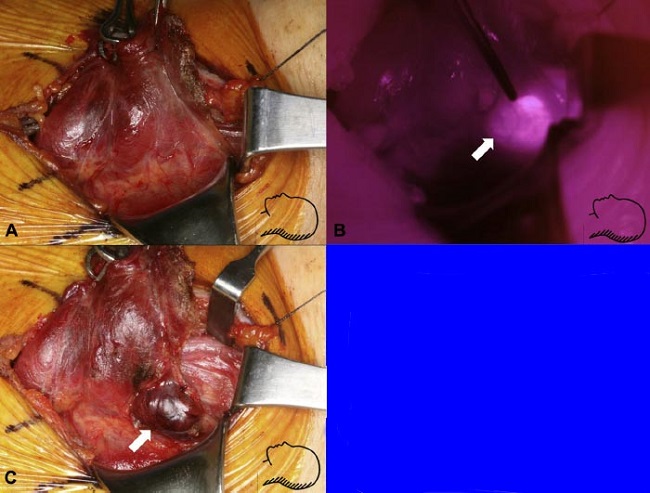
| FIGURA 4: imágenes de autofluorescencia y CIR-IR antes de la identificación de la glándula mediante visualización directa, en un paciente con un adenoma paratiroideo superior y un cáncer tiroideo papilar coexistente. (A) Después de la movilización del polo superior, se expuso el área paratraqueal superior sin observación del adenoma paratiroideo. (B) Imagen CIR-IR mostrando una fuerte fluorescencia (flecha) en el área polar superior. (C) Se localizó un adenoma paratiroideo superior izquierdo con la guía de la imagen CIR-IR (flecha). |
• Precisión del mapeo de la glándula paratiroides
Setenta glándulas paratiroides de 38 pacientes que fueron sometidos a tiroidectomía fueron incluidas en el estudio. Un paciente fue sometido simultáneamente a una paratiroidectomía debido a la coexistencia de un adenoma paratiroideo.
Sesenta y nueve de las 70 glándulas paratiroides fueron identificadas por autofluorescencia, con sólo 1 fracaso en una glándula para mostrar cualquier autofluorescencia hasta el fin de la operación. La intensidad de la fluorescencia fue medida en todas las 69 glándulas que mostraron autofluorescencia. La relación P/B fue de 4,78 (rango: 1,96 a 21,21), siendo mayor a 1 en todos los casos.
En la etapa P1, 64 de 69 glándulas paratiroides fueron claramente distinguidas como una autofluorescencia positiva antes de la exposición por disección quirúrgica de la glándula. El cirujano expuso las glándulas paratiroides en el sitio de la autofluorescencia mediante la remoción de los tejidos fibroadiposos superpuestos, y confirmó la presencia de la glándula mediante evaluación visual (sensibilidad de 92,75% en la etapa P1). Cuatro de las 5 glándulas paratiroides negativas en la etapa P1 fueron identificadas con fluorescencia CIR después de la exposición e identificación visual del la glándula por el cirujano.
Una glándula paratiroides fue identificada en un espécimen quirúrgico, habiendo sido removida inadvertidamente (sensibilidad de 98,55% en etapa P2 y de 100% en etapa P3). Una de las 70 glándulas paratiroides no pudo ser detectada visualmente por el cirujano o por el procedimiento de mapeo glandular.
El examen histológico del paciente no reveló evidencia de glándulas paratiroides en el espécimen removido quirúrgicamente (especificidad de 100% en etapa P3). Dado que el cirujano o el patólogo confirmaron todas las señalas positivas de fluorescencia como glándulas paratiroides, el valor predictivo positivo final fue de 100% para la etapa P3.
Hubo un solo caso en el que fue removida inadvertidamente la glándula paratiroides y todos los pacientes mantuvieron una función glandular paratiroidea normal, excepto 1 que requirió suplemento de calcio por una hipocalcemia temporal después de la cirugía. El tiempo de ajuste requerido para el mapeo glandular paratiroideo fue de aproximadamente 10 minutos antes de la cirugía, y el tiempo requerido para la obtención de las imágenes durante la cirugía fue de 2 a 3 minutos para cada etapa.
| Discusión |
Considerando que la remoción no intencional de la glándula paratiroides es identificada frecuentemente después de la tiroidectomía, la identificación temprana puede ser útil para reducir la hipocalcemia postoperatoria
Aunque el estudio previo de los autores [9] demostró la identificación exitosa de las glándulas paratiroides mediante imágenes fluorescentes después de su exposición, este estudio mostró la factibilidad de un sistema de imágenes para identificar las glándulas paratiroides antes de su exposición quirúrgica, cuando están oscurecidas por el tejido fibroadiposo.
Los autores se refieren a ese procedimiento como mapeo glandular paratiroideo, y observaron una sensibilidad de 92,75% en la detección de la glándula antes de la identificación por visualización directa por parte de un cirujano experimentado.
En años recientes, varios estudios de identificación y localización intraoperatoria de las glándulas paratiroides usando autofluorescencia, ya sea por imagen del campo quirúrgico [10,11] o por espectroscopía [12], han sido reportados. Muy recientemente, ha sido posible aplicar dispositivos comercialmente disponibles usando CIR para la detección intraoperatoria de las glándulas paratiroides [6-8]. No obstante, no ha habido estudios enfocados en técnicas por imágenes que puedan guiar a los cirujanos en la localización de las glándulas paratiroides antes de su exposición mediante disección quirúrgica.
Considerando que la remoción no intencional de la glándula paratiroides es identificada frecuentemente después de la tiroidectomía [13,14], la identificación temprana puede ser útil para reducir la hipocalcemia postoperatoria [15]. Aunque la disección meticulosa para preservar el pedículo vascular de la glándula paratiroides es crítica, cuanto más temprano sean identificadas las glándulas, menor será el riesgo de hipocalcemia [4].
En un reporte reciente, De Leeuw y col. [7], detectaron 5 glándulas paratiroides entre un total de 81 glándulas, como manchas autofluorescentes, antes de la identificación visual del cirujano durante la tiroidectomía. El examen de los sitios anatómicos en donde pueden localizarse las glándulas paratiroides antes de su identificación visual, puede coincidir con el concepto de los autores del presente estudio del mapeo glandular paratiroideo.
Sin embargo, esos casos fueron demostrados sólo en condiciones limitadas y los autores de ese trabajo concluyeron que su procedimiento por imágenes podría evaluar sólo glándulas paratiroides expuestas durante la cirugía. Falco y col. [4], mostraron que el uso de CIR incrementó la tasa de visualización de las glándulas paratiroides, comparado con el uso sólo de luz blanca. Dado que la CIR fue adoptada para detectar glándulas paratiroides que no fueron identificadas bajo la luz blanca por el cirujano, ese método incluye también el concepto de mapeo glandular.
No obstante, esos autores consideraron el uso de CIR como una herramienta suplementaria para identificar las glándulas paratiroides cuando la identificación visual bajo la luz blanca era insuficiente. En contraste, los autores del presente trabajo usaron el mapeo glandular paratiroideo como un método inicial para detectar las glándulas paratiroides en todos los casos, antes de la identificación por visualización directa.
> Etapa P1
Estudios previos han mostrado que es factible usar imágenes CIR para detectar glándulas paratiroides por autofluorescencia después de la identificación de la glándula por los cirujanos [5,7,11]. No obstante, los resultados del presente estudio sugieren que la autofluorescencia de las glándulas paratiroides podría ser identificada antes de la exposición por el cirujano y que sus localizaciones podrían ser predichas por la fluorescencia cuando las glándulas paratiroides están cubiertas con tejidos grasos y conectivos.
> Etapa P2
Cuando las glándulas paratiroides están localizadas más profundamente que la profundidad de penetración de CIR, o si la CIR no puede penetrar el tejido de cobertura a causa de su naturaleza, la autofluorescencia puede no ser detectada. Las 5 casos falso negativos en la etapa P1 pueden representar esas condiciones. Por lo tanto, la falta de detección durante la etapa P1 puede no necesariamente estar indicando que no hay glándulas paratiroides en el área escaneada. En este estudio, 6 de las 70 glándulas paratiroides tuvieron una etapa P1 negativa y 4 de esas 6 glándulas fueron identificadas visualmente por el cirujano durante la disección quirúrgica estándar. La autofluorescencia fue detectada en todos los 4 casos después de la identificación del cirujano.
> Etapa P3
Aunque la tasa de remoción inadvertida de las glándulas paratiroides durante a tiroidectomía puede ser tan alta como del 15% [16,17], sólo 1 (1,4%) fue extraída inadvertidamente en este estudio y fue fácilmente identificada en la etapa P3. Las glándulas paratiroides incrustadas en el espécimen quirúrgico después de la tiroidectomía con o sin disección central del cuello pueden ser difíciles de detectar.
Los autores determinaron que su sistema de mapeo puede ser útil para reducir el riesgo, tanto de una remoción inadvertida de la glándula como de la pérdida no intencional de la misma dentro del espécimen quirúrgico. El auto-trasplante de la glándula removida podría ser realizado inmediatamente, sin tiempo adicional y los costos requeridos para obtener biopsias por congelación. Se ha demostrado que el auto-trasplante paratiroideo reduce el riesgo de hipoparatiroidismo permanente después de la tiroidectomía [18].
Comparado con estudios recientes de localización intraoperatoria de glándulas paratiroides usando sistemas diagnósticos comerciales producidos para otros propósitos [4,6-8], los dispositivos en este estudio fueron experimentales y aún no han sido comercializados. A este respecto, una dirección futura importante podría ser desarrollar un dispositivo todo-en-uno comercializable que incluya imágenes CIR con un iluminador IR y una cámara IR.
Una desventaja de esta técnica de mapeo glandular paratiroideo es que debe eliminarse la luz del ambiente; sin embargo, se espera superar esa desventaja en un futuro cercano a través de avances técnicos. Dado que todos los instrumentos para el procedimiento fueron ajustados antes de la cirugía y que el tiempo para la obtención de imágenes fue de sólo 2 a 3 minutos, el tiempo total de la operación no fue afectado significativamente. El número total de glándulas paratiroides expuestas por la cirugía no coincidió con el número total de imágenes tomadas, porque las glándulas paratiroides que fueron expuestas naturalmente durante la disección de la glándula tiroides fueron excluidas de la muestra.
La identificación intraoperatoria de las glándulas paratiroides puede no necesariamente facilitar la prevención del hipoparatiroidismo postoperatorio. Sin embargo, sólo 1 entre 17 pacientes (5,9%) que fue sometido a una tiroidectomía total, mostró una hipofunción temporal en este estudio. En general, la preservación de los vasos alimenticios y el mantenimiento del flujo sanguíneo o perfusión son críticos para prevenir la hipofunción postoperatoria [19-21].
No obstante, la viabilidad o el flujo sanguíneo de las glándulas paratiroides preservadas podrían no ser evaluados con el sistema de mapeo de los autores. En consecuencia, se requieren técnicas para identificar la vasculatura de las glándulas paratiroides con perfusión sanguínea sin colorante de contraste. Esa técnica podría permitir al cirujano decidir cuál de las glándulas paratiroides preservadas requiere auto-trasplante.
| Conclusiones |
Este estudio presentó la factibilidad y seguridad de un nuevo sistema de mapeo glandular paratiroideo para la identificación fácil de las glándulas paratiroides durante la tiroidectomía. Este es el primer estudio en reportar un abordaje sistemático para detectar las glándulas paratiroides con imágenes CIR a través de un procedimiento por etapas. Futuras investigaciones en las aplicaciones clínicas pueden conducir al desarrollo de dispositivos avanzados para imágenes CIR con iluminación IR, para ayudar a los cirujanos a preservar las glándulas paratiroides.
Comentario y resumen objetivo: Dr. Rodolfo D. Altrudi