| Introducción |
La enfermedad celíaca (EC) se define como una respuesta inmunomediada permanente al gluten presente en el trigo, la cebada y el centeno. Tiene un amplio espectro de manifestaciones clínicas que se asemejan a un trastorno multisistémico en lugar de una enfermedad intestinal aislada, y se caracteriza por una lesión del intestino delgado y la presencia de anticuerpos específicos. La detección de anticuerpos específicos (por ej., anti transglutaminasa) en el suero es muy útil para la detección inicial de pacientes con sospecha de EC. Se requiere una biopsia intestinal en la mayoría de los pacientes para confirmar el diagnóstico. El tratamiento actual para la EC requiere una estricta adherencia a una dieta sin gluten (DLG) y un seguimiento médico de por vida.
> Epidemiología
La EC es común, con una prevalencia de alrededor del 1% en la mayoría de las poblaciones. La incidencia del diagnóstico de EC ha aumentado en las últimas décadas, y este aumento se ha atribuido tanto a un mayor testeo como a un aumento de la autoinmunidad; esto último ha sido demostrado por estudios de seroprevalencia de individuos asintomáticos.
La carga de la enfermedad se ha estimado como considerable según análisis económicos que miden el costo asociado con la atención ambulatoria entre pacientes diagnosticados con EC. Además, el aumento del costo de los alimentos sin gluten en comparación con sus contrapartes que contienen gluten es un componente importante de la carga de la enfermedad.
> Métodos de elaboración de directrices
Los expertos en contenido determinaron las preguntas clínicas clave utilizando el formato PICO, identificaron la literatura relacionada y aportaron su experiencia en contenido para la interpretación de la evidencia, y elaboraron el manuscrito con conceptos y recomendaciones clave. Dos metodólogos evaluaron el nivel de evidencia utilizando el sistema GRADE y facilitaron y guiaron la discusión en torno a la evidencia y la fuerza de la recomendación.
| Diagnóstico |
1. ¿Se debe utilizar una combinación de pruebas serológicas versus biopsia duodenal para confirmar el diagnóstico de EC en niños y adultos?
| Recomendaciones |
|
1A. Recomendamos la VEDA con múltiples biopsias duodenales para confirmar el diagnóstico tanto en niños como en adultos con sospecha de EC (recomendación fuerte, calidad moderada de la evidencia). 1B. Sugerimos una combinación de anticuerpos anti TTG IgA de alto nivel (>10 × límite superior de lo normal) con un anticuerpo anti endomisio (EMA) positivo en una segunda muestra de sangre como pruebas confiables para el diagnóstico de EC en niños. En adultos sintomáticos que no desean o no pueden someterse a una endoscopia, se pueden considerar los mismos criterios, como un diagnóstico de EC probable (recomendación condicional, calidad moderada de la evidencia). |
|
Conceptos clave 1. Para el diagnóstico de EC son necesarias múltiples biopsias del duodeno (1 o 2 del bulbo y 4 del duodeno distal). 2. La VEDA y las biopsias duodenales también pueden ser útiles para el diagnóstico diferencial de otros trastornos malabsortivos o enteropatías. 3. La duodenitis linfocítica (≥25 linfocitos intraepiteliales por 100 enterocitos) en ausencia de atrofia vellosa no es específica de EC y deben considerarse otras causas. |
Evidencia y fundamento
La disponibilidad de pruebas serológicas específicas facilitó el reconocimiento de pacientes con EC y el amplio espectro de manifestaciones clínicas, pero ninguna prueba es 100% específica y la precisión diagnóstica varía considerablemente entre laboratorios. El diagnóstico de EC se confirma definitivamente mediante la demostración de cambios histológicos asociados con la enfermedad según la clasificación de Marsh o, más recientemente, la clasificación simplificada de Corazza. La biopsia del intestino delgado también es útil para el diagnóstico diferencial de otras enteropatías o trastornos malabsortivos.
Se debe considerar la realización de pruebas en pacientes con signos o síntomas sugestivos de EC, como diarrea, pérdida de peso, dolor abdominal y distensión abdominal, o alteraciones de laboratorio como niveles elevados inexplicables de aminotransferasa sérica. Las pruebas para EC consisten en medir anticuerpos anti TTG IgA en suero, mientras se sigue una dieta regular (que contenga gluten) y, si el paciente no se ha sometido previamente a pruebas de deficiencia de IgA, la medición simultánea de IgA total. Los pacientes con un nivel elevado de anticuerpos anti TTG IgA deberán realizar VEDA con biopsia duodenal.
Un nivel de anticuerpos anti TTG IgA negativo en pacientes sin deficiencia de IgA tiene un alto valor predictivo negativo si la probabilidad pretest es baja o moderada, y la EC puede considerarse descartada en este escenario. En pacientes con alta probabilidad pretest, se debe considerar VEDA con biopsia duodenal incluso con una serología negativa. Si hay deficiencia de IgA, entonces se debe medir IgG (comúnmente péptidos deaminados de gliadina [DGP] y/o TTG).
A pesar de la alta especificidad de los EMA, dada la disponibilidad limitada y la dependencia del operador de este ensayo, solo se utilizará como prueba confirmatoria en niños para un algoritmo de diagnóstico sin biopsia.Este algoritmo (Figura 1), que antes se aplicaba a adultos y niños ≥2 años, ahora se puede aplicar a adultos y niños de cualquier edad, siempre que la persona que se someta a la prueba mantenga una dieta regular (que contenga gluten). En la figura también se destacan consideraciones especiales para las personas que siguen una dieta sin gluten.
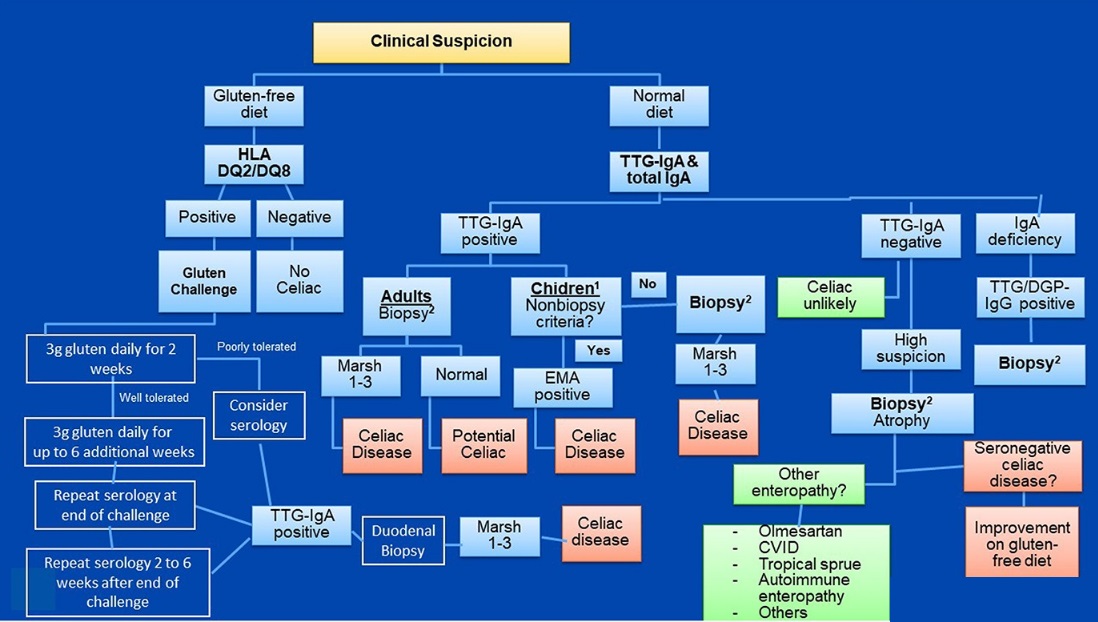
Figura 1. Algoritmo de pruebas diagnósticas de EC.
Las pruebas genéticas para el haplotipo del antígeno leucocitario humano (HLA) compatible con EC no son necesarias para el diagnóstico en todos los casos, pero pueden ser útiles en situaciones seleccionadas, como en el contexto de discrepancia serológica-histología. Las pruebas de HLA también son fundamentales para el enfoque de las pruebas de EC para personas que ya han comenzado una dieta sin gluten antes de la evaluación. Recomendamos múltiples biopsias del duodeno, incluidas 1 o 2 muestras del bulbo (en la posición de las 9 o las 12 en punto) y al menos 4 biopsias del duodeno posbulbar.
La infiltración linfocítica (≥25 linfocitos intraepiteliales por 100 enterocitos), también conocida como duodenitis linfocítica, es común en la población general (prevalencia del 5,4 %) y puede estar aumentando. La anemia, los trastornos de la piel, la TTG positiva y el HLA DQ2 fueron más frecuentes entre los pacientes con EC. Otros trastornos se han asociado con la duodenitis linfocítica, incluida la infección por Helicobacter pylori, fármacos (por ej. AINE), el sobrecrecimiento bacteriano del intestino delgado, la sensibilidad al gluten no celíaca y trastornos autoinmunes sistémicos.
Se puede considerar una DLG en niños y adultos sintomáticos con duodenitis linfocítica o lesiones Marsh II (duodenitis linfocítica e hiperplasia de criptas sin atrofia) que tienen anticuerpos elevados relacionados con EC, especialmente EMA. Una directriz avalada por la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN) propuso que podría ser posible evitar cualquier biopsia intestinal en niños que cumplan con los siguientes criterios: síntomas característicos de EC y niveles de IgA anti TTG >10× (confirmado con un anticuerpo EMA positivo en una muestra de sangre diferente). Este enfoque sin biopsia en niños sintomáticos se ha adoptado en Europa desde 2012 y las directrices actualizadas de la ESPGHAN en 2020 propusieron que (i) la prueba de HLA ya no es necesaria y (ii) se recomienda condicionalmente un enfoque sin biopsia para niños asintomáticos.
En adultos, los médicos pueden encontrar escenarios clínicos donde un diagnóstico de biopsia puede no ser práctico, como un paciente para quien una endoscopia y/o biopsia plantea un riesgo cardiovascular o de sangrado.
| Dieta y resultados a largo plazo |
2. ¿Debería utilizarse la recuperación de la mucosa intestinal versus la remisión clínica y serológica como objetivo de la terapia con dieta sin gluten para mejorar los resultados a largo plazo (5 años o más), como la mortalidad, el riesgo de cáncer y la osteoporosis en adultos con EC?
| Recomendación |
| 2. Sugerimos establecer como objetivo la recuperación de la mucosa intestinal como punto final de la terapia con dieta sin gluten. Abogamos por una discusión individualizada de los objetivos de la dieta sin gluten con el paciente más allá de la remisión clínica y serológica (recomendación condicional, baja calidad de la evidencia). |
|
Conceptos clave 1. La VEDA con biopsia intestinal es útil para el seguimiento en casos con falta de respuesta clínica o recaída de los síntomas a pesar de una dieta sin gluten. 2. Se podría considerar una biopsia de seguimiento para evaluar la recuperación de la mucosa en adultos en ausencia de síntomas después de 2 años de haber iniciado una dieta sin gluten después de una toma de decisiones compartida. |
Evidencia y fundamento
Las biopsias intestinales son la única forma de documentar la recuperación de la mucosa intestinal. La curación de la mucosa en la EC después de comenzar una DLG lleva tiempo y es incompleta o ausente en un número sustancial de pacientes diagnosticados durante la adultez. Esta falta de curación de la mucosa puede estar asociada con un mayor riesgo de malignidad linfoproliferativa, y en última instancia un diagnóstico de EC refractaria en pacientes sintomáticos con buena adherencia a la DLG.
La recuperación de la mucosa se observó en el 95% de los niños dentro de los 2 años de comenzar una DLG. La consideración de realizar una biopsia de seguimiento puede ser diferente en los niños porque tienen tasas más altas de curación de la mucosa en una DLG. Actualmente, no se recomienda la biopsia de seguimiento en niños asintomáticos después de una DLG.
| Uso de dispositivos |
3. ¿Deberían utilizarse dispositivos de detección de gluten frente al estándar de atención actual para monitorear la adherencia a la dieta sin gluten y/o la toma de decisiones dietéticas de los pacientes?
| Recomendación |
| 3. Sugerimos no utilizar rutinariamente dispositivos de detección de gluten en alimentos para pacientes con EC (recomendación condicional, baja calidad de evidencia). |
|
Conceptos clave 1. El estándar de atención para evaluar la adherencia a la dieta implica una entrevista con un nutricionista con experiencia en dieta sin gluten. 2. Es posible que las tecnologías para detectar cualitativamente el gluten en alimentos no distingan entre una exposición al gluten clínicamente significativa y una trivial. 3. Hay poca evidencia que sugiera que el uso de tecnología de detección de gluten mejora la adherencia a la dieta o la calidad de vida. 4. Se necesitan estudios para evaluar la utilidad de las tecnologías de detección de gluten para mejorar la adherencia a la dieta sin gluten y los resultados clínicos en la EC. |
Evidencia y fundamento
El sensor Nima es un dispositivo portátil de sensor de gluten que devuelve un resultado de "gluten encontrado" o "sin gluten" para una muestra pequeña de alimento después de 3 minutos. Los resultados falsos positivos como los falsos negativos son una limitación significativa. A medida que se disponga de otros dispositivos de análisis de alimentos para las personas con EC, es imperativo que se pruebe rigurosamente su validez y se estudie su impacto en los resultados del paciente.
La EC refractaria consiste en síntomas y/o signos continuos de malabsorción con atrofia de las vellosidades intestinales a pesar de la evidencia de una estricta adherencia a una DLG durante al menos 12 meses. Esto es relativamente raro y comprende <1% de los pacientes con EC. La EC refractaria tipo 1, puede manejarse con una mayor restricción dietética. Los medicamentos que se han utilizado para tratar la EC refractaria incluyen budesonida, prednisona, mesalazina, entre otros, aunque faltan datos controlados con placebo. La EC refractaria tipo 2, tiene un pronóstico peor y a menudo es un precursor del linfoma de células T asociado a enteropatía.
| Probióticos |
4. En pacientes con EC, ¿cuál es el efecto de los probióticos además de la dieta sin gluten sobre las tasas de remisión clínica y curación de la mucosa en comparación con la dieta sin gluten sola?
| Recomendación |
| 4. No hay evidencia suficiente para recomendar a favor o en contra del uso de probióticos para el tratamiento de la EC (calidad de evidencia muy baja). |
|
Conceptos clave 1. La disbiosis es una característica de la EC, pero su papel en la patogénesis y la sintomatología de la enfermedad es incierto. 2. A pesar del uso generalizado de probióticos, no se ha establecido un beneficio en el manejo de la EC. |
Evidencia y fundamento
La justificación para el uso de probióticos se deriva de los hallazgos de que existe un estado de disbiosis en el microbioma duodenal de individuos con EC antes y después del desarrollo de la enfermedad. La administración de probióticos podría restaurar la supuesta disbiosis documentada en la EC.
Un estudio piloto de 40 niños con EC a los que se les administró un probiótico que contenía una combinación de cepas de Bifidobacterium durante 3 meses dio como resultado una proporción de Firmicutes/Bacteroidetes en heces que parecía más similar a los controles después de la intervención.
En un ensayo piloto aleatorizado, doble ciego, controlado con placebo de 22 adultos con anticuerpos elevados de EC que todavía recibían una dieta con gluten, en comparación con los asignados aleatoriamente a placebo, los asignados aleatoriamente al probiótico Bifidobacterium natren tuvieron una mayor mejoría en los síntomas gastrointestinales y niveles más bajos de anticuerpos IgA anti TTG y DGP. A pesar de estos prometedores estudios piloto, siguen existiendo múltiples incertidumbres sobre el papel de los probióticos en el tratamiento de la EC.
| Nutrición |
5. En pacientes con EC recién diagnosticada, ¿cuál es el efecto de la dieta con avena sin gluten sobre las tasas de remisión clínica y recuperación de la mucosa en comparación con una dieta con avena con gluten?
| Recomendación |
| 5. Recomendamos el consumo de avena sin gluten en la dieta de las personas con EC. La contaminación de la avena con gluten, la toxicidad variable en diferentes variedades de avena y el pequeño riesgo de una reacción inmunitaria a la proteína de la avena, avenina, requieren un seguimiento de la tolerancia a la avena (recomendación fuerte, calidad moderada de la evidencia). |
|
Conceptos clave 1. El consumo de avena parece ser seguro para la mayoría de las personas con EC, pero puede ser inmunogénico en un subconjunto de pacientes. 2 La heterogeneidad en la tolerancia de la avena puede estar relacionada con diferencias en el origen/cosecha y la cantidad de avena consumida. 3. No se conocen los intervalos de seguimiento de los síntomas y la serología tras la introducción de avena sin gluten en la dieta. |
Evidencia y fundamento
Recientemente, dos estudios han respaldado la seguridad de la avena pura/no contaminada en personas con EC después de la DLG. Un gran estudio transversal de pacientes con EC de Finlandia informó que el consumo a largo plazo de avena resultó ser seguro y mejoró la calidad de vida. Aquellos que consumieron avena tuvieron mejores puntajes de salud.
Un ensayo doble ciego, aleatorizado, cruzado y controlado con placebo sobre la seguridad de la avena en niños con EC informó que los productos de avena pura son seguros en la dieta de los niños con EC.
| Vacuna antineumocócica |
En pacientes con EC, ¿el uso de la vacuna neumocócica reduce el riesgo futuro de infección neumocócica grave en comparación con ninguna vacuna neumocócica?
| Recomendación |
| 6.Sugerimos la vacunación para prevenir la infección neumocócica en pacientes con EC (recomendación condicional, baja calidad de evidencia). |
|
Conceptos clave 1. La vacunación contra la infección neumocócica es segura y eficaz. 2. La vacunación se recomienda ampliamente para todos los adultos mayores de 65 años y para los fumadores de entre 19 y 64 años o adultos con determinadas afecciones subyacentes. |
Evidencia y fundamento
Los adultos con EC tienen un riesgo significativamente mayor de infecciones neumocócicas (sepsis, neumonía). En un estudio poblacional que utilizó un registro de salud en Italia, los niños con EC tenían un mayor riesgo de neumonía bacteriana en comparación con los individuos de control, pero las infecciones neumocócicas no aumentaron significativamente. Se cree que el mayor riesgo de infección neumocócica se debe al hipoesplenismo (frecuentemente subclínico) encontrado en aproximadamente un tercio de aquellos con EC según el recuento de glóbulos rojos. En una revisión sistemática y metanálisis recientes, la EC se asoció con un riesgo general 2 veces mayor de infección neumocócica en comparación con los pacientes y la población general.
| Tamizaje |
7. ¿Debería utilizarse la búsqueda de casos en lugar del cribado masivo para mejorar la detección de la EC en la población general?
| Recomendación |
|
7A. Recomendamos la búsqueda de casos para aumentar la detección de EC en la práctica clínica (recomendación fuerte, evidencia de baja calidad). 7B. No recomendamos la detección masiva de EC en la comunidad (recomendación firme, evidencia de baja calidad). |
|
Conceptos clave 1. Los pacientes con síntomas, signos o hallazgos de laboratorio que sugieran malabsorción, como diarrea crónica con pérdida de peso, esteatorrea, dolor abdominal y distensión abdominal, deben someterse a testeo de EC. 2. Los pacientes con síntomas, signos o hallazgos de laboratorio para los cuales la EC es una causa tratable deben ser considerados para realizar testeo de EC. 3. Los pacientes con un familiar de primer grado que tenga un diagnóstico confirmado de EC deben ser estudiados para detectar posibles signos o síntomas o evidencia de laboratorio de EC. 4. Considere realizar testeo a familiares asintomáticos con un familiar de primer grado que tenga un diagnóstico confirmado de EC. |
Evidencia y fundamento
A diferencia del cribado masivo, la detección de casos entre grupos de alta prevalencia puede resultar eficaz en la práctica clínica y tal vez conducir a una relación costo-beneficio positiva. Sin embargo, la evidencia reciente sugiere que la detección de casos es insuficiente para detectar a la mayoría de las personas con EC no diagnosticada a nivel de población. No hay consenso sobre qué síntomas, anomalías de laboratorio y/o enfermedades asociadas requieren evaluación para EC. La frecuencia de EC en escenarios clínicos comunes varía desde moderadamente elevada, como el síndrome del intestino irritable, hasta sustancialmente elevada, como la anemia por deficiencia de hierro inexplicable.
Los pacientes con un familiar de primer grado que tenga un diagnóstico confirmado de EC deben someterse a pruebas de EC. La frecuencia de EC aumenta sustancialmente en pacientes que tienen un familiar de primer grado afectado con EC. En pacientes con enzimas hepáticas séricas elevadas, la EC debe considerarse entre las explicaciones de esta condición, siendo en estos casos un hallazgo subclínico que depende del gluten. Hay datos razonables que muestran esta elevación se normaliza en la mayoría de los pacientes con una DLG.
Los pacientes con diabetes mellitus tipo I deben someterse a pruebas de EC si hay cualquier síntoma o signo sugerente. Hay evidencia de que la EC es sustancialmente más común en pacientes con diabetes tipo I que en la población blanca general.
| Pruebas en niños |
8. ¿Son los anticuerpos anti TTG y DGP combinados más precisos para diagnosticar EC en niños menores de 2 años en comparación con anti TTG sola?
| Recomendación |
|
8A. Recomendamos el anticuerpo IgA anti-TTG como la prueba única preferida para la detección de EC en niños menores de 2 años que no presentan deficiencia de IgA (recomendación fuerte, calidad moderada de evidencia). 8B. Recomendamos que las pruebas de EC en niños con deficiencia de IgA se realicen utilizando anticuerpos basados en IgG (anti DGP-IgG o anti TTG-IgG) (recomendación fuerte; calidad moderada de evidencia). |
|
Conceptos clave 1. Se informa que anti TTG-IgA y EMA-IgA son menos precisas en niños menores de 2 años. 2. Las pautas actuales recomiendan que las pruebas de detección de EC en niños menores de 2 años incluyan tanto anti TTG-IgA como anti DGP-IgG. |
Evidencia y fundamento
Las pautas anteriores sobre el diagnóstico y el tratamiento de la EC recomiendan que se utilice una combinación de pruebas anti TTG y DGP para detectar la EC en niños menores de 2 años.
Estudios recientes han cuestionado la validez de la recomendación de utilizar pruebas combinadas en niños menores de 2 años. En 7 estudios que incluyeron un número combinado de 639 niños menores de 2 años con EC confirmada por biopsia, los anticuerpos anti TTG-IgA funcionaron tan bien o mejor que los anti DGP-IgG en la identificación de niños con la enfermedad.
Con base en estos informes, ya no está justificado combinar los anticuerpos anti TTG-IgA con anti DGP-IgG cuando se realizan pruebas de EC en niños menores de 2 años que no presentan déficit de IgA.