CRISTINA DE MARTOS
 Durante los ensayos clínicos previos a la comercialización de oseltamivir, más conocido como Tamiflu, los expertos detectaron algunos casos en los que el virus de la gripe era resistente al fármaco. Estos microorganismos que burlaban el efecto del antiviral tenían, por el contrario, una capacidad de replicación muy limitada. Esto, junto con su escasa presencia, evitó que saltaran entonces las alarmas.
Durante los ensayos clínicos previos a la comercialización de oseltamivir, más conocido como Tamiflu, los expertos detectaron algunos casos en los que el virus de la gripe era resistente al fármaco. Estos microorganismos que burlaban el efecto del antiviral tenían, por el contrario, una capacidad de replicación muy limitada. Esto, junto con su escasa presencia, evitó que saltaran entonces las alarmas.
Pero durante la temporada de gripe 2007-2008 empezaron a llegar informes del Hemisferio Norte de cepas H1N1 resistentes al oseltamivir, incluso en personas que no habían recibido este tratamiento. Un año después, los virus H1N1 estacionales insensibles a este antiviral eran dominantes a escala global, descartando el uso de este fármaco de primera línea.
De pronto, estas cepas resistentes, que antes apenas eran capaces de replicarse y extenderse, se habían vuelto igual de eficientes que el resto de virus estacionales. ¿Qué había sucedido? Las claves de este salto evolutivo aparecen en el último número de la revista 'Science', desgranadas por David Baltimore, profesor de Biología del Instituto de Tecnología de California (Caltech) y ganador del Nobel de Fisiología en 1975, junto con Jesse Bloom, alumno de postdoctorado en dicho centro.
Una mutación de doble filo
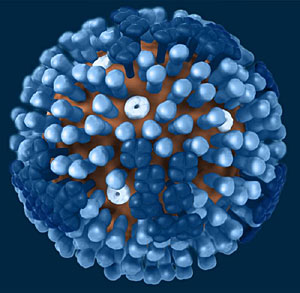
Los virus de la gripe penetran en las células uniéndose mediante la hemaglutinina a una molécula de ácido siálico. Después de replicarse en su interior, los nuevos virus deben salir para infectar otras células. Para ello, utilizan de nuevo el ácido siálico y para liberarse de él lo cortan gracias a la neuraminidasa.
El Tamiflu interfiere, precisamente, en este último proceso. Se une al sitio activo de la neuraminidasa (N), justo en la 'tijera', impidiendo que se corte el ácido siálico. Así, los virus no pueden salir de la célula. Cualquier alteración en la morfología de esa herramienta de corte podría impedir la unión entre el oseltamivir y N, dejando así sin efecto al antiviral. Eso es lo que ocurre con la mutación H274Y.
Pero, tal y como sucedía con las primeras cepas que portaban H274Y, este cambio que confiere a los virus resistencia frente al Tamiflu supone ciertas desventajas para estos microorganismos al dificultar su reproducción. Sin embargo, de algún modo, los virus superaron este escollo y recuperaron su eficiencia.
"Nos pareció un misterio evolutivo muy interesante", ha explicado Bloom. "Algo sucedió para que los virus resistentes al Tamiflu se volvieran además capaces de replicarse y expandirse como los demás virus". La solución es "tener una segunda mutación que solvente este problema de los mutantes H274Y", indica el autor.
Una ventaja exclusiva de los virus estacionales
Así lo confirmaron sus investigaciones, que hallaron no una sino dos alteraciones en el gen de la neuraminidasa que devolvían la capacidad de replicación a estos virus. Estas mutaciones permisivas, según demuestran los autores, aparecieron antes de H274Y. Este sorprendente hecho "demuestra que las mutaciones secundarias pueden preceder a los cambios principales", señala un editorial que acompaña al estudio.
En él, Edward Holmes, del Centro de Dinámica de la Enfermedad Infecciosa de la Universidad Estatal de Pensilvania (EEUU) subraya que, a la luz de estos resultados, "existen linajes virales con una mayor capacidad innata para desarrollar rasgos fenotípicos importantes", como la resistencia a los fármacos.
Por suerte, las mutaciones halladas por Baltirmore y Bloom apenas se han visto en otros virus más peligrosos que el de las infecciones estacionales, como el de la gripe A o el de la gripe aviar. La aparición de las dos alteraciones permisivas en ejemplares de estas cepas "anuncia la aparición de la resistencia al oseltamivir", concluye Holmes.