Introducción
La FDA proporciona nuevas recomendaciones con respecto a la selección de pacientes y el uso del dispositivo para la colocación de stent neurovascular en aneurismas cerebrales no rotos.
Estas recomendaciones siguen a los informes de accidente cerebrovascular y mortalidad perioperatorios que pueden estar relacionados con riesgos de procedimientos o selección inapropiada de pacientes.
Algunos de los pacientes tenían comorbilidades importantes relacionadas con una menor esperanza de vida o no podían tolerar los anticoagulantes o los antiplaquetarios requeridos para la espiral asistida por stent.
La FDA dice que para los pacientes con aneurismas más pequeños o con una expectativa de vida más baja, los riesgos del tratamiento pueden ser mayores que sus beneficios potenciales. Los pacientes deben ser informados de estos riesgos.
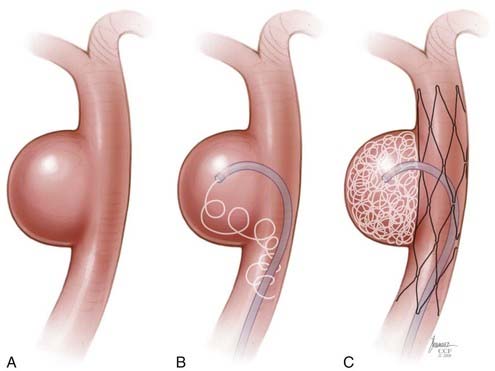
Los dispositivos están diseñados para tratar aneurismas saculares de cuello ancho, intracraneales. Diferentes fabricantes tienen diferentes especificaciones para los diámetros del vaso progenitor. "La FDA no ha evaluado la seguridad y el beneficio probable fuera de esos parámetros", advierte la agencia.
Reporte de la FDA
La FDA recibió informes asociados con el uso de estos dispositivos en el tratamiento de aneurismas cerebrales no rotos que sugieren que algunos eventos de accidente cerebrovascular y / o muerte peri-procesal pueden haber estado relacionados con riesgos de procedimientos o factores relacionados con la selección de pacientes.
Estos factores incluyen pacientes que tenían comorbilidades graves que daban como resultado una expectativa de vida reducida, o que no toleraron la anticoagulación requerida o la terapia antiplaquetaria.
ANTECEDENTES:
Los stents neurovasculares utilizados para SAC están destinados a tratar aneurismas saculares de cuello ancho, intracraneales, que surgen de diversos tamaños de diámetros de vasos progenitores dependiendo del uso previsto por los fabricantes (por ejemplo,> 2 milímetros y <4,5 milímetros).
El cuello ancho se define como tener un ancho de cuello> 4 milímetros o una relación de domo a cuello <2. Estos dispositivos están disponibles de múltiples fabricantes y han sido aprobados por la FDA a través de la ruta regulatoria de Exención de Dispositivo Humanitario (HDE), después de demostrar seguridad y beneficio probable para su uso previsto.
RECOMENDACIÓN:
Consulte Seguridad de dispositivos médicos: cartas a proveedores de servicios de salud para obtener una lista completa de recomendaciones. Cuando se utilizan stents neurovasculares para SAC, la FDA recomienda que los proveedores de atención médica:
|