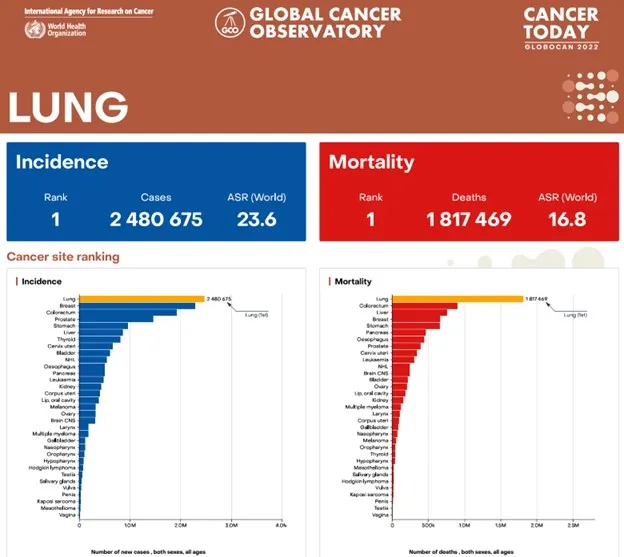
El cáncer de pulmón es la principal causa de muerte por cáncer en el mundo, con más de 2 millones de nuevos casos anuales y una tasa de mortalidad que supera el 80 % en estadios avanzados. Aproximadamente, el 85 % de los casos corresponden al cáncer de pulmón no microcítico (CPNM), el cual incluye adenocarcinomas, carcinomas escamosos y carcinomas de células grandes.
Factores de riesgo, como el tabaquismo, la exposición a carcinógenos ambientales y ocupacionales y predisposiciones genéticas, juegan un papel central en su desarrollo. A pesar de los avances en el diagnóstico temprano y las terapias personalizadas, la mayoría de los pacientes son diagnosticados en etapas avanzadas, lo que enfatiza la necesidad de estrategias de tratamiento más efectivas.
En el CPNM, las alteraciones moleculares son determinantes clave, tanto para la clasificación biológica como para la selección terapéutica. Entre estas alteraciones destacan mutaciones en EGFR, translocaciones en ALK, mutaciones en BRAF y MET, así como fusiones en RET y ROS1, cada una asociada con un subgrupo específico de pacientes. Estas alteraciones genómicas han permitido el desarrollo de terapias dirigidas que mejoran significativamente los resultados clínicos, en comparación con tratamientos convencionales. Además, estas características moleculares han ampliado el espectro de opciones terapéuticas, como los inhibidores de tirosina quinasa (TKI), que ofrecen beneficios en supervivencia y calidad de vida, especialmente en pacientes con características moleculares específicas.
El tratamiento dirigido para pacientes con cáncer de pulmón no microcítico (CPNM) positivo para ALK ha evolucionado significativamente en la última década, con la introducción de múltiples inhibidores de ALK (anaplastic lymphoma kinase). Crizotinib, el primer inhibidor de ALK aprobado, demostró eficacia inicial, pero con limitaciones en el control intracraneal y en la duración de la respuesta, debido a la aparición de resistencias.
Posteriormente, se desarrollaron inhibidores de segunda generación, como alectinib, ceritinib y brigatinib, que ofrecen una mayor potencia y actividad intracraneal. Más recientemente, lorlatinib, un inhibidor de tercera generación, ha sido diseñado específicamente para superar resistencias a los fármacos previos y ofrecer una alta penetración en el sistema nervioso central, ampliando las opciones terapéuticas para los pacientes con enfermedad avanzada y progresión intracraneal.
El estudio CROWN, un ensayo clínico de fase III, comparó la eficacia del lorlatinib frente al crizotinib, en pacientes con cáncer de pulmón no microcítico avanzado positivo para ALK. Los resultados a 5 años destacan que el lorlatinib no alcanzó la mediana de supervivencia libre de progresión (SLP), mientras que con crizotinib fue de solo 9,1 meses. Además, el 60 % de los pacientes tratados con el lorlatinib permanecieron sin progresión a 5 años, en comparación con solo el 8 % que recibió crizotinib. Esto representa el mayor beneficio en SLP reportado con un tratamiento dirigido de agente único en tumores sólidos metastásicos, estableciendo un nuevo estándar para las terapias dirigidas.
El lorlatinib mostró una actividad intracraneal destacada, con una mediana de tiempo hasta la progresión intracraneal que no se alcanzó, frente a los 16,4 meses con el crizotinib. Entre los pacientes con metástasis cerebrales al inicio, el 49 % logró una respuesta completa intracraneal con el lorlatinib, en comparación con solo el 5 % con el crizotinib. Además, no se detectaron nuevas mutaciones de resistencia ALK en el ADN tumoral circulante al final del tratamiento con el lorlatinib, lo que subraya su capacidad para prevenir mecanismos de resistencia.
En términos de seguridad, el lorlatinib presentó eventos adversos manejables, aunque con mayor incidencia de hipercolesterolemia e hipertrigliceridemia, en comparación con el crizotinib. La mayoría de los efectos secundarios fueron de grado leve a moderado y se controlaron con ajustes de dosis. Estos resultados confirman al lorlatinib como una opción de primera línea altamente efectiva y segura para pacientes con cáncer de pulmón avanzado positivo para ALK, con beneficios significativos tanto en control sistémico como en la protección contra las metástasis cerebrales.
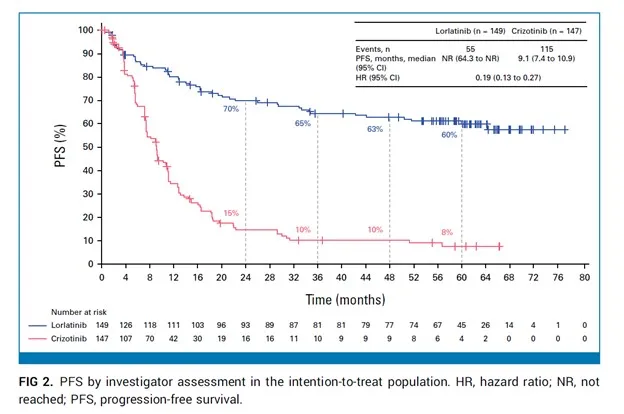
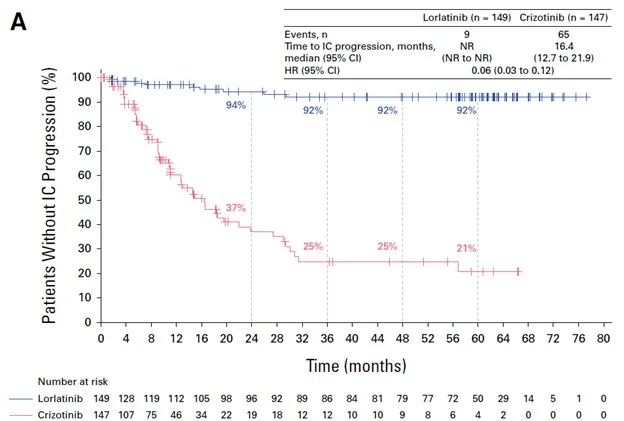
Tiempo hasta la progresión intracraneal según la evaluación del investigador utilizando RECIST modificado, versión 1.1, en la población por intención de tratar.