El envejecimiento es uno de los factores de riesgo más importantes de la degeneración macular asociada con la edad (DMAE). Las drusas blandas y depósitos lineales basales son lesiones extracelulares ricas en lípidos específicas de la DMAE. Lípidos visualizados mediante rojo-O al aceite constituyen los principales depósitos en la membrana de Bruch y primer componente identificable en las drusas. Décadas después de este descubrimiento trascendental, se articuló una historia natural de los depósitos de lípidos neutros y se propuso un modelo bioquímico. Los resultados obtenidos mediante diversos métodos bioquímicos, histoquímicos y ultraestructurales, confirmados indirectamente por la epidemiología, indican que el epitelio pigmentario retiniano secreta apolipoproteína B (apoB), una lipoproteina con partículas de composición poco común, en la membrana de Bruch, donde se van acumulando con la edad hasta finalmente forma una pared lípida., esto antecede a los depósitos lineares basales. Los autores del presente estudio consideran que los componentes de estas lesiones interactúan con especies de oxigeno reactivo para formar lípidos peroxidados proinflamatorios que dan lugar a la neovascularización. En el presente estudio, los autores resumieron las principales evidencias de acumulación de lipoproteinas en la membrana de Bruch que conduce a la formación de lesiones y la producción de lipoproteina por parte del epitelio pigmentario retiniano. Se actualizó el modelo realizando asociaciones genéticas entre la DMAE y genes históricamente asociados con el metabolismo de HDL en plasma.
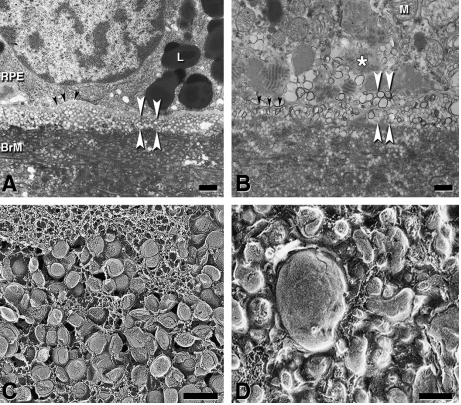
Fig. 1 La pared lípida y los depósitos lineales basales. La pared lípida es precursora de los depósitos lineales basales, lesión específica de la DMAE. A,B) Micrografía que muestra lipoproteina como vesículas. C,D) lipoproteínas modificadas como partículas sólidas. En A), las lipoproteinas (vesículas esféricas de diámetro uniforme) se acumulan entre la membrana basal del epitelio pigmentario retiniano (flechas negras) y la capa interna de colágeno de la membrana de Bruch (pared lípida, flechas blancas). L, lipofuscina. En B) los depósitos lineales basales (flechas blancas) aparecen como vesículas unidas a la membrana en el mismo plano de la pared lípida en A). La alta densidad de electrones en los bordes vesiculares está asociada con aumento del contenido de colesterol no esterificado. Flechas negras: membrana basal del epitelio pigmentario retiniano. M: mitocondria. En C), lipoproteínas muy juntas en la pared lípida de la membrana de Bruch muestran el clásico núcleo y superficie de las lipoproteinas. En D), en los depósitos lineales basales de un donante de 78 años con atrofia geográfica, las lipoproteínas tienen tamaño y forma más heterogénea.
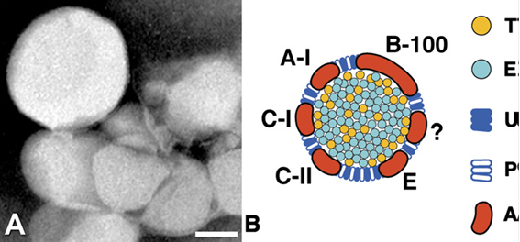
Fig. 2 Lipoproteina de la membrana de Bruch A) partículas de lipoproteina aisladas en la membrana de Bruch. Las partículas son grandes, esféricas y electrón-lúcidas. B) Datos de la composición de la lipotproteina de la membrana de Bruch por ensayo directo y por deducción de la composición de las drusas y expresión genética del epitelio pigmentario retiniano. Apo: apolipoproteínas; EC colesteriol esterificado; PL fosfolípidos; TG: triglicéridos; UC: colesterol no esterificado. El signo de pregunta señala que no se conocen todas las apoliproproteínas.
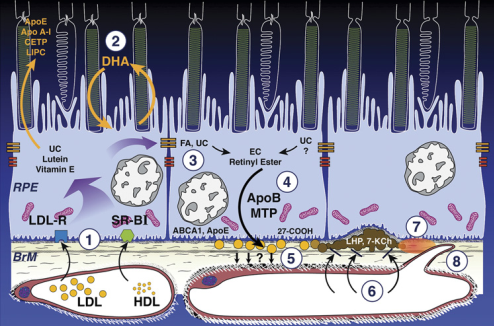
Fig 3. El derrame de aceite en la membrana de Bruch de la biología a la patobiología. De arriba hacia abajo, se observan los segmentos externos del fotoreceptor, Epitelio pigmentario retiniano (RPE), membrana de Bruch (BrM) y coriocapilares. Las células del RPE contienen núcleo y mitocondria . Se omitió la lipofuscina para mayor claridad. 1) lipoproteina de baja densidad (LDL) y lipobproteina de alta densidad (HDL) que proporcionan nutrientes lipofilicos son tomados por el receptor clase B, tipo I (SR-B!) en el RPE basolateral. 2) Las proteínas normalmente asociadas con el metabolismo de HDL están expresadas en el espacio subretiniano y pueden estar involucradas en el rápido recambio de colesterol no estrtificado en la retina neurosensorial. El docosahexaenoico (DHA) se presenta cíclicamente entre el RPE y la retina. 3) La lipoproteina apoliproteina B se secreta basolateralmente y se junta desde varias fuentes: absorción de lipoproteinas en plasma, lípidos sintetisados de manera endógena y productos de degradación del fotorreceptor. Los ácidos grasos (FA), especialmente el linoleato, provienen principalmente de las lipoproteinas. El colesterol no esterificado (UC), de origen aun no determinado, es resterificado (no se ve). Las lipoproteinas de la BrM también contienen esteres de retinol. 4) El RPE expresa tanto apoB como proteina microsomal transportadora de triglicéridos (MTP) y secreta partículas de colesterol esterificado (EC) en la membrana de Bruch (círculos dorados), donde se retienen y finalmente se liberan a través del endotelio coriocapilar. 5) Partículas de lipoproteína comienzan a acumularse en la edad adulta por razones desconocidas, formándose una capa en la membrana basal del EPR (pared lípida). Otras vías de salida del UC son apoE, ABCA1, ApoE y conversión enzimática de oxiesteroles (27-COOH). 6) Con el tiempo, tal vez por especies reactivas al oxigeno de las miticondrias lindantes, aparecen especies proinlfamatorias/tóxicas como hidroperoxido de linoleato y 7-keto colesterol. Las partículas podrían fundirse formando desechos lipoproteicos, principal componente de los depósitos lineales basales y drusas blandas. 7) la inflamación se produce en la BrM interna. 8) Luego se produce la neovascularisación (tipo I),
Los descubrimientos sobre el epitelio pigmentario retiniano y las apolipoproteinas podrían servir para mejorar tratamientos, prevenir y tratar a los pacientes con DMAE. Debe profundizarse el conocimiento de la fisiología ocular para desarrollas mejores herramientas y modelos.
La tomografía de coherencia óptica de dominio espectral muy utilizada por los especialistas en retina, muestra claramente elevaciones drusenoides y señales de engrosamiento del epitelio pigmentario retiniano, pero no pueden distinguirse lesiones difusas de la membrana basal y depósitos lineales basales, corriéndose el riesgo de que la patología siga avanzando. El colesterol estratificado es abundante en el núcleo necrótico de la placa aterosclerótica y puede visualisarse de distintas maneras. Se podría lograr la separación de lesiones que antes no podían detectarse mediante el contenido lípido.
Conclusiones:
La vía de la apolipoproteina B, que conduce a la lipoproteína de muy baja densidad hepática y su metabolito de lipoproteina de baja densidad, es una de las más intensamente estudiadas en investigaciones cardiobasculares, sobre diabetes y obesidad. El descubrimiento de una lipoproteína apoB en la membrana de Bruch significa un descubrimiento fundamental para los oftalmólogos que intenten descubrir nuevos métodos para la DMAE.
♦ Síntesis y traducción: Dr. Martín Mocorrea, editor responsable de Intramed en la especialidad de oftalmología.
Bibliografía:
1. Miller JW. Treatment of age-related macular degeneration: beyond VEG-F. Jpn J Ophthalmol 2010;54:523e8.
2. Pauleikhoff D, Harper CA, Marshall J, et al. Aging changes in Bruch’s membrane:a histochemical and morphological study. Ophthalmology 1990;97:171e8.
3. Sheraidah G, Steinmetz R, Maguire J, et al. Correlation between lipids extracted from Bruch’s membrane and age. Ophthalmology 1993;100:47e51.
4. Holz FG, Sheraidah G, Pauleikhoff D, et al. Analysis of lipid deposits extracted from human macular and peripheral Bruch’s membrane. Arch Ophthalmol 1994;112:402e6.
5. Wolter JR, Falls HF. Bilateral confluent drusen. Arch Ophthalmol 1962;68:219e26.
6. Pauleikhoff D, Zuels S, Sheraidah GS, et al. Correlation between biochemical
composition and fluorescein binding of deposits in Bruch’s membrane.
Ophthalmology 1992;99:1548e53.