| Introducción |
La obesidad es un problema de salud pública mundial asociado con una mayor prevalencia de múltiples enfermedades crónicas en comparación con las personas sin obesidad. La prevalencia de la obesidad entre los adultos, definida como un IMC de 30 o más, alcanza el 42% en los EE. UU. y se proyecta que afectará a casi 1 de cada 2 adultos para 2030. En todo el mundo, la obesidad afecta al 19% de las mujeres y al 14% de los hombres. Los medicamentos anti obesidad (AOM, por sus siglas en inglés) afectan la desregulación del apetito asociada con la obesidad, logrando y manteniendo así una mayor pérdida de peso.
Varias pautas de tratamiento de la obesidad recomiendan la farmacoterapia junto con la modificación del estilo de vida. La FDA ha aprobado múltiples AOM que están indicados para adultos con un IMC de 30 o más o para adultos con un IMC de 27 o más con comorbilidades, como diabetes tipo 2, hipertensión o dislipidemia. Los AOM también están indicados para adolescentes (≥12 años) con un IMC igual o superior al percentil 95 para la edad y el sexo. No existe evidencia suficiente para el uso en menores de 12 años. Los medicamentos anti obesidad disponibles actualmente se presentan en 3 grupos según sus mecanismos de acción: medicamentos intragastrointestinales (orlistat), medicamentos de acción central (fentermina, fentermina-topiramato, naltrexona-bupropión) y medicamentos basados en hormonas estimuladas por nutrientes (liraglutida, semaglutida, tirzepatida) (Figura 1)
| Métodos |
Se realizó una búsqueda bibliográfica en PubMed utilizando los siguientes términos de búsqueda: agentes antiobesidad, terapia farmacológica para la obesidad y farmacoterapia para la obesidad. La búsqueda se limitó a ensayos clínicos aleatorizados (ECA), revisiones sistemáticas y guías de práctica.
| Medicamentos intragastrointestinales |
Actualmente, solo un fármaco aprobado por la FDA, el orlistat, actúa bloqueando la absorción de lípidos en el tracto gastrointestinal (GI). En el lumen del estómago y el intestino delgado, el orlistat forma un enlace covalente con el sitio activo de las lipasas intestinales, bloqueando la digestión y absorción de aproximadamente el 30% de la grasa de la dieta, lo que conduce a un déficit calórico. Un tratamiento independiente, el hidrogel de celulosa y ácido cítrico, se administra como un medicamento oral y, después de la ingestión, se expande para ocupar el 25% del volumen del estómago, lo que promueve una sensación de plenitud y mayor saciedad.
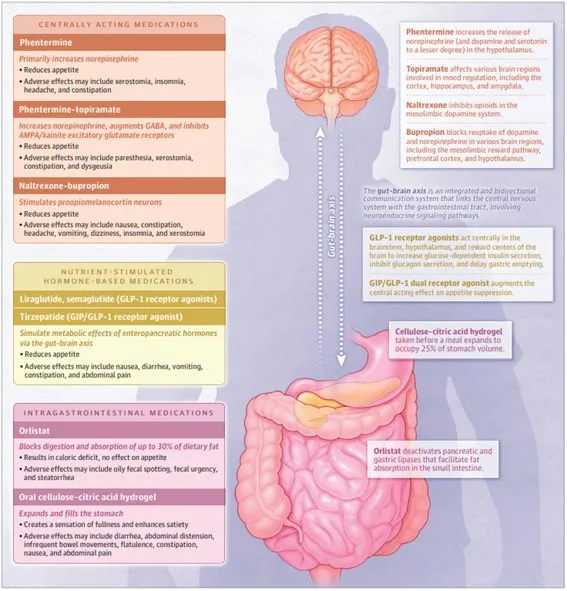
Figura 1. Mecanismos de acción y efectos adversos comunes de tres clases de medicamentos contra la obesidad
> Orlistat
Orlistat ha sido aprobado para adultos desde 1999 y para adolescentes desde 2003. Aunque la mayoría de las pautas respaldan su uso, las de la Asociación Estadounidense de Gastroenterología (AGA) recomendaron no usar orlistat debido a su pequeño efecto en la pérdida de peso y los efectos adversos gastrointestinales. Un metanálisis de 52 ECA que incluyeron 16.964 participantes informó que orlistat se asoció con una reducción de peso un 3,1% mayor que el placebo entre adultos con obesidad. Casi el 70% de los participantes que tomaron orlistat lograron una pérdida de peso del 5% o más (Figura 2), y los adolescentes tuvieron disminuciones significativas en el IMC.
El orlistat redujo la circunferencia de la cintura en aproximadamente 10 cm, la presión arterial sistólica (PAS) en aproximadamente 6 mm Hg y el colesterol LDL (LDL-C) en aproximadamente un 9% entre los adultos con obesidad. Entre los pacientes con hipertensión, un metanálisis de 4 ECA que incluyeron 2058 participantes informó que el orlistat se asoció con una disminución de la PAS 2,6 mm Hg mayor en comparación con placebo. En un ECA de 4 años, el orlistat se asoció con un riesgo 37,3% menor de diabetes tipo 2 en comparación con placebo. En otro metanálisis, el orlistat se asoció con una pérdida de peso 2 kg mayor y una reducción de la hemoglobina A1c 0,5 % mayor que el placebo. No se ha completado un ECA para probar los efectos del orlistat sobre los eventos cardiovasculares.
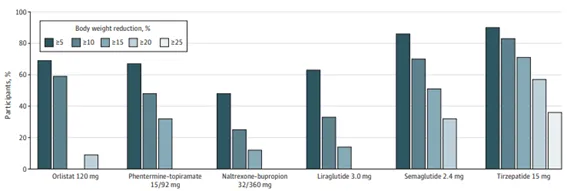
Figura 2. Porcentaje de adultos que alcanzan objetivos de pérdida de peso según fármaco utilizado
El orlistat puede ser más apropiado para pacientes que se beneficiarían con sus efectos cardiometabólicos y que no toleran o tienen contraindicaciones para otros medicamentos antidiabéticos. Sin embargo, la adherencia al orlistat ha sido deficiente. En un gran sistema de salud de los EE. UU., ningún paciente al que se le recetó orlistat continuó tomando el medicamento después de 12 meses. Los efectos adversos gastrointestinales, como manchas de heces aceitosas (27 %), urgencia fecal (22 %) y esteatorrea (20 %), son comunes en el primer año de uso de orlistat, pero generalmente se resuelven en 4 semanas y se pueden reducir siguiendo una dieta baja en calorías con menos del 30 % de grasas. Debido a su mecanismo de acción, el orlistat debe administrarse con comidas que contengan algo de grasa (10 %-30 % de calorías) para que sea eficaz y limite los efectos adversos.
> Hidrogel de celulosa y ácido cítrico
El hidrogel de celulosa y ácido cítrico fue aprobado por la FDA para adultos en 2019. Las pautas de la AGA indicaron que no había evidencia suficiente para recomendar su uso. A su vez, el fabricante se declaró en quiebra en octubre de 2023 comprometiendo su disponibilidad.
| Medicamentos de acción central |
Los AOM aprobados por la FDA que actúan sobre el sistema nervioso central incluyen fentermina, fentermina-topiramato y naltrexona-bupropión. Estos medicamentos tienen varios mecanismos de acción. Los regímenes combinados, como fentermina-topiramato y naltrexona-bupropión, se desarrollaron para proporcionar efectos complementarios para mejorar la pérdida de peso. La fentermina es una amina simpaticomimética que aumenta principalmente la norepinefrina en el hipotálamo con efectos menores sobre la dopamina y la serotonina. La información sobre la fentermina puede no ser aplicable a otros simpaticomiméticos, como el dietilpropión o la benzfetamina.
La fentermina tiene un potencial de abuso relativamente bajo y no se han reportado signos de abuso de fentermina o dependencia física. El topiramato aumenta la actividad del γ-aminobutirato e inhibe los receptores de glutamato excitatorios del ácido α-amino-3-hidroxi-5-metil-4-isoxazolpropiónico; por lo tanto, el topiramato de fentermina actúa a través de varios mecanismos centrales para reducir el apetito y aumentar la saciedad. La naltrexona y el bupropión reducen el apetito y los antojos de comida a través de diferentes mecanismos que estimulan las neuronas proopiomelanocortina.
> Fentermina
La fentermina fue aprobada en los EE. UU. para uso a corto plazo (3 meses o menos) en 1959 y, por lo tanto, su uso a largo plazo se considera fuera de etiqueta. Las pautas de la Endocrine Society y la AGA recomiendan el uso a largo plazo de fentermina para tratar la obesidad en adultos sin enfermedad cardiovascular. Pocos ECAs han probado la eficacia y seguridad de la fentermina durante más de 3 meses y se necesitan ensayos a largo plazo para que la FDA considere extender la duración aprobada de uso. Un ECA informó que fentermina 7,5 mg se asoció con una pérdida de peso del 5,5% y fentermina 15 mg se asoció con una pérdida de peso del 6,1%, significativamente mayores que el placebo. Más del 40% de los participantes lograron una pérdida de peso del 5% o más con cualquiera de las dosis de fentermina a los 6 meses.
Hay poca evidencia con respecto a los resultados cardiometabólicos con fentermina. Un gran estudio observacional informó una mayor reducción de peso sin un mayor riesgo de eventos cardiovasculares durante 3 años. No se informaron aumentos de la presión arterial con el uso de fentermina durante 6 meses y la PAS disminuyó con su uso. Los efectos adversos comunes son xerostomía (7%-12%), insomnio (6%-11%), cefalea (10%-12%) y estreñimiento (4%-8%), que pueden mejorar con la reducción de la dosis. La fentermina puede no estar disponible en algunos países fuera de los EE. UU.
> Fentermina-topiramato
La fentermina-topiramato ha sido aprobada para uso a largo plazo en los EE. UU. para adultos desde 2012 y fue aprobada para adolescentes en 2022. Un metanálisis informó que fentermina-topiramato se asoció con una pérdida de peso un 8% mayor que el placebo entre adultos con obesidad. A los 12 meses, la pérdida de peso media fue del 7,8 % con fentermina-topiramato 7,5/46 mg y del 9,8 % con fentermina-topiramato 15/92 mg. Un estudio de seguimiento informó que estas reducciones de peso persistieron a los 2 años con el uso continuo de la medicación. Más de dos tercios de los usuarios de fentermina-topiramato 15/92 mg lograron una pérdida de peso del 5 % o más (Figura 2). Los adolescentes tuvieron una reducción significativa del 10,4 % en el IMC con fentermina-topiramato 15/92 mg en comparación con placebo. El perfil de seguridad fue similar al perfil de seguridad en adultos.
La fentermina-topiramato redujo la circunferencia de la cintura en aproximadamente 11 cm, disminuyó la PAS en aproximadamente 3 mmHg y redujo el colesterol LDL en aproximadamente un 6%. En el seguimiento a los 2 años, la fentermina-topiramato 15/92 mg redujo la progresión a diabetes tipo 2 en comparación con placebo. Los pacientes con diabetes tipo 2 lograron una pérdida de peso media del 9,4 % y una reducción de la hemoglobina A1c del 1,6 % a los 12 meses con fentermina-topiramato 15/92 mg en comparación con placebo. No se ha realizado un ensayo de resultados cardiovasculares para fentermina-topiramato.
Como la fentermina-topiramato a largo plazo puede lograr y mantener una reducción de peso del 10 %, esta AOM puede ser útil para los pacientes que necesitan alcanzar este objetivo, en particular para reducir la presión arterial o controlar la diabetes. Sin embargo, médicos y los pacientes deben ser conscientes de que su uso no está aprobado para esa finalidad y que los datos limitados de los ensayos clínicos respaldan el enfoque.
Los eventos adversos comunes asociados con la combinación de fentermina y topiramato incluyen parestesias (14%-20%), sequedad de boca (14%-19%), estreñimiento (15%-16%) y disgeusia (7%-9%), que pueden mejorar con la reducción de la dosis. Debido a un mayor riesgo de malformaciones congénitas (labio leporino) por el topiramato, las personas en edad fértil deben tener un test de embarazo negativo antes del tratamiento y deben ser monitoreadas con test de embarazo mensuales mientras reciban el fármaco. También se debe aconsejar a las personas en edad fértil que utilicen regularmente métodos anticonceptivos. Es posible que fentermina-topiramato no esté disponible en otros países donde los reguladores citan la necesidad de datos a largo plazo sobre resultados cardiovasculares, psiquiátricos y cognitivos para considerar la aprobación.
> Naltrexona-Bupropión
Naltrexona-bupropión fue aprobada para uso a largo plazo en adultos en 2014; no se ha estudiado en adolescentes. Un metanálisis informó que la se asoció con una pérdida de peso un 4,1 % mayor que el placebo. La combinación de naltrexona-bupropión con terapia conductual intensiva se asoció con una pérdida de peso del 9,3% a los 12 meses, en comparación con una pérdida de peso del 5,1% para el placebo combinado con terapia conductual intensiva. Casi la mitad de los participantes de naltrexona-bupropión lograron una pérdida de peso del 5% o más en otro ECA (Figura 2).
En comparación con otros medicamentos, naltrexona-bupropión tiene menos efectos sobre los factores de riesgo cardiovascular. No tuvo un efecto significativo sobre la presión arterial en comparación con el placebo. Se sabe que el bupropión aumenta la presión arterial. Los pacientes con diabetes tipo 2 lograron una pérdida de peso media del 5% y una reducción de la hemoglobina A1c del 0,6% a los 12 meses con naltrexona-bupropión versus placebo. Un ECA que incluyó a 8910 personas no informó efectos significativos de la naltrexona-bupropión sobre los eventos cardiovasculares adversos mayores (MACE) en comparación con placebo.
En la práctica clínica, la adherencia a la medicación es relativamente baja (34 % a los 3 meses; 10 % a los 12 meses). Los efectos adversos incluyen náuseas (33%), estreñimiento (19%), cefalea (18%), vómitos (11%), mareos (10%), insomnio (9%) y xerostomía (8%). La dosis máxima está limitada a 8/90 mg diarios de naltrexona-bupropión en pacientes con insuficiencia renal moderada y hepática leve a moderada, y se debe evitar en adultos jóvenes con depresión/ansiedad.
| Medicamentos basados en hormonas estimuladas por alimentos |
El descubrimiento del papel del eje intestino-cerebro en el control del apetito ha proporcionado nuevos objetivos biológicos para el desarrollo de fármacos, basados en hormonas estimuladas por alimentos, que simulan los efectos metabólicos de las hormonas enteropancreáticas naturales. Los agonistas del receptor GLP-1 (aGLP-1) han sido los más estudiados debido a su efecto incretina (es decir, secreción de insulina amplificada después de la administración oral vs. intravenosa de glucosa) y otras acciones cardiometabólicas pleiotrópicas (por ejemplo, disminución de la presión arterial e inflamación) que están mediadas por la distribución generalizada de los receptores GLP-1 en todo el cuerpo. Los aGLP-1 se introdujeron inicialmente para el tratamiento de la diabetes tipo 2 y más recientemente para el tratamiento de la obesidad.
La FDA ha aprobado 3 AOM basados en hormonas estimuladas por alimentos: liraglutida, semaglutida y tirzepatida. Como la vida media del GLP-1 nativo es de sólo 2 a 3 minutos debido a la rápida degradación por la dipeptidil peptidasa IV (DPP-4), estos AOM tienen una estructura modificada para resistir la proteólisis de la DPP-4 y prolongar la vida media. La liraglutida es un aGLP-1 con un 97% de homología con el GLP-1 humano con con una vida media de 11 a 15 horas con la administración subcutánea diaria. La semaglutida es otro aGLP-1 que está diseñado para la administración subcutánea semanal, con una vida media de 183 horas. La tirzepatida es un agonista dual GIP/GLP-1 con una vida media de 117 horas con la administración subcutánea semanal. El GIP parece actuar sinérgicamente con el GLP-1 en el cerebro para promover una mayor magnitud de pérdida de peso en comparación con el GLP-1 solo.
> Liraglutida
Un metanálisis informó que, en comparación con placebo, la liraglutida se asoció con una reducción de peso del 4,7 % entre los adultos con obesidad. El metanálisis incluyó ECA tanto para el tratamiento de la diabetes tipo 2 como de la obesidad. En concreto, la liraglutida se ha estudiado en 5 ECA. Más del 60 % de los participantes tratados con liraglutida lograron una pérdida de peso del 5 % o más. En un ensayo de adolescentes con obesidad, liraglutida logró una reducción media del IMC de 5% en comparación con placebo.
La liraglutida redujo la circunferencia de la cintura en aproximadamente 8 cm, disminuyó la presión arterial sistólica en aproximadamente 4 mmHg y redujo el colesterol LDL en aproximadamente un 8 % entre los adultos con obesidad. Entre los pacientes con diabetes tipo 2, una dosis más alta de liraglutida para la obesidad (es decir, 3 mg/día) no logró mayores reducciones en la hemoglobina A1c en relación con una dosis más baja (1,8 mg/día) para el tratamiento de la diabetes tipo 2. La liraglutida 3 mg resultó en una pérdida de peso media del 6 % y una disminución media de la hemoglobina A1c del 1,6 % entre los adultos con diabetes tipo 2 y obesidad.
La adherencia al tratamiento disminuyó con el tiempo (52% a los 3 meses; 17% a los 12 meses). El seguimiento regular puede ser importante para maximizar la adherencia a largo plazo. Los efectos adversos más comunes asociados con la liraglutida son náuseas (39%), diarrea (21%) y estreñimiento (19%), que son de leves a moderados y ocurren principalmente durante la fase de aumento de la dosis.
> Semaglutida
Se aprobó la semaglutida para el control crónico del peso en 2021 para adultos y en 2022 para adolescentes. La semaglutida 2,4 mg también se aprobó para reducir el riesgo de MACE en adultos con enfermedad cardiovascular establecida y obesidad o sobrepeso en 2024. Un metanálisis informó una pérdida de peso 11,4 % mayor que el placebo entre los adultos tratados por obesidad. Más del 85% de los participantes que tomaron semaglutida alcanzaron una pérdida de peso del 5% o más (Figura 2). Cuando se comparó directamente, la pérdida de peso fue del 15,8% para semaglutida y del 6,4% para liraglutida. En un ECA de adolescentes con obesidad, semaglutida alcanzó una reducción del IMC del 16,1% en comparación con un aumento del IMC del 0,6% para placebo.
Semaglutida redujo la circunferencia de la cintura en aproximadamente 14 cm y la PAS en aproximadamente 6 mm Hg. Semaglutida 2,4 mg resultó en una pérdida de peso media del 9,6% y una disminución media de la hemoglobina A1c del 1,6% entre adultos con diabetes tipo 2 y obesidad. En el ensayo SELECT, la semaglutida 2,4 mg redujo los eventos adversos cardiovasculares graves en un 20 % en comparación con placebo en adultos con un IMC de 27 o mayor y enfermedad cardiovascular preexistente sin diabetes tipo 2. Debido a que la semaglutida logra y mantiene una reducción de peso superior al 10% mientras continúa la terapia, este AOM puede ser el más apropiado para pacientes que necesitan alcanzar este objetivo.
A diferencia de otros AOMs, la adherencia al tratamiento con semaglutida se mantuvo relativamente alta a lo largo del tiempo (63% a los 3 meses; 40% a los 12 meses). Los efectos adversos comunes de la semaglutida incluyen náuseas (44%), diarrea (30%), vómitos (24%), estreñimiento (24%) y dolor abdominal (20%), que son leves a moderados y ocurren principalmente durante el aumento de la dosis. Las náuseas, la diarrea y los vómitos suelen desaparecer en una semana; sin embargo, el estreñimiento puede durar aproximadamente 45 días. Asesorar a los pacientes al inicio sobre modificaciones dietéticas clave, como aumentar la ingesta de fibra, puede ayudar a mitigar estos efectos.
> Tirzepatida
La tirzepatida fue aprobada para tratar la obesidad en adultos en 2023. Un metanálisis informó que la tirzepatida 15 mg se asoció con una pérdida de peso un 12,4 % mayor que el placebo entre adultos con obesidad, que incluyeron ECA tanto para el tratamiento de la diabetes tipo 2 como de la obesidad. Más del 90 % de los participantes tratados con tirzepatida 15 mg lograron una pérdida de peso del 5 % o más (Figura 2).
Se observaron mejoras dependientes de la dosis con tirzepatida para múltiples resultados cardiometabólicos. Por ejemplo, la tirzepatida 15 mg redujo la circunferencia de la cintura en aproximadamente 19 cm, disminuyó la PAS en aproximadamente 8 mm Hg y redujo el colesterol LDL en un 9%. La tirzepatida 15 mg resultó en una pérdida de peso media del 14,7% y una disminución media de la hemoglobina A1c del 2,1% entre adultos con diabetes tipo 2 y obesidad. Aunque no hay comparaciones directas, la tirzepatida 10 mg y 15 mg mostraron una mayor pérdida de peso que la semaglutida 2,4 mg. Los efectos adversos de la tirzepatida suelen incluir náuseas (25%-29%), diarrea (19%-23%), estreñimiento (11%-17%) y vómitos (8%-13%).
| AOM en desarrollo |
Actualmente se están estudiando combinaciones de medicamentos basados en hormonas estimuladas por alimentos (agonistas duales y triagonistas) entre adultos con obesidad. Se están estudiando los AOM basados en hormonas estimuladas por alimentos administrados por vía oral en adultos con obesidad. En un ensayo clínico, semaglutida oral 50 mg diarios logró una pérdida de peso del 12,7% en comparación con placebo. Se están desarrollando nuevas terapias con mecanismos de acción diferentes; por ejemplo, un anticuerpo que bloquea los receptores de activina tipo II, bimagrumab, causó una pérdida significativa de masa grasa y una ganancia de masa muscular. Se está llevando a cabo un ECA multicéntrico para determinar la eficacia y seguridad del uso de fentermina durante 24 meses.
| Cambio de estilo de vida y AOMs |
Todos los AOMs están aprobados como terapia complementaria a una dieta reducida en calorías y una mayor actividad física. Los médicos deben aconsejar a los pacientes sobre estas modificaciones del estilo de vida en el momento del inicio del AOM. Existen recomendaciones nutricionales importantes para AOM específicas, como evitar una dieta rica en grasas con orlistat o naltrexona bupropión. Los resultados mejoran cuando los AOMs, en particular naltrexona-bupropión, se combinan con una terapia conductual intensiva. La terapia conductual intensiva puede ser menos importante junto con semaglutida o tirzepatida. Con semaglutida y tirzepatida, los médicos pueden centrar el asesoramiento en los patrones de alimentación saludable y la calidad de los alimentos, priorizando las proteínas magras y aumentando el consumo de frutas, verduras y carbohidratos complejos.
| Seguridad de los AOM |
Los médicos deben analizar los perfiles de efectos adversos de los AOM con los pacientes. Dados sus diversos mecanismos, los médicos deben examinar el perfil de riesgo-beneficio de cada AOM individualmente. Una preocupación particular es mantener la masa corporal magra (masa muscular) durante la pérdida de peso, que es importante para la movilidad y la función física, en particular entre los adultos mayores. Los AOM deben usarse en adultos de 65 años o más con precaución. El asesoramiento sobre actividad física de los médicos debe integrar el entrenamiento de resistencia para disminuir la pérdida de masa corporal magra y mejorar la fuerza funcional y la movilidad. La actividad aeróbica por sí sola suele ser insuficiente para preservar la masa corporal magra. La actividad física también es importante para mantener la pérdida de peso.Los AOM suelen estar contraindicados en embarazadas y deben evitarse en pacientes en período de lactancia. Se recomienda el uso de métodos anticonceptivos en personas con posibilidad de embarazo. La planificación previa a la concepción es importante: la semaglutida, por ejemplo, debe interrumpirse al menos 2 meses antes de intentar el embarazo.
| Duración del uso de AOM |
En los ámbitos de atención primaria, el uso de AOM aumenta la proporción de pacientes que logran una pérdida de peso del 5% o más. Sin embargo, los estudios han encontrado una mala adherencia a la medicación en la práctica clínica. El aumento de peso es común cuando se interrumpen los AOM. Los médicos deben utilizar la toma de decisiones compartida para determinar la duración de la medicación, como continuar con un AOM a largo plazo con la dosis efectiva más baja, usar una terapia intermitente o suspender la medicación seguida de un control estricto del peso. Las consideraciones financieras son importantes para la capacidad de los pacientes de iniciar y adherirse al tratamiento continuo.
| Conclusiones |
La obesidad se asocia a múltiples comorbilidades. Los medicamentos antidiabéticos orales son terapias complementarias eficaces a los cambios en el estilo de vida para mejorar la pérdida de peso y los resultados de salud.
Traducción y resumen objetivo: Dr. Cristian Pisa