O sistema nervoso central (SNC) é um importante regulador do trato gastrointestinal e a sua disfunção pode resultar em sintomas gastrointestinais adversos. Pacientes com distúrbios neurológicos inflamatórios e autoimunes geralmente apresentam sintomas gastrointestinais associados, embora a etiologia desses possa variar. Por exemplo, a maioria dos enfermos com esclerose múltipla relata sintomas sugestivos de um distúrbio da motilidade gastrointestinal, provavelmente relacionado ao envolvimento do sistema nervoso autônomo. Para pacientes com outras condições neuroimunológicas e neuroinflamatórias sistêmicas, o reconhecimento de sintomas gastrointestinais é provavelmente subestimado, talvez devido a sintomas mais dramáticos em outros sistemas orgânicos.
Da mesma forma, para pacientes que apresentam sintomas gastrointestinais, muitas vezes há uma subestimação da natureza neurológica, neuroimune e inflamatória da doença. Por exemplo, a análise transcriptômica de pacientes com gastroparesia idiopática revelou um papel claro do sistema imunológico no processo da doença e, da mesma forma, em pacientes com distúrbios de motilidade esofágica, há uma alta taxa de detecção de autoanticorpos. No entanto, a maioria é tratada cirurgicamente, em vez de terapia imunomoduladora. As atuais estratégias de tratamento, muitas vezes empregadas de forma independente pelo neurologista e pelo gastroenterologista, levantam a questão de saber se o manejo é realizado de forma ideal quando isolados em uma especialidade. Por isso, Sanchez e colaboradores (2020) forneceram uma visão geral da literatura, destacando os potenciais mecanismos de crosstalk entre distúrbios neurológicos imunomediados e disfunção gastrointestinal.
| Mecanismos do Crosstalk |
O eixo cérebro-intestino incorpora sinais bidirecionais do SNC, sistema nervoso autônomo, sistema nervoso entérico, microbiota intestinal e sistema imunológico para responder às necessidades dinâmicas da fisiologia humana. As divisões simpática e parassimpática do sistema nervoso autônomo fornecem sinais eferentes para modular a motilidade gastrointestinal, a secreção e o fluxo sanguíneo para o trato gastrointestinal. Em contraste, os neurônios aferentes transmitem informações ao SNC, incluindo a distensão mecânica e o estado alimentado/rápido do trato gastrointestinal. Além disso, a microbiota gastrointestinal produz moléculas neuroativas e tem influência substancial na imunidade da mucosa.
As células dos sistemas imunológico e nervoso são funcionalmente significativas no trato gastrointestinal. Foi demonstrado que as catecolaminas induzem diferencialmente macrófagos inflamatórios pró (semelhantes a M1) e anti (semelhantes a M2) no intestino. O efeito da sua sinalização parece ser dependente do contexto, uma vez que a ativação dos adrenorreceptores α2 promove a produção de citocinas pró-inflamatórias, enquanto a dos adrenorreceptores β2 resulta na síntese de citocinas anti-inflamatórias. Em contraste, foi demonstrado que o principal neurotransmissor parassimpático, a acetilcolina, diminui a produção de citocinas pró-inflamatórias em macrófagos e células dendríticas, entre outros tipos de células imunes. A serotonina modula a polarização dos macrófagos e a fagocitose. Os neuropeptídeos, incluindo a substância P, o neuropeptídeo Y e o peptídeo YY, podem aumentar a produção de citocinas pró-inflamatórias em monócitos e aumentar a fagocitose em macrófagos. O peptídeo intestinal vasoativo (VIP) induz células dendríticas reguladoras que podem então ativar células T reguladoras. O VIP também pode reduzir o TGF-β1, que pode impulsionar células T-helper-17 pró-inflamatórias, e aumentar a produção de IL-10 em macrófagos. Assim, os neurônios do sistema nervoso entérico e as células imunes inatas residentes no intestino estão intimamente associadas através de sinalização bidirecional.
O sistema imunológico adaptativo também está envolvido no crosstalk. Curiosamente, algumas células T são intrinsecamente capazes de produzir acetilcolina através da colina acetiltransferase. Essas podem ser ativadas por sinais eferentes do nervo vago para o nervo esplênico. Por outro lado, a sinalização vagal aferente pode resultar em efeitos anti-inflamatórios. A sinalização de catecolaminas via receptores β2-adrenérgicos interage com receptores de quimiocinas para controlar a migração de células T e B e pode modular diferencialmente a produção de citocinas em diferentes subconjuntos de células T. Da mesma forma, a dopamina pode controlar a migração de células T e a secreção de citocinas. Os neuropeptídeos também podem influenciar a produção de citocinas pelas células T. No geral, a grande coleção de células imunes inatas e adaptativas que residem no intestino está ligada a estímulos do sistema nervoso e da microbiota para manter a homeostase num ambiente em constante mudança.

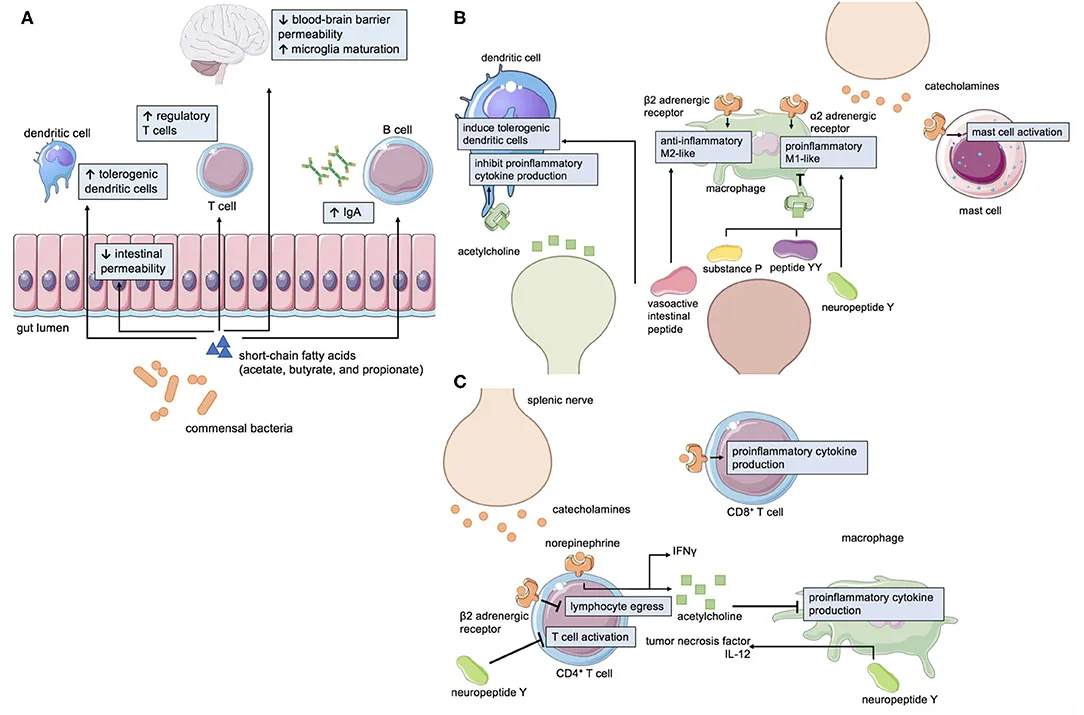
Figura 1: Mecanismos de crosstalk. (A) Ácidos graxos de cadeia curta (AGCCs), como acetato, butirato e propionato, são metabólitos gerados por bactérias intestinais comensais que afetam a permeabilidade intestinal, a imunidade e a fisiologia do SNC. Neurotransmissores e neuropeptídeos podem influenciar a função das células imunes (B) inatas e (C) adaptativas. Imagem retirada de Sanches e Colaboradores (2023)
| O papel da microbiota intestinal e da permeabilidade intestinal das doenças neuro inflamatórias |
Os microrganismos e seus metabólitos podem influenciar a secreção e a motilidade gástrica, direcionando a produção de serotonina; modular a diferenciação e função das células imunológicas; e aumentar a neuro gênese. O epitélio do trato gastrointestinal é fundamental para manter uma barreira entre o conteúdo luminal dos intestinos e o resto do corpo, porém esta possui permeabilidade seletiva que permite a absorção de nutrientes, bem como de certos produtos microbianos. Em algumas condições neuro inflamatórias, a permeabilidade é aumentada, o que pode permitir a translocação patogénica de microrganismos intestinais e produtos derivados da microbiota para a circulação que promovem a inflamação. Por outro lado, certos microrganismos comensais, incluindo certas cepas de Lactobacillus e Bifidobacterium, têm a capacidade de regular positivamente a expressão de proteínas de junção estreita entre células epiteliais e fortalecer a barreira intestinal.
O transtorno do espectro do autismo é um continuum de condições de neurodesenvolvimento caracterizadas por comportamentos repetitivos, sociabilidade alterada e dificuldades de linguagem. A disfunção e o aumento da permeabilidade da barreira gastrointestinal são uma comorbidade comum da doença. Pacientes com transtorno do espectro do autismo também apresentam alterações nas comunidades bacterianas intestinais, incluindo menor abundância de Akkermansia, Bacteroides, Escherichia coli e Enterococcus e maior abundância de Faecalibacterium e Lactobacillus. Foi demonstrado que bactérias específicas, como Bacteroides fragilis e Lactobacillus reuteri, modulam modelos de transtorno do espectro do autismo em camundongos, reduzindo a inflamação intestinal, a permeabilidade e visando redes oxitocinérgicas e dopaminérgicas.
A esclerose múltipla (EM) é uma doença desmielinizante imunomediada do SNC e a causa mais comum de incapacidade física não traumática em adultos jovens. A dismotilidade gastrointestinal e o aumento da permeabilidade são prevalentes em pacientes com EM e na encefalomielite autoimune experimental (EAE). Vários estudos relataram alterações em cepas específicas de bactérias, como elevação de Methanobrevibacter e Porphyromonas e diminuição de Bacteroides e Lactobacillus em pacientes com esclerose múltipla. Além disso, foi demonstrado que as terapias modificadoras da doença para a esclerose múltipla alteram a composição microbiana intestinal, embora as consequências funcionais destas alterações não sejam conhecidas. Ademais, foi demonstrado que bactérias específicas, incluindo Bacteroides, Lactobacillus e Prevotella, protegem contra a EAE através da modulação da resposta imunitária, incluindo a indução de células T reguladoras e a supressão de células T auxiliares pró-inflamatórias (Th) tipo 1 e Th17.
A doença de Parkinson é uma doença neurodegenerativa associada à agregação patológica de α-sinucleína no SNC. Os sintomas característicos da doença são tremor, rigidez muscular e equilíbrio prejudicado. Curiosamente, os pacientes apresentam inflamação gastrointestinal e aumento da permeabilidade intestinal anos antes dos déficits neurológicos e a α-sinucleína pode ser encontrada precocemente no sistema nervoso entérico e nos nervos glossofaríngeo e vagal. De fato, os pacientes com doença apresentam alterações em certos táxons comensais intestinais, incluindo diminuição de Prevotellaceae e aumento de Verrucomicrobiaceae.
Os exemplos acima demonstram a ampla influência que a microbiota intestinal tem nas doenças neurológicas de diversas etiologias. A sua capacidade de modular o sistema imunológico, produzir compostos neuroativos, afetar a função da barreira intestinal, entre outras funções, acrescenta uma camada de complexidade às doenças neuro inflamatórias. Os mecanismos de comunicação entre a microbiota intestinal e o SNC ao longo do eixo intestino-cérebro ainda não foram totalmente elucidados. Ainda assim, os resultados positivos de ensaios piloto utilizando probióticos, antibióticos e transferência de microbiota fecal em certas condições neurológicas sugeriram que as terapias baseadas na microbiota podem estar no horizonte para contextos específicos.
| Manifestações neurológicas das doenças gastrointestinais |
Na direção oposta, foi demonstrado que certas doenças gastrointestinais, incluindo a doença inflamatória intestinal (DII) e a doença celíaca, apresentam envolvimento neurológico. Embora os mecanismos exatos ainda não tenham sido elucidados, investigações futuras serão críticas para abordar estas manifestações.
A DII, que inclui colite ulcerativa e doença de Crohn, é caracterizada por inflamação crônica do trato gastrointestinal. Estudos de imagem demonstraram aumento de lesões na substância branca, diminuição do volume da substância cinzenta e aumento do dano axonal em pacientes com DII. Embora outros estudos não tenham conseguido identificar estas alterações neurológicas associadas à DII, isto pode ser devido a diferenças na gravidade da doença no momento da imagem. Na verdade, foi relatado que a atrofia da substância cinzenta está correlacionada com a duração da DII. A etiologia destas lesões estruturais não é completamente compreendida, embora vários mecanismos tenham sido propostos. Estes incluem tromboembolismo, vasculite, inflamação neurotóxica, desmielinização, leucoencefalopatia multifocal progressiva iatrogênica e infecções oportunistas.
A doença celíaca é uma enfermidade inflamatória gastrointestinal desencadeada pelo glúten. Está frequentemente associada a sintomas neurológicos que vão desde ataxia, neuropatia, cefaleia, comprometimento cognitivo e distúrbios psiquiátricos, embora a doença celíaca provavelmente não seja a causa primária dessas condições. O envolvimento neurológico tem sido atribuído a deficiências nutricionais, incluindo deficiências de vitamina B12, vitamina E, folato, zinco ou cobre, devido à perda de proteínas e enzimas da borda em escova necessárias para a absorção desses nutrientes, como também relacionado à inflamação. A sobreposição de autoimunidade do sistema nervoso também pode contribuir para sintomas neurológicos, uma vez que anticorpos anti-transglutaminase foram relatados no SNC de pacientes com doença celíaca. De fato, a injeção intraventricular de anticorpos anti-transglutaminase em camundongos resultou em ataxia.
A síndrome do intestino irritável (SII) é definida por dor abdominal e alteração na função intestinal. Os critérios diagnósticos incluem dor abdominal recorrente, em média pelo menos 1 dia por semana nos últimos 3 meses, associada a duas das três condições a seguir: (1) dor ao evacuar, (2) alteração na frequência das fezes ou (3) mudança na aparência das fezes. Um clínico astuto pode perceber rapidamente que isso simplesmente categoriza os indivíduos com base nos sintomas e não fornece informações sobre os determinantes fisiopatológicos dos sintomas. Apesar do reconhecimento de que fatores genéticos, ambientais e imunológicos podem aumentar o risco de distúrbios gastrointestinais funcionais, muito poucos pacientes serão submetidos a uma avaliação clínica completa.
O componente inflamatório da SII inclui o aumento de células inflamatórias, como mastócitos e células T, na mucosa intestinal. Esses leucócitos estão localizados próximos aos nervos do sistema nervoso entérico que podem responder a produtos imunológicos, como citocinas e quimiocinas. O papel da inflamação também é comprovado por estudos de associação genômica ampla de pacientes com SII, identificando alelos de risco principais em genes relacionados ao sistema imunológico, como TNFSF15, que codifica o ligante 1A semelhante ao fator de necrose tumoral de citocina, e TLR9, que codifica um receptor do tipo Toll que detecta DNA derivado de micróbios. A SII também tem sido associada a condições autoimunes, incluindo artrite reumatóide e psoríase, embora autoanticorpos neurais sejam encontrados apenas raramente em pacientes com SII. Ainda assim, o estresse comumente exacerba os sintomas da SII, o que pode ser devido à indução de inflamação mediada por catecolaminas. Assim, o sistema imunológico emerge como um efetor crítico na SII que pode integrar sinais do sistema nervoso e da microbiota intestinal para dar origem à doença.
A gastroparesia é definida como uma síndrome de esvaziamento retardado do conteúdo gástrico sólido sem obstrução mecânica. Os pacientes apresentam sintomas que incluem náusea, saciedade precoce, plenitude pós-prandial, refluxo gastroesofágico, dor abdominal e, frequentemente, vômito. Embora o diabetes e o trauma cirúrgico tenham sido identificados como as principais etiologias da doença, a gastroparesia idiopática é de longe a mais comum. Na gastroparesia idiopática, disfunções imunológicas, neurológicas, neuro imunológicas, neuromusculares, do tecido conjuntivo, genéticas e metabólicas podem estar subjacentes à doença.
Entre os mecanismos subestimados, devem ser consideradas etiologias neuro imunológicas como infecciosas e autoimunes. Curiosamente, alguns pacientes desenvolvem gastroparesia após infecções virais agudas, incluindo Epstein-Barr, Herpes simplex e vírus Varicella zoster. O desencadeamento viral de patologia neuro imune e/ou autoimunidade é um fenômeno bem estudado que pode levar à síndrome gástrica devido a danos imunomediados do sistema nervoso entérico. Além disso, a gastroparesia está associada a uma série de condições autoimunes, incluindo gastrite autoimune, síndrome de Sjögren e esclerodermia. De fato, citocinas inflamatórias e espécies reativas, incluindo interleucina-6, interleucina-1β, fator de necrose tumoral-α e óxido nítrico sintase induzível, têm sido associadas à motilidade intestinal prejudicada.
| Considerações diagnósticas |
Os testes baseados na cintilografia são considerados o método padrão-ouro para medir o trânsito gastrointestinal, no entanto, esses são limitados porque só podem fornecer informações relacionadas ao trânsito. Além disso, é limitada apenas a centros muito especializados. Isso se traduz em subdiagnóstico da grande maioria das dismotilidades do intestino delgado e do cólon. Testes baseados em manometria e análise de cápsula de motilidade (WMC) podem fornecer informações sobre medições de pressão intraluminal e coordenação de contrações musculares. Até muito recentemente, o primeiro era considerado o padrão-ouro para o diagnóstico de distúrbios complicados da motilidade gastrointestinal, pois se pensava que esta tecnologia poderia diferenciar entre uma patologia miopática e neuropática. No entanto, não conseguiu diferenciar de forma confiável distúrbios gastrointestinais. O WMC fornece medidas importantes de tempos de trânsito gastrointestinal regionais e globais, medições de pressão intraluminal, pH e medições de temperatura e tem sido incrivelmente útil para caracterizar os distúrbios de motilidade gastrointestinal secundários a distúrbios neurológicos subjacentes. Uma vantagem adicional do WMC, em relação à cintilografia, é que pode ser realizada fora de centros altamente especializados.
A sorologia é uma ferramenta útil para identificar processos autoimunes. Embora exista uma vasta gama de autoanticorpos específicos de neurônios, alguns são especialmente úteis no contexto de doenças gastrointestinais neuro imunes. Classicamente, estes anticorpos antineuronais são considerados processos para neoplásicos que surgem contra antígenos onconeurais expressos pelo ambiente tumoral, no entanto, podem surgir mesmo na ausência de um tumor. Os autoanticorpos associados à dismotilidade gastrointestinal incluem: anticorpo periférico, anticorpo citoplasmático de células de Purkinje tipo 1 e anticorpo do canal de cálcio tipo L do músculo liso.
Várias modalidades de imagem podem ser usadas para capturar sinais de inflamação e disfunção gastrointestinal. A tomografia computadorizada abdominal também é comumente usada para visualizar os intestinos e estruturas adjacentes para descobrir obstruções e outros problemas anatômicos que afetam o trato gastrointestinal. Da mesma forma, o FDG-PET/CT é um excelente método para a quantificação não invasiva da inflamação intestinal e tem sido extensivamente estudado em pacientes com DII. Estas modalidades são fundamentais para localizar o insulto inflamatório, no entanto, a imagem deve ser combinada com outros diagnósticos para determinar a causa subjacente. Específica para a inflamação do sistema nervoso, a inflamação pode ser mais difícil de detectar, a menos que seja profunda, mas a ressonância magnética do cérebro e da medula espinhal (com contraste) pode ser um teste útil para detectar lesões neuro inflamatórias. Da mesma forma, FDG-PET/CT pode ser útil e específico para encefalite autoimune.
| Considerações terapêuticas |
Os casos leves de SII são comumente tratados com modificações na dieta e no estilo de vida, evitando alimentos desencadeantes e controlando o estresse, embora manifestações mais graves de possam exigir medicamentos como pro cinéticos, anticolinérgicos, antagonistas de opioides, antidiarreicos ou antibióticos. Significativamente, os medicamentos direcionados aos mastócitos demonstraram ser benéficos na SII. O cromoglicato dissódico é um exemplo de tal agente, que reduz a liberação da triptase efetora principal dos mastócitos em biópsias jejunais e proporciona benefício sintomático aos pacientes com predominância de diarreia. A ebastina, um antagonista do receptor 1 da histamina, tem como alvo a sinalização de outro produto importante dos mastócitos, a histamina, e descobriu-se que alivia a dor abdominal associada à SII.
Embora a gastroparesia seja tratada sintomaticamente com medicamentos antieméticos e pro cinéticos ou com dispositivos de estimulação elétrica gástrica, um subconjunto não responde a essas intervenções. Em um estudo retrospectivo de pacientes com gastroparesia resistente a medicamentos e dispositivos com evidência de neuro inflamação, conforme determinado pela presença de anticorpos antidescarboxilase do ácido glutâmico e inflamação na biópsia gástrica de espessura total, a imunoglobulina intravenosa melhorou náuseas, vômitos e dor abdominal. Isto foi seguido por um estudo prospectivo em uma pequena coorte de pacientes com gastroparesia refratária com evidência de disfunção imunológica e benefício sintomático semelhante da IVIG.
Com reconhecimento e caracterização apropriados, os distúrbios neurológicos inflamatórios e autoimunes proporcionam ao médico uma oportunidade de melhorar a qualidade de vida dos pacientes com disfunção neurológica e gastrointestinal concomitante.
| Conclusão |
Pacientes com distúrbios neurológicos inflamatórios e autoimunes geralmente apresentam sintomas gastrointestinais associados que passam despercebidos. Os profissionais de Neurologia e Gastroenterologia não devem mais ficar satisfeitos em rotular pacientes com distúrbios funcionais, especialmente quando esses pacientes apresentam sintomas multissistêmicos. Nesses casos, tanto os neurologistas como os gastroenterologistas podem, individualmente, não ter formação ou capacidade para abordar estas doenças interdisciplinares e, portanto, devem trabalhar em estreita colaboração.